A. | B. |
C.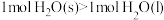 | D.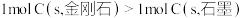 |
| A.ΔH>0,ΔH-TΔS<0 | B.ΔH<0,ΔH-TΔS>0 |
| C.ΔH>0,ΔH-TΔS>0 | D.ΔH<0,ΔH-TΔS<0 |
| A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.测定溶液pH时,润湿pH试纸不一定会对结果产生影响 |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率ν(H2)和氢气的平衡转化率均增大 2NH3(g) △H<0,其他条件不变时升高温度,反应速率ν(H2)和氢气的平衡转化率均增大 |
| D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| A.吸热反应只有加热才能发生 |
| B.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| C.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH>0 |
| D.N2(g)+3H2(g)=2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
5 . (1)试运用盖斯定律回答下列问题:
(1)已知:H2O(g)===H2O(l) ΔH1= -Q1kJ·mol-1
C2H5OH(g)===C2H5OH(l) ΔH2= -Q2kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3= -Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
(2)碳(s)在氧气供应不充分时,生成CO的同时还生成部分CO2,因此无法通过实验直接测得反应C(s)+ O2(g)=CO(g)的ΔH。但可设计实验,利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有
O2(g)=CO(g)的ΔH。但可设计实验,利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有
计算丙烷的燃烧热有两种途径:
途径Ⅰ:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-a kJ·mol-1。
途径Ⅱ:C3H8(g)===C3H6(g)+H2(g) ΔH=+b kJ·mol-1;
2C3H6(g)+9O2(g)===6CO2(g)+6H2O(l) ΔH=-c kJ·mol-1;
2H2(g)+O2(g)===2H2O(l) ΔH=-d kJ·mol-1(a、b、c、d均为正值)。
请回答下列问题:
(3)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
(4)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量
(5)b与a、c、d的数学关系式是
 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。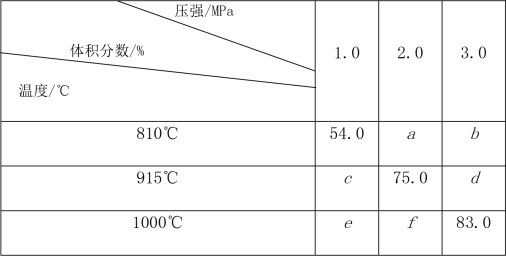
①b>f ②915℃,2.0MPa时E的转化率为60% ③该反应的ΔS<0 ④K(1000℃)<K(810℃)
上述①~④中正确的有( )
| A.4个 | B.3个 | C.2个 | D.1个 |
| A.反应焓变是决定反应能否自发进行的唯一因素 |
| B.温度、压强一定时,熵增加的反应一定能自发进行 |
| C.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| D.固体的溶解过程只与焓变有关 |
| A.ΔH>0、ΔS<0 | B.ΔH<0、ΔS>0 |
| C.ΔH>0、ΔS>0 | D.ΔH<0、ΔS<0 |
| A.在任何温度下都能自发进行 | B.仅在低温下自发进行 |
| C.仅在高温下自发进行 | D.在任何温度下都不能自发进行 |
| A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)] |
| B.NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
C.CaCO3(s)  CaO(s)+CO2(g) △H>0能否自发进行与温度有关 CaO(s)+CO2(g) △H>0能否自发进行与温度有关 |
| D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的 △H>0 |



