解题方法
1 . 在碳循环中,以 为原料生产尿素的反应历程与能量变化示意图如图所示。
为原料生产尿素的反应历程与能量变化示意图如图所示。
_______ 0(填“>”、“<”或“=”)。从图像分析决定生产尿素的总反应的反应速率的步骤是第_______ 步反应,并说明理由______________ 。
 为原料生产尿素的反应历程与能量变化示意图如图所示。
为原料生产尿素的反应历程与能量变化示意图如图所示。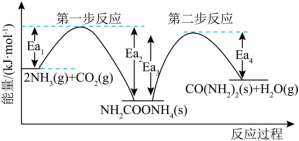

您最近一年使用:0次
解题方法
2 . 一个化学反应在给定条件(通常指温度、压强)下能否自发进行以及在什么条件下有可能按预期的方向发生,需寻求一种客观的判据,用它来判断一个化学反应能否正向自发进行。研究表明,可逆反应在适当条件下进行一段时间后一定会达到化学平衡状态。在研究了大量实验的基础上,人们发现可以用化学平衡常数来定量描述化学反应的限度。
(1)下列关于自发反应的叙述,正确的是___________。
(2)下列说法中正确的是___________。
(3)某温度下,可逆反应 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。
(4)在一定温度下,下列反应的化学平衡常数数值如下:
①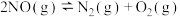
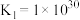
②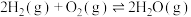
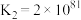
③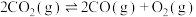
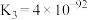
下列说法正确的是___________。
(5)在某密闭容器中把CO和 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。
(6)地下水中的氮污染主要是由 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: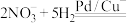

①氮肥 溶于水的过程中熵值
溶于水的过程中熵值___________ (填“增大”或“减小”),Pd/Cu双金属催化剂___________ (填“是”或“不是”)决定反应自发发生的决定因素。
②已知: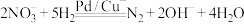 的
的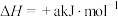 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应___________ (填“能”“不能”或“无法判断是否能”)自发进行。
(7)在一定体积的密闭容器中进行如下化学反应:
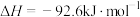 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:
①试判断
___________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
②T℃( )的某时刻下,
)的某时刻下, ,
,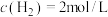 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态___________ (选填“是”或“否”),此时反应速率是
___________  (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是___________ 。
(1)下列关于自发反应的叙述,正确的是___________。
| A.自发反应的逆过程在相同条件下也必定是自发的 |
| B.铁在潮湿的空气中生锈属于非自发反应 |
| C.自发过程可以是物理过程,不一定是自发反应,而自发反应一定是自发过程 |
| D.自发反应与外界条件无关 |
A.若 , , ,化学反应在任何温度下都能自发进行 ,化学反应在任何温度下都能自发进行 |
B.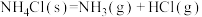 在室温下不能自发进行,则该反应的 在室温下不能自发进行,则该反应的 |
C. 在低温下能自发进行,则该反应的 在低温下能自发进行,则该反应的 |
| D.加入合适的催化剂能降低反应的活化能,从而改变反应的焓变 |
 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。| A.温度越高,K一定越大 |
B.如果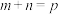 ,则 ,则 |
| C.若缩小反应器的容积,增大压强,则K增大 |
| D.K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
①
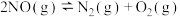
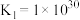
②
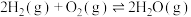
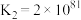
③
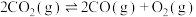
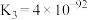
下列说法正确的是___________。
A.该温度下,反应①的平衡常数表达式为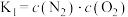 |
B.该温度下,反应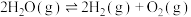 的平衡常数的数值约为 的平衡常数的数值约为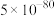 |
C.该温度下,反应①、反应②的逆反应、反应③产生 的倾向由大到小的顺序为 的倾向由大到小的顺序为 |
| D.以上说法都不正确 |
 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。| A.40% | B.50% | C.60% | D.83.3% |
 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: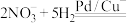

①氮肥
 溶于水的过程中熵值
溶于水的过程中熵值②已知:
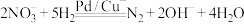 的
的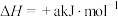 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应(7)在一定体积的密闭容器中进行如下化学反应:

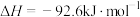 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:| T℃ | 25 | 125 | 225 |
| K | 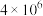 |  |  |

 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)②T℃(
 )的某时刻下,
)的某时刻下, ,
,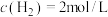 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态
 (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是
您最近一年使用:0次
名校
3 . 对于在一定条件下进行的化学反应,改变下列条件,可以提高反应物中的活化分子百分数的是
①升高温度②加入催化剂③增大体系压强④增大反应物浓度
①升高温度②加入催化剂③增大体系压强④增大反应物浓度
| A.①② | B.②③ | C.③④ | D.①④ |
您最近一年使用:0次
名校
4 . 如图(E表示活化能)是 与
与 生成
生成 的反应过程中能量变化关系图,下列说法正确的是
的反应过程中能量变化关系图,下列说法正确的是
 与
与 生成
生成 的反应过程中能量变化关系图,下列说法正确的是
的反应过程中能量变化关系图,下列说法正确的是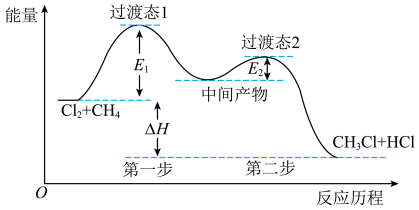
| A.第一步反应吸收的热量大于第二步反应放出的热量 |
| B.升高温度,活化分子的百分数不变,但反应速率加快 |
C.增大 的浓度,可提高反应速率,但不影响 的浓度,可提高反应速率,但不影响 的大小 的大小 |
| D.第一步反应的速率大于第二步反应 |
您最近一年使用:0次
2024-01-09更新
|
153次组卷
|
3卷引用:上海市吴淞中学2023-2024学年高二上学期第二次学科质量检测 化学试卷
名校
5 . 钒(23V)广泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。
(1)基态钒原子的价电子排布式为___________ ,与钒同周期的所有元素的基态原子中,未成对电子数最多的是___________ (填元素符号)。
(2)V2O5 溶解在 NaOH 溶液中,可得到钒酸钠(Na3VO4),已知 空间构型与
空间构型与 相同。
相同。
① 中心原子价层孤电子对数目为
中心原子价层孤电子对数目为______ 。
A.0 B.1 C.2 D.3
②短周期元素形成的各微粒中,与 空间构型相同的正离子有
空间构型相同的正离子有______ (任写一种)。
(3)V2O5 常用作 SO2 转化为 SO3 的催化剂。一定条件下,在固定容积的密闭容器中充入 SO2与空气的混合气体,加入一定量 V2O5,反应 t min 后,容器中 SO2 和 SO3 物质的量浓度分别为 a mol·L-1 和 b mol·L-1。
①SO2 起始物质的量浓度为______ mol·L-1(用含 a、b 的代数式表示)。
②这段时间内用 O2 表示的平均化学反应速率为______ mol/(L·min)-1(用含 a、b、t的代数式表示)。
③在未使用催化剂时,SO2 氧化反应的能量变化如图所示。加入 V2O5 后,会使图中______ 。

A.E1 增大、E3 减小 B.E1减小、E2增大
C.E2 减小、E3不变 D.E2减小、E3 增大
(4)用活化后的 V2O5 作催化剂,在有氧条件下氨气将 NO 还原成 N2 的一种反应历程如图所示。
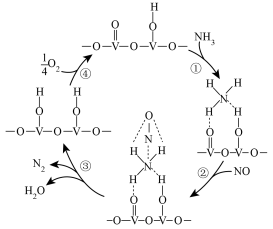
①上述历程中,钒元素被氧化的过程有______ (填序号);写出总反应的化学方程式:___________ 。
②按上述图中 NH3、NO 和 O2 的比例进行催化脱硝反应。反应一定的时间,NH3 和 NO 的转化率与温度的关系如图所示。超过 200℃后,NO 转化率急剧下降,而 NH3 仍维持较高,原因可能是:___________ 。

(1)基态钒原子的价电子排布式为
(2)V2O5 溶解在 NaOH 溶液中,可得到钒酸钠(Na3VO4),已知
 空间构型与
空间构型与 相同。
相同。①
 中心原子价层孤电子对数目为
中心原子价层孤电子对数目为A.0 B.1 C.2 D.3
②短周期元素形成的各微粒中,与
 空间构型相同的正离子有
空间构型相同的正离子有(3)V2O5 常用作 SO2 转化为 SO3 的催化剂。一定条件下,在固定容积的密闭容器中充入 SO2与空气的混合气体,加入一定量 V2O5,反应 t min 后,容器中 SO2 和 SO3 物质的量浓度分别为 a mol·L-1 和 b mol·L-1。
①SO2 起始物质的量浓度为
②这段时间内用 O2 表示的平均化学反应速率为
③在未使用催化剂时,SO2 氧化反应的能量变化如图所示。加入 V2O5 后,会使图中

A.E1 增大、E3 减小 B.E1减小、E2增大
C.E2 减小、E3不变 D.E2减小、E3 增大
(4)用活化后的 V2O5 作催化剂,在有氧条件下氨气将 NO 还原成 N2 的一种反应历程如图所示。

①上述历程中,钒元素被氧化的过程有
②按上述图中 NH3、NO 和 O2 的比例进行催化脱硝反应。反应一定的时间,NH3 和 NO 的转化率与温度的关系如图所示。超过 200℃后,NO 转化率急剧下降,而 NH3 仍维持较高,原因可能是:

您最近一年使用:0次
6 . 已知相同条件下,反应
 ,在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法
,在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法不正确 的是______。(双选)
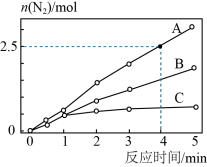

 ,在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法
,在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法
| A.单位时间内H—O键与N—H键断裂的数目相等时,说明反应已经达到平衡 |
| B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡 |
C.该反应的活化能大小顺序是: |
| D.增大压强能使反应速率加快,是因为增加了活化分子百分数 |
您最近一年使用:0次
名校
7 . 尿素是一种重要的氮肥,也是一种化工原料。合成尿素能回收利用二氧化碳,实现碳的固定。
(1)合成尿素分图示的两步进行:
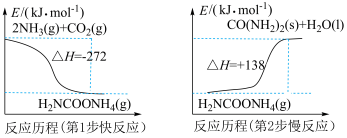
反应 的反应热为
的反应热为_______ 。
(2)某课题组使用氢氧化铟 纳米晶电催化剂直接由
纳米晶电催化剂直接由 和
和 高选择性地合成
高选择性地合成 。
。

①上述 和
和 转化中,被还原的物质是
转化中,被还原的物质是_______ (填化学式)。
②上述转化中,控速步骤是_______ (填标号)。
A. B.
B.
C. D.
D.
(3)在恒温恒容密闭容器中投入1mol 和2mol
和2mol 合成尿素,原理是
合成尿素,原理是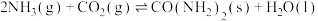 。下列表明该反应达到平衡状态的是_______。
。下列表明该反应达到平衡状态的是_______。
(4)在恒容密闭容器中发生反应: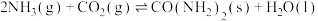 ,测得
,测得 的平衡转化率与起始投料比[
的平衡转化率与起始投料比[ ,
, 分别为1:1、2:1、3:1]、温度关系如图。①在相同投料比下,升高温度,
分别为1:1、2:1、3:1]、温度关系如图。①在相同投料比下,升高温度, 的平衡转化率降低的主要原因是
的平衡转化率降低的主要原因是_______ 。
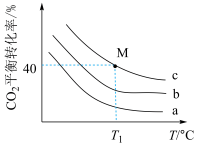
②曲线a代表的投料比为_______ 。
③若 下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,
下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内, 分压的平均变化率为
分压的平均变化率为_______ 
(1)合成尿素分图示的两步进行:

反应
 的反应热为
的反应热为(2)某课题组使用氢氧化铟
 纳米晶电催化剂直接由
纳米晶电催化剂直接由 和
和 高选择性地合成
高选择性地合成 。
。
①上述
 和
和 转化中,被还原的物质是
转化中,被还原的物质是②上述转化中,控速步骤是
A.
 B.
B.
C.
 D.
D.
(3)在恒温恒容密闭容器中投入1mol
 和2mol
和2mol 合成尿素,原理是
合成尿素,原理是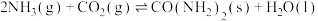 。下列表明该反应达到平衡状态的是_______。
。下列表明该反应达到平衡状态的是_______。| A.气体密度不随时间变化 | B. 体积分数不随时间变化 体积分数不随时间变化 |
| C.气体总压强不随时间变化 | D. 、 、 的转化率之比不随时间变化 的转化率之比不随时间变化 |
(4)在恒容密闭容器中发生反应:
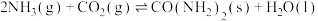 ,测得
,测得 的平衡转化率与起始投料比[
的平衡转化率与起始投料比[ ,
, 分别为1:1、2:1、3:1]、温度关系如图。①在相同投料比下,升高温度,
分别为1:1、2:1、3:1]、温度关系如图。①在相同投料比下,升高温度, 的平衡转化率降低的主要原因是
的平衡转化率降低的主要原因是
②曲线a代表的投料比为
③若
 下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,
下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内, 分压的平均变化率为
分压的平均变化率为
您最近一年使用:0次
2023-12-14更新
|
67次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期10月月考化学试卷
名校
解题方法
8 . 自科学家们开始研究物质的结构与性质以来,氢元素时常担任主角,例如氢原子光谱启发了人们对原子结构的探索。此外,氢气与氢能源也是时下热门的一种绿色能源。氢能是最具发展潜力的清洁能源,但当下的生产条件非常苛刻且纯度不高。因此,科学家们正在寻找更经济、环境友好的方法,电解水便是其中一种。
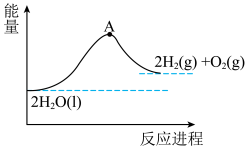
(1)已知在298K和100kPa的条件下,液态水分解生成氢气: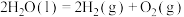
 。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如
。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如 ,那么图中A点将
,那么图中A点将___________ (填“升高”、“降低”或“不变”)。
(2)部分化学键的键能和反应焓变的数据如下:
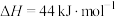 ,
, ,
,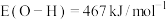 ,
,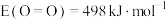 ,由此可计算得上述反应的
,由此可计算得上述反应的 为
为___________ 。又知该反应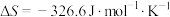 ,那么该反应在298K条件下能否自发进行?
,那么该反应在298K条件下能否自发进行?___________ 。
(3)试从绿色化学的角度比较并评价直接电解海水与太阳能( 作催化剂)分解淡水两种制备氢气的方案
作催化剂)分解淡水两种制备氢气的方案___________ 。
(1)已知在298K和100kPa的条件下,液态水分解生成氢气:
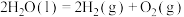
 。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如
。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如 ,那么图中A点将
,那么图中A点将
(2)部分化学键的键能和反应焓变的数据如下:

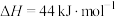 ,
, ,
,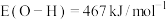 ,
,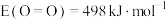 ,由此可计算得上述反应的
,由此可计算得上述反应的 为
为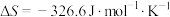 ,那么该反应在298K条件下能否自发进行?
,那么该反应在298K条件下能否自发进行?(3)试从绿色化学的角度比较并评价直接电解海水与太阳能(
 作催化剂)分解淡水两种制备氢气的方案
作催化剂)分解淡水两种制备氢气的方案
您最近一年使用:0次
名校
解题方法
9 . 反应CO2 (g) + 3H2(g)⇌CH3OH(g) + H2O (g)通过如下步骤来实现:①CO2 (g) +H2(g) ⇌CO(g) + H2O (g) ②CO(g) +2H2(g) ⇌CH3OH(g);上述反应过程中能量变化可用如图表示,

其中反应_______ 为慢反应(填“①”或“②”)。对反应②自发性的判断正确的是_______ ,判断依据是_______ 。
A.高温下自发 B.低温下自发 C.始终自发 D.始终不自发

其中反应
A.高温下自发 B.低温下自发 C.始终自发 D.始终不自发
您最近一年使用:0次
名校
10 . CO2可与H2生成CH4:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。
(1)我国科研人员提出了以Ni/Al2O3为催化剂,上述反应的历程如图所示:

下列说法错误的是_______。
(2)在恒温(T>100℃)恒容装置中进行该反应,能判断反应已达平衡状态的是_______。
(3)将1mol CO2和4mol H2置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度升高而_______ (填“增大”或“减小”)。判断依据是_______ 。

(4)下列措施有利于提高反应中CO2的平衡转化率的是_______。
(1)我国科研人员提出了以Ni/Al2O3为催化剂,上述反应的历程如图所示:

下列说法错误的是_______。
| A.使用催化剂可有效提高反应物的平衡转化率 |
| B.该历程中每生成1mol CH4,转移8NA个电子 |
| C.在反应历程中,H-H键与C=O键断裂吸收能量 |
| D.在反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能 |
(2)在恒温(T>100℃)恒容装置中进行该反应,能判断反应已达平衡状态的是_______。
| A.混合气体密度不再改变 | B.混合气体压强不再改变 |
| C.混合气体平均摩尔质量不再改变 | D.n (CO2): n(H2) =1:4 |
(3)将1mol CO2和4mol H2置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度升高而

(4)下列措施有利于提高反应中CO2的平衡转化率的是_______。
| A.使用催化剂 | B.加压 | C.升高温度 | D.增大初始投料比n(CO2)/n(H2) |
您最近一年使用:0次



