名校
1 . 下列说法正确的是( )
| A.因为反应物浓度越大,反应速率越快,所以常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸中,浓硝酸中铝片先溶解完 |
| B.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
C.N2(g)+3H2(g) 2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大 2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大 |
| D.对于反应2H2O2===2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
您最近一年使用:0次
2019-11-14更新
|
145次组卷
|
2卷引用:安徽省蚌埠市第二中学2019-2020学年高二上学期期中考试化学试题
名校
2 . 下列说法中正确的是( )
| A.选用适当的催化剂,分子运动加快,增加了碰撞频率,故化学反应速率增大 |
| B.反应:CaCO3(s)=CaO(s)+CO2(g)ΔH>0,在低温时能自发进行 |
| C.增大压强,平衡向正反应方向移动,平衡常数K值增大 |
| D.H+和OH-的反应活化能接近于零,反应几乎在瞬间完成 |
您最近一年使用:0次
2019-11-14更新
|
248次组卷
|
2卷引用:安徽省蚌埠市第二中学2019-2020学年高二上学期期中考试化学试题
18-19高三·浙江·期中
名校
3 . 研究反应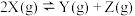 的速率影响因素,在不同条件下进行4组实验,
的速率影响因素,在不同条件下进行4组实验, 起始浓度为0,反应物
起始浓度为0,反应物 的浓度
的浓度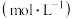 随反应时间(min)的变化情况如图所示。下列说法
随反应时间(min)的变化情况如图所示。下列说法不正确 的是
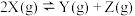 的速率影响因素,在不同条件下进行4组实验,
的速率影响因素,在不同条件下进行4组实验, 起始浓度为0,反应物
起始浓度为0,反应物 的浓度
的浓度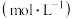 随反应时间(min)的变化情况如图所示。下列说法
随反应时间(min)的变化情况如图所示。下列说法
| A.比较实验②、④得出:升高温度,化学反应速率加快 |
| B.比较实验①、④得出:升高温度,化学反应速率加快 |
| C.实验③有可能使用了催化剂,催化剂加快正反应速率,对逆反应无影响 |
D.在0~10min之间,实验②的平均速率 |
您最近一年使用:0次
2019-11-12更新
|
242次组卷
|
7卷引用:安徽省宣城市六校2021-2022学年高二上学期期中联考化学试题
名校
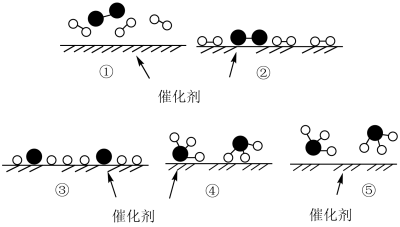
4 . 工业上,合成氨反应N2 + 3H2 2NH3的微观历程如图所示。用
2NH3的微观历程如图所示。用 、
、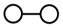 、
、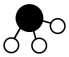 分别表示N2、H2、NH3,下列说法不正确的是
分别表示N2、H2、NH3,下列说法不正确的是
 2NH3的微观历程如图所示。用
2NH3的微观历程如图所示。用 、
、 、
、 分别表示N2、H2、NH3,下列说法不正确的是
分别表示N2、H2、NH3,下列说法不正确的是
| A.①→② 催化剂在吸附N2、H2时,未形成新的化学键 |
| B.②→③ 形成N原子和H原子是放热过程 |
| C.③→④形成了新的化学键 |
| D.使用合适的催化剂,能提高合成氨反应的速率 |
您最近一年使用:0次
2019-11-03更新
|
416次组卷
|
7卷引用:安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题
5 . 下列实验不能 达到目的的是
| 选项 | 目的 | 实验 |
| A | 制取较高浓度的次氯酸溶液 | 将Cl2通入碳酸钠溶液中 |
| B | 加快氧气的生成速率 | 在过氧化氢溶液中加入少量MnO2 |
| C | 除去乙酸乙酯中的少量乙酸 | 加入饱和碳酸钠溶液洗涤、分液 |
| D | 制备少量氨气 | 向氢氧化钠固体上滴加浓氨水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
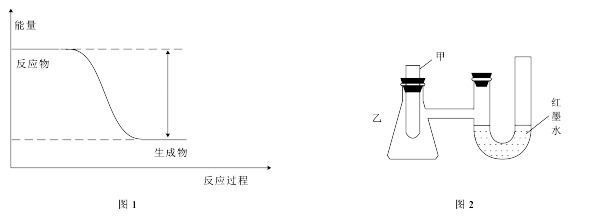
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为__________ (填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是__________ 。
③若要使该反应的反应速率加快,下列措施可行的是__________ (填字母)。
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
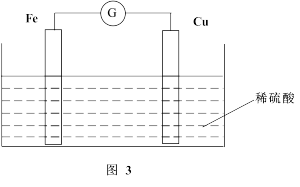
①铜为__________ (填“正”或“负”)极;负极的电极反应式为______ 。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是__________ L。

(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是
③若要使该反应的反应速率加快,下列措施可行的是
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。

①铜为
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是
您最近一年使用:0次
2019-10-12更新
|
197次组卷
|
5卷引用:安徽省蚌埠第三中学2020-2021学年高一下学期5月教学质量检测化学试题
名校
7 . H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
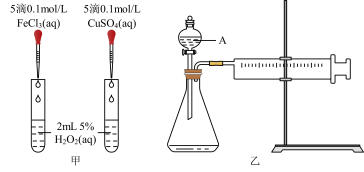
(1)若利用图甲装置,可通过观察__________ 现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________ 。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________ 。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________ ,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________ 。
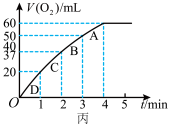
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________ 。H2O2初始物质的量浓度为_______ (保留两位小数)。

(1)若利用图甲装置,可通过观察
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:

您最近一年使用:0次
2019-09-20更新
|
445次组卷
|
10卷引用:安徽省定远县育才学校2019-2020学年高一下学期期末考试化学试题
安徽省定远县育才学校2019-2020学年高一下学期期末考试化学试题云南省盈江县一中2019-2020学年高二上学期开学考试化学试题人教版高中化学必修二第二单元《化学反应与能量》测试卷2019-2020人教版高中化学必修2第二章《化学反应与能量》测试卷2020年人教版高中化学必修2第二章《化学反应与能量》测试卷12020年春季苏教版高中化学必修2专题二《化学反应与能量转化》测试卷(已下线)2.1.2 影响化学反应速率的因素(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)云南省普洱市第一中学2021-2022学年高一下学期3月份考试化学试题云南省石屏县第一中学2021-2022学年高一下学期3月份考试化学试题云南省广南县第一中学校2021-2022学年高一下学期3月份考试化学试题
名校
8 . 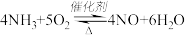 是工业上制硝酸的重要反应,下列有关说法
是工业上制硝酸的重要反应,下列有关说法错误 的是
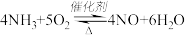 是工业上制硝酸的重要反应,下列有关说法
是工业上制硝酸的重要反应,下列有关说法| A.使用催化剂可以加快反应速率 |
| B.增大压强可以加快反应速率 |
| C.达到平衡时,V(正)=V(逆) |
| D.增大O2的浓度可以使NH3全部转变为NO |
您最近一年使用:0次
2019-08-31更新
|
458次组卷
|
12卷引用:安徽省宣城市2018-2019学年高一下学期期末考试化学试题
安徽省宣城市2018-2019学年高一下学期期末考试化学试题【省级联考】江苏省2019届高三下学期小高考模拟化学试题辽宁省大连市普兰店市第一中学2019-2020学年高二上学期期末考试化学试题(已下线)2.4 化学反应的调控(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)第二章检测-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)江苏省常州市武进区礼嘉中学2020-2021学年高一下学期阶段质量调研化学试题湖北省罗田第一中学2021-2022学年高二10月月考化学试题云南省通海县第一中学2021-2022学年高一下学期3月月考化学试题(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)江苏省常州市联盟学校2022-2023学年高一下学期期末考试化学试题江苏省扬州市广陵区红桥高级中学2023-2024学年高一下学期4月期中考试化学试题(已下线)专题01 化学反应与能量变化-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)
名校
9 . 可逆反应 的v-t图像如图甲所示。若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。下列判断
的v-t图像如图甲所示。若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。下列判断不正确 的是
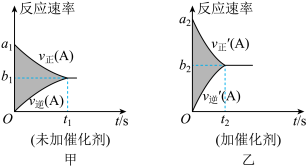
 的v-t图像如图甲所示。若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。下列判断
的v-t图像如图甲所示。若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。下列判断
| A.a1<a2 | B.平衡时图甲和图乙中反应速率相等 |
| C.t1>t2 | D.平衡时图甲和图乙中反应限度相同 |
您最近一年使用:0次
2019-08-25更新
|
692次组卷
|
6卷引用:安徽省蚌埠市第二中学2019-2020学年高二上学期期中考试化学试题
名校
10 . 反应A(g)+2B(g)C(g)+D(g)+QkJ的能量变化如图所示,有关叙述正确的是
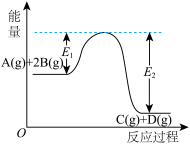

| A.Q=E2 |
| B.在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 |
| C.Q>0,升高温度,正反应速率增大,逆反应速率减小 |
| D.若减小体积,平衡会移动,当反应再次达到平衡时,A的平衡浓度增大 |
您最近一年使用:0次
2019-08-18更新
|
1142次组卷
|
6卷引用:安徽省蚌埠田家炳中学、蚌埠五中2020-2021学年高二上学期期中考试化学试题



