名校
1 . 常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可氢气反应生成烷,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
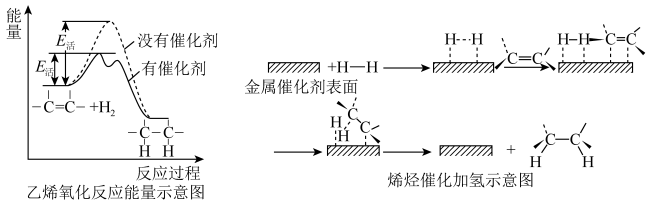
下列说法中正确的是

下列说法中正确的是
| A.乙烯和H2生成乙烷的反应是吸热反应 |
| B.加入催化剂,可减小反应的热效应 |
| C.催化剂能改变平衡转化率,不能改变化学平衡常数 |
| D.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体 |
您最近一年使用:0次
2017-02-17更新
|
192次组卷
|
7卷引用:安徽省滁州市定远县育才学校2019-2020学年高二上学期期末考试(普通班)化学试题
2 . 已知HI在催化剂作用下分解速率会加快,其能量随反应进程的变化如图所示。下列说法正确的是
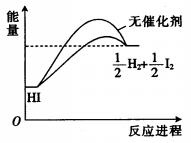

| A.加入催化剂,减小了反应的活化能 | B.加入催化剂,可提高HI的平衡转化率 |
| C.降低温度,HI的分解速率加快 | D.反应物的总能量大于生成物的总能量 |
您最近一年使用:0次
2017-02-17更新
|
312次组卷
|
4卷引用:安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题
名校
解题方法
3 . 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大。小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证。
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
【实验目的】探究草酸与高锰酸钾反应的速率变化“异常”原因
【实验用品】仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;
试剂:0.1mol/L H2C2O4溶液、0.05mol/L KMnO4(硫酸酸化)溶液等。
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容。
(1)草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为______________
(2)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是_______________
(3)猜想Ⅱ可是:___________________
要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂及一种仪器,分别是_______________
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容_____________ 。
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
【实验目的】探究草酸与高锰酸钾反应的速率变化“异常”原因
【实验用品】仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;
试剂:0.1mol/L H2C2O4溶液、0.05mol/L KMnO4(硫酸酸化)溶液等。
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容。
(1)草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为
(2)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是
(3)猜想Ⅱ可是:
要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂及一种仪器,分别是
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容
| 试管A | 试管B | |
| 加入试剂 | ||
| 实验现象(褪色时间) | ||
| 结论 | 猜想Ⅱ正确 | |
您最近一年使用:0次
2016-12-09更新
|
298次组卷
|
4卷引用:2016-2017学年安徽省淮南二中高二上第一次月考化学试卷
名校
4 . 一定条件下,乙醛可发生分解:CH3CHO(l)→CH4+CO,已知该反应的活化能为190 kJ·mol-1。 在含有少量I2的溶液中,该反应的机理如下:
反应Ⅰ:CH3CHO+I2 CH3I+HI+CO(慢)
CH3I+HI+CO(慢)
反应Ⅱ:CH3I+HI CH4+I2(快)
CH4+I2(快)
下列有关该反应的叙述正确的是 ( )
反应Ⅰ:CH3CHO+I2
 CH3I+HI+CO(慢)
CH3I+HI+CO(慢)反应Ⅱ:CH3I+HI
 CH4+I2(快)
CH4+I2(快)下列有关该反应的叙述正确的是 ( )
| A.反应速率与I2的浓度有关 | B.HI在反应Ⅰ中是氧化产物 |
| C.反应焓变的绝对值等于190 kJ·mol-1 | D.乙醛的分解速率主要取决于反应Ⅱ |
您最近一年使用:0次
2016-12-09更新
|
311次组卷
|
4卷引用:安徽师范大学附属中学2017-2018学年高一下学期期末考试化学试题
名校
解题方法
5 . 某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
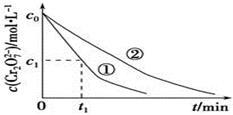
测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化的离子方程式为____________________
(3)实验①和②的结果表明________________ ;实验①中0~t1时间段反应速率v(Cr3+)=________________ mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:____________________ ;
假设三:____________________ ;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定)
________________________ 。
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |

测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化的离子方程式为
(3)实验①和②的结果表明
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:
假设三:
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
您最近一年使用:0次
2016-12-09更新
|
448次组卷
|
2卷引用:安徽省马鞍山市含山县含山中学2020-2021学年高二上学期第一次月考化学试题
9-10高一下·黑龙江鹤岗·期末
名校
6 . 下列实验中,反应速率加快是由催化剂引起的是
| A.在炭粉中加入KClO3 ,点燃时燃烧更为剧烈 |
| B.H2O2中加入少量FeCl3,即可迅速放出气体 |
| C.将炭块粉碎成粉末状,可使燃烧更加充分 |
| D.锌与稀硫酸反应中加入少量硫酸铜,产生氢气速率加快 |
您最近一年使用:0次
名校
解题方法
7 . 下列有关物质的性质或应用正确的是
| A.单质硅用于制造芯片和光导纤维 |
| B.浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 |
| C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D.30%的H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
您最近一年使用:0次
2016-12-09更新
|
1537次组卷
|
5卷引用:安徽省肥东县高级中学2020-2021学年高二上学期第二次月考化学试题
安徽省肥东县高级中学2020-2021学年高二上学期第二次月考化学试题黑龙江省大庆中学2018届高三上学期开学考试化学试题(已下线)2018年12月14日 《每日一题》人教必修1-常见非金属及其化合物的用途(已下线)2019年12月13日 《每日一题》化学人教版(必修1)——常见非金属及其化合物的用途河北省张家口市崇礼区第一中学2021届高三上学期期中考试化学试题
13-14高一·安徽芜湖·开学考试
名校
8 . 下列图像与对应实验完全吻合的是:
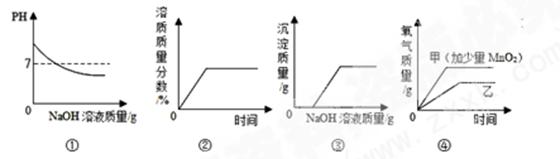

| A.①往一定量的盐酸中滴加NaOH溶液至过量 |
| B.②将一定量的不饱和KNO3溶液恒温蒸发水 |
| C.③向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液 |
| D.④用两份等质量等溶质质量分数的过氧化氢溶液制取氧气(甲加少量MnO2) |
您最近一年使用:0次
名校
9 . 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
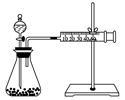
(1)该同学的实验目的是________________________ ;要得出正确的实验结论,还需控制的实验条件是________________________________________ 。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是____________________________ ;应该测定的实验数据是________________________________________________________________________ 。
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________ 的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是________ 。
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快 |

(1)该同学的实验目的是
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
您最近一年使用:0次
2016-12-09更新
|
1012次组卷
|
6卷引用:安徽省合肥市第十一中学2020-2021学年高二上学期第一次月考化学试题
安徽省合肥市第十一中学2020-2021学年高二上学期第一次月考化学试题(已下线)2010-2011学年辽宁省师大附中高一下学期期中考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2012-2013学年新疆乌鲁木齐市一中高一(平行班)下学期期中考试化学试卷(已下线)2012年鲁科版高中化学选修6 2反应条件对化学反应的影响练习卷(已下线)2013届新疆乌鲁木齐市一中高一下学期平行班期中考试化学试卷
解题方法
10 . 在下列事实中,什么因素影响了化学反应速率:
(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:_______ 。
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:_______ 。
(3)同浓度、同体积的盐酸中分别放入同样大小的锌粒和镁条,产生气体有快有慢:_______ 。
(4)夏天的食品易霉变,而冬天不易发生该现象:_______
(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:
(3)同浓度、同体积的盐酸中分别放入同样大小的锌粒和镁条,产生气体有快有慢:
(4)夏天的食品易霉变,而冬天不易发生该现象:
您最近一年使用:0次



