名校
1 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)与H2-O2燃料电池相比,氨易液化、运输和储存方便,安全性能更高。新型NH3-O2燃科电池原理如下图所示:OH-离子向________ 移动(填“电极1或“电极2”),电极2的反应式为___________ 。

(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是___________ 。
②列举一条既能提高速率又能提高原料转化率的措施___________ 。
(3)常温常压下电解法合成氨的原理如下图所示:
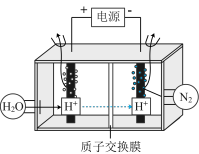
①阳极产生的气体是___________ 。
②阴极生成氨的电极反应式为___________ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。出该反应的电极反应式___________ 。
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有___________ 性。
(1)与H2-O2燃料电池相比,氨易液化、运输和储存方便,安全性能更高。新型NH3-O2燃科电池原理如下图所示:OH-离子向

(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是
②列举一条既能提高速率又能提高原料转化率的措施
(3)常温常压下电解法合成氨的原理如下图所示:

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。出该反应的电极反应式
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有
您最近半年使用:0次
解题方法
2 . 高纯硅用途广泛,SiHCl3是制备高纯硅的主要原料,制备SiHCl3主要有以下工艺。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是___________ (填“a”或“b”)。 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。
(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是___________ (填字母)。
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g) 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1
ⅱ.2SiHCl3(g) SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2
ⅲ.SiHCl3(g)+H2(g) Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3
ⅳ.SiCl4(g)+Si(s)+2H2(g) 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4
(3)ΔH4=___________ (写出代数式)。
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。___________ (填序号)。
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=___________ MPa-1(已知压强平衡常数的表达式为各气体物质的平衡分压替代物质的量浓度,气体的分压等于其物质的量分数乘以总压强)。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是
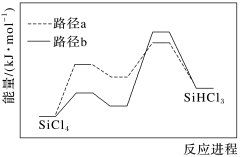
 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g)
 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1ⅱ.2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2ⅲ.SiHCl3(g)+H2(g)
 Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3ⅳ.SiCl4(g)+Si(s)+2H2(g)
 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4(3)ΔH4=
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。
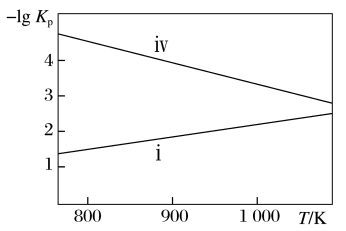
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=
您最近半年使用:0次
解题方法
3 . 甲醇用途广泛,可用作溶剂、防冻剂、燃料,也可用于生产生物柴油,利用合成气(主要成分为CO、CO2和H2)可以合成甲醇,涉及的反应如下,回答下列问题:
反应ⅰ:CO(g)+2H2(g) CH3OH(g) △H1=−91.5kJ∙mol−1
CH3OH(g) △H1=−91.5kJ∙mol−1
反应ii:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
反应iii:CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):___________ 。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式___________ 。
③m=___________ (计算结果保留两位有效数字,已知1eV=1.6×10−22kJ)。
(2)反应ⅰ的Arrhenius经验公式Rlnk=− +C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是
+C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是___________ 。 和CO的选择性
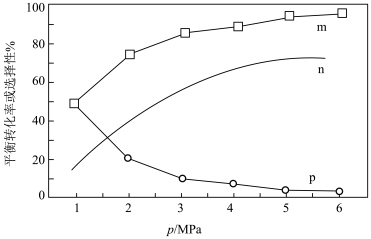
和CO的选择性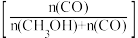 随压强变化曲线如图所示。
随压强变化曲线如图所示。___________ (填“m”“n”或“p”),简述判断方法___________ 。___________ mol·L−1·s−1(保留两位有效数字)。
反应ⅰ:CO(g)+2H2(g)
 CH3OH(g) △H1=−91.5kJ∙mol−1
CH3OH(g) △H1=−91.5kJ∙mol−1反应ii:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1反应iii:CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
CO(g)+H2O(g) △H3=+41.6kJ∙mol−1(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
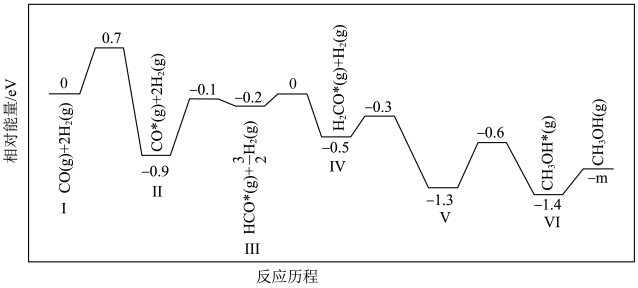
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式
③m=
(2)反应ⅰ的Arrhenius经验公式Rlnk=−
 +C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是
+C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是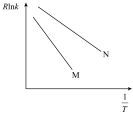
 和CO的选择性
和CO的选择性 随压强变化曲线如图所示。
随压强变化曲线如图所示。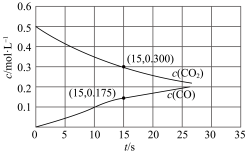
您最近半年使用:0次
名校
解题方法
4 . H2O2是一种常见试剂,在实验室、工业生产上有广泛用途。H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如下图甲、乙两种实验装置。
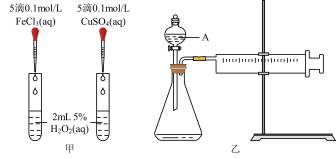
(1)若利用图甲装置,可通过观察___________ 现象,从而定性比较得出结论。
(2)有同学提出将0.1 FeCl3,改为
FeCl3,改为___________ 更为合理,其理由是___________ 。
(3)若利用乙实验可进行定量比较分析,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中还需要用到的实验仪器为___________ 。
(4)请简述如何用“微热法”检查装置乙的气密性良好:组装好实验装置,关闭分液漏斗活塞,___________ 。
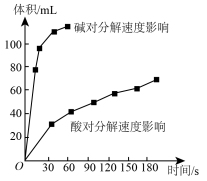
(5)如下图为某小组研究的酸、碱对H2O2分解的影响。该小组提出可以用BaO2固体与H2SO4溶液反应制H2O2,反应的化学方程式为___________ ,支持这一方案的理由是___________ 。
(6)使用催化剂Mn2+催化H2O2分解的反应中,Mn2+改变了___________ (填字母序号)
A.活化分子的浓度 B.反应限度 C.反应焓变
D.反应路径 E.反应活化能 F.活化分子百分数

(1)若利用图甲装置,可通过观察
(2)有同学提出将0.1
 FeCl3,改为
FeCl3,改为(3)若利用乙实验可进行定量比较分析,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中还需要用到的实验仪器为
(4)请简述如何用“微热法”检查装置乙的气密性良好:组装好实验装置,关闭分液漏斗活塞,
(5)如下图为某小组研究的酸、碱对H2O2分解的影响。该小组提出可以用BaO2固体与H2SO4溶液反应制H2O2,反应的化学方程式为

(6)使用催化剂Mn2+催化H2O2分解的反应中,Mn2+改变了
A.活化分子的浓度 B.反应限度 C.反应焓变
D.反应路径 E.反应活化能 F.活化分子百分数
您最近半年使用:0次
5 . 氨的用途十分广泛,是制造硝酸和氮肥的重要原料。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于___________ kJ
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
(3)已知合成氨反应的速率方程为:ν=kcα(N2)cβ(H2)c-1(NH3),在合成氨过程中,需要不断分离出氨,可能的原因为___________ 。
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①为进一步提高NH3的平衡转化率,下列措施能达到目的的是___________ (填标号)。
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g) NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/mol
b.NH2COONH4(1) CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是___________ (填“第一步”或“第二步”)。
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
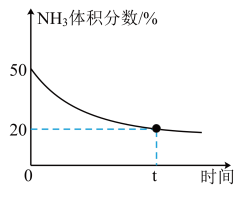
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=___________ MPa-2(已知:分压=总压×体积分数)。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
| A.容器内压强不变 | B.N2的体积分数不变 |
| C.气体的密度不再改变 | D.V正(N2)=3V逆(H2) |
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。①为进一步提高NH3的平衡转化率,下列措施能达到目的的是
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g)
 NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/molb.NH2COONH4(1)
 CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=
您最近半年使用:0次
名校
6 . 氨气在工农业生产中有着重要的用途,研究合成氨反应具有重要意义。
(1)直接常压电化学合成氨以纳米 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图-1所示:
。其工作原理如图-1所示:
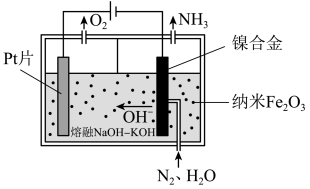
图-1
①阴极的电极反应式为___________ 。
②电解过程中,由于发生副反应,使得阴极制得的 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是___________ 。
(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图-2所示。合成氨反应的热化学方程式为___________ 。生成 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为___________ 。
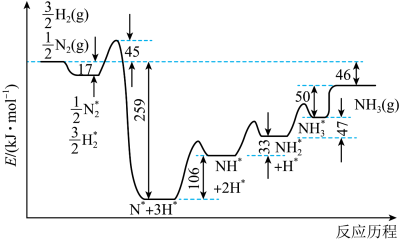
图-2
(3) 催化释氢可提供哈伯-博施合成氨反应所需的
催化释氢可提供哈伯-博施合成氨反应所需的 。在催化剂作用下,
。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图-3所示。
,可能的反应机理如图-3所示。
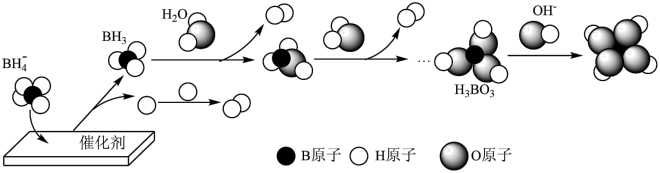
图-3
①其他条件不变时,以 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为___________ 。
②已知: 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是___________ (用离子方程式表示)。
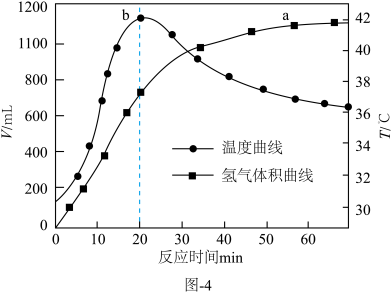
③在催化剂的作用下, 与水反应。释氢体积及温度随反应时间的变化如图-4所示。
与水反应。释氢体积及温度随反应时间的变化如图-4所示。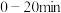 内,温度随时间快速升高的原因是
内,温度随时间快速升高的原因是___________ 。 后,氢气体积在增加,面温度却下降的原因是
后,氢气体积在增加,面温度却下降的原因是___________ 。
(1)直接常压电化学合成氨以纳米
 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图-1所示:
。其工作原理如图-1所示:
图-1
①阴极的电极反应式为
②电解过程中,由于发生副反应,使得阴极制得的
 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图-2所示。合成氨反应的热化学方程式为
 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为
图-2
(3)
 催化释氢可提供哈伯-博施合成氨反应所需的
催化释氢可提供哈伯-博施合成氨反应所需的 。在催化剂作用下,
。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图-3所示。
,可能的反应机理如图-3所示。
图-3
①其他条件不变时,以
 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为②已知:
 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是③在催化剂的作用下,
 与水反应。释氢体积及温度随反应时间的变化如图-4所示。
与水反应。释氢体积及温度随反应时间的变化如图-4所示。 内,温度随时间快速升高的原因是
内,温度随时间快速升高的原因是 后,氢气体积在增加,面温度却下降的原因是
后,氢气体积在增加,面温度却下降的原因是
您最近半年使用:0次
7 .  是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。
I. 不稳定、易分解,
不稳定、易分解, 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
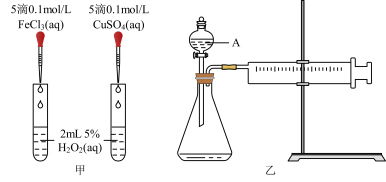
(1)若利用图甲装置,可通过观察___________ 现象,从而定性比较得出结论。
(2)有同学提出将 改为
改为___________  更为合理,其理由是
更为合理,其理由是___________ 。
(3)若利用乙实验可进行定量分析,实验时均以生成 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___________ 。
(4)如图为某小组研究的酸、碱对 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为___________ ,支持这一方案的理由是___________ 。
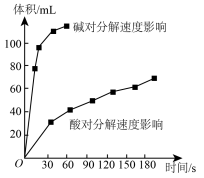
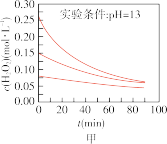
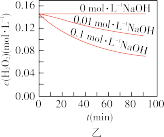
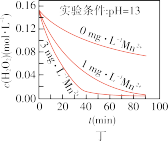
Ⅱ.实验室用 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:

(5)下列说法正确的是:___________(填字母序号)
(6)催化剂 在反应中,改变了
在反应中,改变了___________ (填字母序号)
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
 是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。I.
 不稳定、易分解,
不稳定、易分解,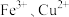 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
(1)若利用图甲装置,可通过观察
(2)有同学提出将
 改为
改为 更为合理,其理由是
更为合理,其理由是(3)若利用乙实验可进行定量分析,实验时均以生成
 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是(4)如图为某小组研究的酸、碱对
 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为
Ⅱ.实验室用
 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:



(5)下列说法正确的是:___________(填字母序号)
A.图甲表明,其他条件相同时, 浓度越小,其分解越慢 浓度越小,其分解越慢 |
B.图乙表明,其他条件相同时,溶液碱性越弱, 分解越快 分解越快 |
C.图丙表明,少量 存在时,溶液碱性越强, 存在时,溶液碱性越强, 分解越快 分解越快 |
D.图丁表明,碱性溶液中, 浓度越大,对 浓度越大,对 分解速率的影响越大 分解速率的影响越大 |
 在反应中,改变了
在反应中,改变了A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
您最近半年使用:0次
8 . 低碳烯烃是指乙烯、丙烯和丁烯等小分子烯烃的总称。其用途十分广泛,是塑料、橡胶、树脂、高分子、医药、农药等后续产业链赖以生存的基石。请结合所学知识,回答下列问题:
(1)研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2与H2合成乙烯相关的热化学方程式如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应II:2CH3OH(g)=C2H4(g)+2H2O(g) ΔH2=-29.98kJ·mol-1
反应III:2CO2(g)+6H2(g)=4H2O(g)+C2H4(g) ΔH3=_______ kJ·mol-1
(2)一定条件下,在2L的恒容密闭容器中以不同的氢碳比[ ]发生反应III,CO2的平衡转化率α(CO2)与温度的关系如图所示。
]发生反应III,CO2的平衡转化率α(CO2)与温度的关系如图所示。
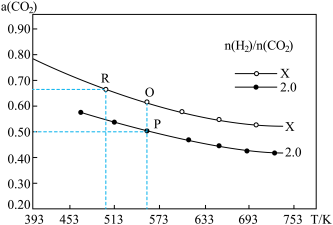
①该反应在低温下是否可以自发进行_______ (填“是”“否”或“无法确定”);
②下列能提高CO2平衡转化率的措施有_______ ;
a.降低反应温度
b.使用高效催化剂
c.通入He气体使体系的压强增大
d.以相同的投料比增加反应物的物质的量
③R点处,X_______ 2.0(填“>”“<”或“=”);
④若起始加入1molCO2和2molH2,则Q点的平衡常数K=_______ ;
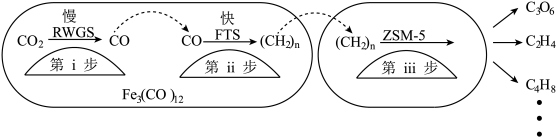
(3)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃-乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
①催化剂助剂主要在_______ 起作用(填“第i步”或“第ii步”“第iii步”);
②在Fe3(CO)12/ZSM-5中添加_______ 助剂效果最好,加入助剂能提高单位时间内乙烯产量的根本原因是_______ 。
(1)研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2与H2合成乙烯相关的热化学方程式如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应II:2CH3OH(g)=C2H4(g)+2H2O(g) ΔH2=-29.98kJ·mol-1
反应III:2CO2(g)+6H2(g)=4H2O(g)+C2H4(g) ΔH3=
(2)一定条件下,在2L的恒容密闭容器中以不同的氢碳比[
 ]发生反应III,CO2的平衡转化率α(CO2)与温度的关系如图所示。
]发生反应III,CO2的平衡转化率α(CO2)与温度的关系如图所示。
①该反应在低温下是否可以自发进行
②下列能提高CO2平衡转化率的措施有
a.降低反应温度
b.使用高效催化剂
c.通入He气体使体系的压强增大
d.以相同的投料比增加反应物的物质的量
③R点处,X
④若起始加入1molCO2和2molH2,则Q点的平衡常数K=
(3)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃-乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
②在Fe3(CO)12/ZSM-5中添加
您最近半年使用:0次
名校
9 . 乙醇用途广泛且需求量大,寻求制备乙醇的新方法是研究的热点。
(1) 电催化制备乙醇。电解原理示意图如图1所示。
电催化制备乙醇。电解原理示意图如图1所示。
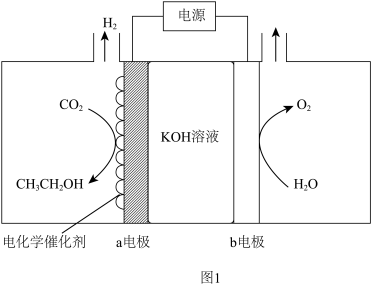
①a电极的电极反应式为_______ 。
②有效抑制a电极发生析氢反应的措施有_______ 。
(2) 催化加氢制备乙醇。
催化加氢制备乙醇。 在催化剂
在催化剂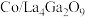 表面加氢制备乙醇的反应为
表面加氢制备乙醇的反应为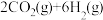

 ,反应机理如图2所示。
,反应机理如图2所示。
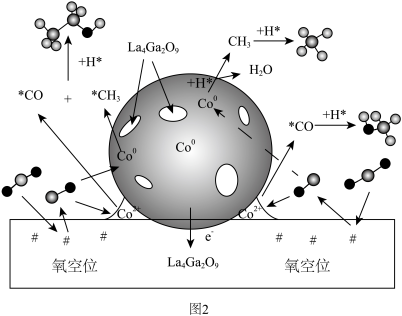
① 在
在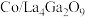 催化剂表面加氢生成
催化剂表面加氢生成 的过程可描述为
的过程可描述为_______ 。
②制取 的过程中可获得的副产物有
的过程中可获得的副产物有_______ 。
③随着反应进行,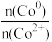 的值
的值_______ (填“增大”、“减小”或“不变”)。
④将 的混合气体置于密闭容器中,在
的混合气体置于密闭容器中,在 和不同温度下反应达到平衡时,
和不同温度下反应达到平衡时, 的转化率和
的转化率和 的选择性[
的选择性[ 的选择性
的选择性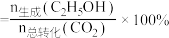 ]如图3所示。温度在时
]如图3所示。温度在时 ,CO2的平衡转化率几乎不变,其原因可能为
,CO2的平衡转化率几乎不变,其原因可能为_______ 。
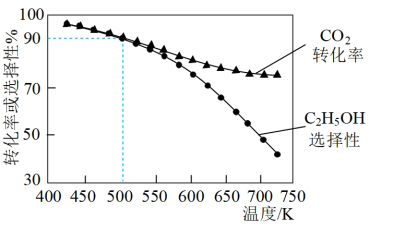
图3
(1)
 电催化制备乙醇。电解原理示意图如图1所示。
电催化制备乙醇。电解原理示意图如图1所示。
①a电极的电极反应式为
②有效抑制a电极发生析氢反应的措施有
(2)
 催化加氢制备乙醇。
催化加氢制备乙醇。 在催化剂
在催化剂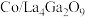 表面加氢制备乙醇的反应为
表面加氢制备乙醇的反应为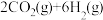

 ,反应机理如图2所示。
,反应机理如图2所示。
①
 在
在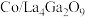 催化剂表面加氢生成
催化剂表面加氢生成 的过程可描述为
的过程可描述为②制取
 的过程中可获得的副产物有
的过程中可获得的副产物有③随着反应进行,
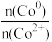 的值
的值④将
 的混合气体置于密闭容器中,在
的混合气体置于密闭容器中,在 和不同温度下反应达到平衡时,
和不同温度下反应达到平衡时, 的转化率和
的转化率和 的选择性[
的选择性[ 的选择性
的选择性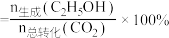 ]如图3所示。温度在时
]如图3所示。温度在时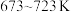 ,CO2的平衡转化率几乎不变,其原因可能为
,CO2的平衡转化率几乎不变,其原因可能为
图3
您最近半年使用:0次
2023-02-15更新
|
579次组卷
|
2卷引用:江苏省无锡市2022-2023学年高三上学期期末调研测试化学试题
名校
10 . 云南大学钱德云课题组最近合成一种用途广泛的手性N—烷基吲哚分子。反应历程如图所示:


已知:图示中 、
、 、R等表示烃基或氢原子且均不相同。下列叙述错误的是
、R等表示烃基或氢原子且均不相同。下列叙述错误的是


已知:图示中
 、
、 、R等表示烃基或氢原子且均不相同。下列叙述错误的是
、R等表示烃基或氢原子且均不相同。下列叙述错误的是| A.物质A是总反应的催化剂 |
| B.物质3分子含手性碳原子 |
| C.上述总反应为取代反应 |
| D.上述转化中Ni形成的共价键数目发生了变化 |
您最近半年使用:0次



