名校
解题方法
1 . 二氧化碳作为工业原料的用途十分广泛。某氢气催化还原CO2的转化路径如下,下列说法错误的是
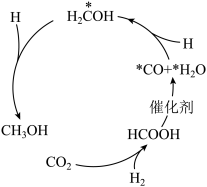

A.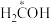 为中间产物 为中间产物 |
| B.HCOOH→*CO+*H2O释放能量 |
C.存在反应CO2+3H2 CH3OH+H2O CH3OH+H2O |
| D.*CO及时从催化剂脱附有利于加快反应速率 |
您最近半年使用:0次
2020-11-24更新
|
300次组卷
|
3卷引用:广东省清远市2021届高三上学期摸底考试(11月) 化学试题
广东省清远市2021届高三上学期摸底考试(11月) 化学试题江西省南昌市南昌县莲塘第一中学2021届高三上学期12月质量检测化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-测试
名校
解题方法
2 . 碳氢化合物有多种,它们在工业生产、生活中有重要用途。
(1)石油危机日渐严重,甲烷的转化和利用在天然气化工行业有非常重要的作用。甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和H2混合气体)。现在常见的重整技术有甲烷-水蒸气重整,其反应为:CH4(g) + H2O(g) CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
如图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。
下列说法正确的是________ 。
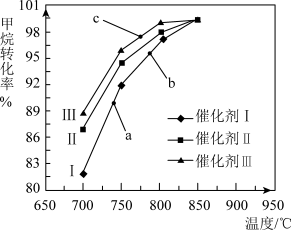
A.在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B.b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C.C点一定未达到平衡状态
D.催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
(2) 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,甲烷在1500℃左右气相裂解法生产,裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H= +376.4kJ/mol。
哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
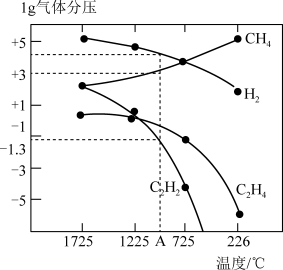
①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____ 0(填“>”或“<”),CH4的平衡转化率为____ %(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____ (填“>”或“<”)T2,t=______ s。
②由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________ 。
(1)石油危机日渐严重,甲烷的转化和利用在天然气化工行业有非常重要的作用。甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和H2混合气体)。现在常见的重整技术有甲烷-水蒸气重整,其反应为:CH4(g) + H2O(g)
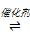 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0如图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。
下列说法正确的是

A.在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B.b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C.C点一定未达到平衡状态
D.催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
(2) 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,甲烷在1500℃左右气相裂解法生产,裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H= +376.4kJ/mol。
哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H②由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有
您最近半年使用:0次
2019-12-02更新
|
133次组卷
|
2卷引用:山西大学附属中学2019-2020学年高二10月月考化学试题
名校
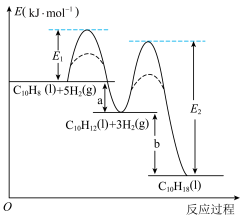
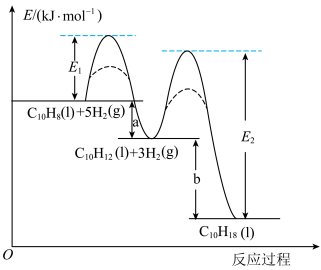
3 . 萘、四氢萘、十氢萘用途广泛,其转化关系为: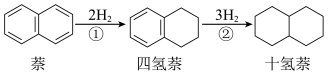 ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:
 ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:
A.萘分子(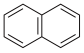 )的一氯代物有2种 )的一氯代物有2种 |
| B.实线表示无催化剂的反应过程,虚线表示有催化剂的反应过程 |
| C.E1、E2表示活化能,a的大小由E1决定,b的大小由E2决定 |
| D.物质的稳定性:十氢萘>四氢萘>萘 |
您最近半年使用:0次
2019-11-13更新
|
275次组卷
|
3卷引用:湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校2019-2020学年高二11月联考化学试题
4 . 请阅读下列材料,完成下面小题。
硫酸的工业用途非常广泛,可用于制造化肥、除铁锈、作电解液等。工业制硫酸的关键一步是将SO2氧化为SO3,该反应为2SO2+O2 2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
1. SO2与O2在一定条件下反应生成SO3,该反应属于( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
2. 上述材料中的反应是氧化还原反应,下列有关该反应的说法正确的是( )
A. O2是还原剂 B. SO2被氧化
C. O2失去电子 D. SO2发生还原反应
3. 上述材料中的反应在密闭容器中进行,下列关于该反应的说法正确的是( )
A. 升高温度能减慢反应速率
B. SO2与O2能100%转化为SO3
C. 减小O2的浓度能加快反应速率
D. 使用恰当的催化剂能加快反应速率
4. 上述材料中的反应为放热反应,下列说法正确的是( )
A. 断开化学键放出能量
B. 放热反应都不需要加热
C. 该反应的逆反应是吸热反应
D. 该反应的反应物总能量小于生成物的总能量
硫酸的工业用途非常广泛,可用于制造化肥、除铁锈、作电解液等。工业制硫酸的关键一步是将SO2氧化为SO3,该反应为2SO2+O2
 2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。1. SO2与O2在一定条件下反应生成SO3,该反应属于
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
2. 上述材料中的反应是氧化还原反应,下列有关该反应的说法正确的是
A. O2是还原剂 B. SO2被氧化
C. O2失去电子 D. SO2发生还原反应
3. 上述材料中的反应在密闭容器中进行,下列关于该反应的说法正确的是
A. 升高温度能减慢反应速率
B. SO2与O2能100%转化为SO3
C. 减小O2的浓度能加快反应速率
D. 使用恰当的催化剂能加快反应速率
4. 上述材料中的反应为放热反应,下列说法正确的是
A. 断开化学键放出能量
B. 放热反应都不需要加热
C. 该反应的逆反应是吸热反应
D. 该反应的反应物总能量小于生成物的总能量
您最近半年使用:0次
名校
解题方法
5 . 氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是_______ (填标号)。
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为____________ 。
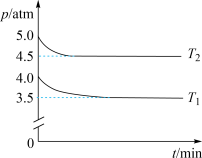
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g) 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是____________ (填标号)。
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1________ T2(填“>”或“<”)。该反应的ΔH______ 0(填“>”或“<”),判断的依据是_________ 。
③T2时,HCl的平衡转化率=________ ,反应的Kx=_____ (Kx为以物质的量分数表示的平衡常数)。
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g)
 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1
③T2时,HCl的平衡转化率=
您最近半年使用:0次
名校
解题方法
6 . 氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为:2H2O2(aq)=2H2O(l)+O2(g) ΔH=akJ·mol-1
①相同条件下,H2O2分解时,使用催化剂,不会改变的是___ (填标号)。
A.反应热 B.反应速率 C.活化能 D.生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为:H2O2+2Fe3+=2Fe2++O2+2H+,第二步反应的化学方程式为___ 。
(2)已知:O2(g)+4HCl(g) 2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

①该反应的速率v=k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是___ (填标号)。
A.温度升高,k增大
B.使用催化剂,k不变
C.平衡后分离出水蒸气,k变小
D.平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1___ T2(填“>”或“<”)。该反应的ΔH___ 0(填“>”或“<”)。
③T2时,HCl的平衡转化率=___ 。
(1)用H2O2制取O2时,分解的热化学方程式为:2H2O2(aq)=2H2O(l)+O2(g) ΔH=akJ·mol-1
①相同条件下,H2O2分解时,使用催化剂,不会改变的是
A.反应热 B.反应速率 C.活化能 D.生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为:H2O2+2Fe3+=2Fe2++O2+2H+,第二步反应的化学方程式为
(2)已知:O2(g)+4HCl(g)
 2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
①该反应的速率v=k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是
A.温度升高,k增大
B.使用催化剂,k不变
C.平衡后分离出水蒸气,k变小
D.平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1
③T2时,HCl的平衡转化率=
您最近半年使用:0次
7 . 砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___ 。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:
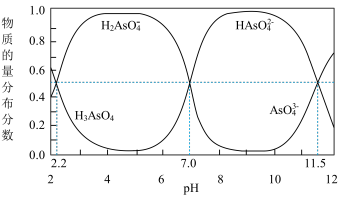
①lgKa1(H3AsO4)=_____ 。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___ 。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s) 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)
 As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g) 4As(g) △H
4As(g) △H
①△H=____ kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
由上表判断催化剂X____ (填“优于”或“劣于”)Y,理由是_____ 。
(4)反应2As2S3(s) 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正)_____ v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____ kPa,该反应的Kp=_____ kPa5(Kp为以分压表示的平衡常数)。
(1)AsH3的电子式为
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:

①lgKa1(H3AsO4)=
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s)
 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1反应Ⅱ.As2O3(g)+3C(s)

 As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1反应Ⅲ.As4(g)
 4As(g) △H
4As(g) △H①△H=
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
| 反应Ⅱ | 反应Ⅲ | ||
| 活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 | |
(4)反应2As2S3(s)
 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
①对应温度下,B点的反应速率v(正)
②A点处,AsS(g)的分压为
您最近半年使用:0次
8 . 萘、四氢萘、十氢萘用途广泛,其转化关系为: ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:
 ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:
A.萘分子(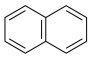 )的一氯代物有2种 )的一氯代物有2种 |
| B.E1、E2表示活化能,a的大小由E1决定,b的大小由E2决定 |
| C.实线表示无催化剂的反应过程,虚线表示有催化剂的反应过程 |
| D.物质的稳定性:十氢萘>四氢萘>萘 |
您最近半年使用:0次
名校
解题方法
9 . 铜及其化合物在工农业生产有着重要的用途,氯化铜、氯化业铜经常用作催化剂。其中CuCl广泛应用于化工和印染等行业。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15 -25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)
(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略) 制备氯化铜。
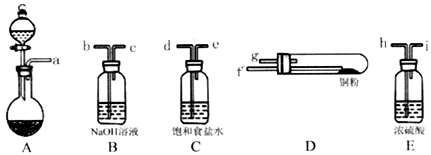
①按气流方向连接各仪器接口顺序是:
a→_____ 、_____ →_____ 、_____ →_____ 、_____ →_____ 。
②本套装置有两个仪器需要加热,加热的顺序为先_____ 后_______
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:_____________________ 。
(3)现欲从(2)所得溶液获得纯净的CuCl2•2H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X 用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3•H2O C.CuO d.CuSO4
②要获得纯净CuCl2•2H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、_____ 、_____ 、洗涤、干燥。
(4)用CuCl2•2H2O为原料制备CuCl 时,发现其中含有少量的CuCl 2或CuO杂质,若杂质是CuCl2,则产生的原因是______________ 。
(5)设计简单的实验验证0.1mol/L 的CuCl2溶液中的Cu2+ 对H2O2的分解具有催化作用:_____ 。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15 -25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)

(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略) 制备氯化铜。

①按气流方向连接各仪器接口顺序是:
a→
②本套装置有两个仪器需要加热,加热的顺序为先
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:
(3)现欲从(2)所得溶液获得纯净的CuCl2•2H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X 用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3•H2O C.CuO d.CuSO4
②要获得纯净CuCl2•2H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、
(4)用CuCl2•2H2O为原料制备CuCl 时,发现其中含有少量的CuCl 2或CuO杂质,若杂质是CuCl2,则产生的原因是
(5)设计简单的实验验证0.1mol/L 的CuCl2溶液中的Cu2+ 对H2O2的分解具有催化作用:
您最近半年使用:0次
2018-04-22更新
|
430次组卷
|
2卷引用:内蒙古赤峰市2018届高三4月模拟理科综合化学试题
10 . 3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点 181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯 相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】
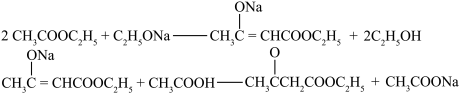
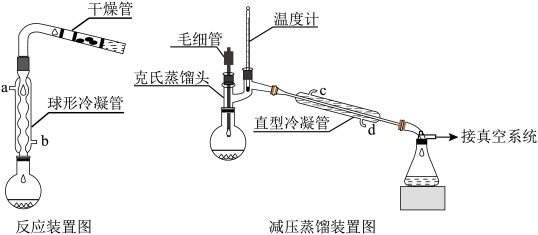
【实验装置】
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是_____________ 。
(2)反应装置中加干燥管是为了__________ 。两个装置中冷凝管的作用__________ (填“相同”或“不相同”),冷却水进水口分别为__________ 和_____________ (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是__________ ,稀醋酸不能加多了,原因是___________ 。用分液漏斗分离出酯层的操作叫____________ 。碳酸钠溶液洗涤的目的是_________________ 。加碳酸钾的目的是______________ 。
(4)采用减压蒸馏的原因是_______________ 。
(5)本实验所得到的3-丁酮酸乙酯产率是_____________ (填正确答案标号)。
【反应原理】

【实验装置】

【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是
(2)反应装置中加干燥管是为了
(3)产物后处理中,滴加稀醋酸的目的是
(4)采用减压蒸馏的原因是
(5)本实验所得到的3-丁酮酸乙酯产率是
| A.10% | B.22% | C.19% | D.40% |
您最近半年使用:0次
2016-12-09更新
|
524次组卷
|
2卷引用:2015届湖北省襄阳市普通高中高三1月调研理综化学试卷



