解题方法
1 . 甲醇用途广泛,可用作溶剂、防冻剂、燃料,也可用于生产生物柴油,利用合成气(主要成分为CO、CO2和H2)可以合成甲醇,涉及的反应如下,回答下列问题:
反应ⅰ:CO(g)+2H2(g) CH3OH(g) △H1=−91.5kJ∙mol−1
CH3OH(g) △H1=−91.5kJ∙mol−1
反应ii:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
反应iii:CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):___________ 。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式___________ 。
③m=___________ (计算结果保留两位有效数字,已知1eV=1.6×10−22kJ)。
(2)反应ⅰ的Arrhenius经验公式Rlnk=− +C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是
+C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是___________ 。 和CO的选择性
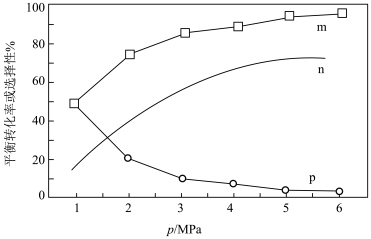
和CO的选择性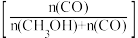 随压强变化曲线如图所示。
随压强变化曲线如图所示。___________ (填“m”“n”或“p”),简述判断方法___________ 。___________ mol·L−1·s−1(保留两位有效数字)。
反应ⅰ:CO(g)+2H2(g)
 CH3OH(g) △H1=−91.5kJ∙mol−1
CH3OH(g) △H1=−91.5kJ∙mol−1反应ii:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1反应iii:CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
CO(g)+H2O(g) △H3=+41.6kJ∙mol−1(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
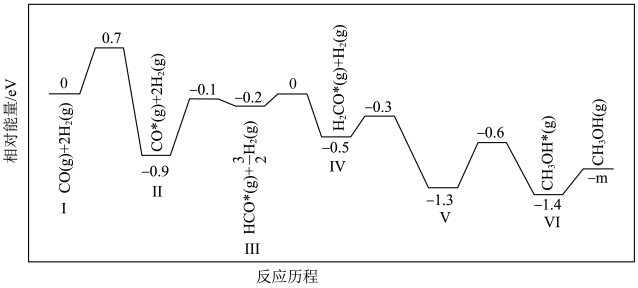
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式
③m=
(2)反应ⅰ的Arrhenius经验公式Rlnk=−
 +C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是
+C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是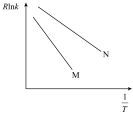
 和CO的选择性
和CO的选择性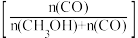 随压强变化曲线如图所示。
随压强变化曲线如图所示。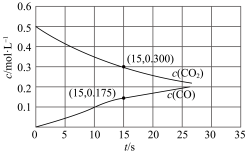
您最近一年使用:0次
2 . 氨的用途十分广泛,是制造硝酸和氮肥的重要原料。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于___________ kJ
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
(3)已知合成氨反应的速率方程为:ν=kcα(N2)cβ(H2)c-1(NH3),在合成氨过程中,需要不断分离出氨,可能的原因为___________ 。
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①为进一步提高NH3的平衡转化率,下列措施能达到目的的是___________ (填标号)。
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g) NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/mol
b.NH2COONH4(1) CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是___________ (填“第一步”或“第二步”)。
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
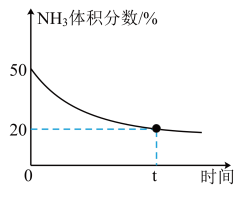
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=___________ MPa-2(已知:分压=总压×体积分数)。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
| A.容器内压强不变 | B.N2的体积分数不变 |
| C.气体的密度不再改变 | D.V正(N2)=3V逆(H2) |
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。①为进一步提高NH3的平衡转化率,下列措施能达到目的的是
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g)
 NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/molb.NH2COONH4(1)
 CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=
您最近一年使用:0次
3 .  是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。
I. 不稳定、易分解,
不稳定、易分解, 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
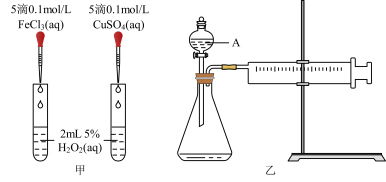
(1)若利用图甲装置,可通过观察___________ 现象,从而定性比较得出结论。
(2)有同学提出将 改为
改为___________  更为合理,其理由是
更为合理,其理由是___________ 。
(3)若利用乙实验可进行定量分析,实验时均以生成 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___________ 。
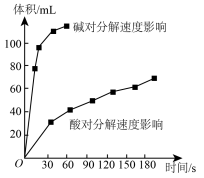
(4)如图为某小组研究的酸、碱对 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为___________ ,支持这一方案的理由是___________ 。
Ⅱ.实验室用 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:
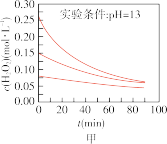
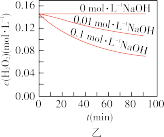

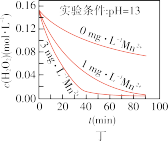
(5)下列说法正确的是:___________(填字母序号)
(6)催化剂 在反应中,改变了
在反应中,改变了___________ (填字母序号)
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
 是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。I.
 不稳定、易分解,
不稳定、易分解,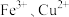 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
(1)若利用图甲装置,可通过观察
(2)有同学提出将
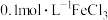 改为
改为 更为合理,其理由是
更为合理,其理由是(3)若利用乙实验可进行定量分析,实验时均以生成
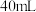 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是(4)如图为某小组研究的酸、碱对
 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为
Ⅱ.实验室用
 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:



(5)下列说法正确的是:___________(填字母序号)
A.图甲表明,其他条件相同时, 浓度越小,其分解越慢 浓度越小,其分解越慢 |
B.图乙表明,其他条件相同时,溶液碱性越弱, 分解越快 分解越快 |
C.图丙表明,少量 存在时,溶液碱性越强, 存在时,溶液碱性越强, 分解越快 分解越快 |
D.图丁表明,碱性溶液中, 浓度越大,对 浓度越大,对 分解速率的影响越大 分解速率的影响越大 |
 在反应中,改变了
在反应中,改变了A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
您最近一年使用:0次
名校
4 . 氨气在工农业生产中有着重要的用途,研究合成氨反应具有重要意义。
(1)直接常压电化学合成氨以纳米 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图-1所示:
。其工作原理如图-1所示:
①阴极的电极反应式为___________ 。
②电解过程中,由于发生副反应,使得阴极制得的 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是___________ 。
(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图-2所示。合成氨反应的热化学方程式为___________ 。生成 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为___________ 。
(3) 催化释氢可提供哈伯-博施合成氨反应所需的
催化释氢可提供哈伯-博施合成氨反应所需的 。在催化剂作用下,
。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图-3所示。
,可能的反应机理如图-3所示。
①其他条件不变时,以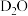 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为___________ 。
②已知: 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是___________ (用离子方程式表示)。
③在催化剂的作用下, 与水反应。释氢体积及温度随反应时间的变化如图-4所示。
与水反应。释氢体积及温度随反应时间的变化如图-4所示。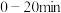 内,温度随时间快速升高的原因是
内,温度随时间快速升高的原因是___________ 。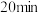 后,氢气体积在增加,面温度却下降的原因是
后,氢气体积在增加,面温度却下降的原因是___________ 。
(1)直接常压电化学合成氨以纳米
 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图-1所示:
。其工作原理如图-1所示: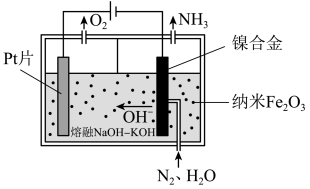
①阴极的电极反应式为
②电解过程中,由于发生副反应,使得阴极制得的
 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图-2所示。合成氨反应的热化学方程式为
 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为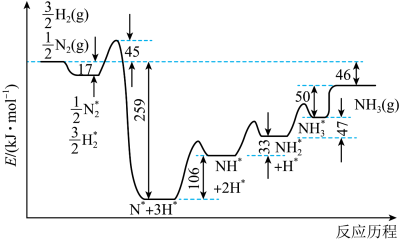
(3)
 催化释氢可提供哈伯-博施合成氨反应所需的
催化释氢可提供哈伯-博施合成氨反应所需的 。在催化剂作用下,
。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图-3所示。
,可能的反应机理如图-3所示。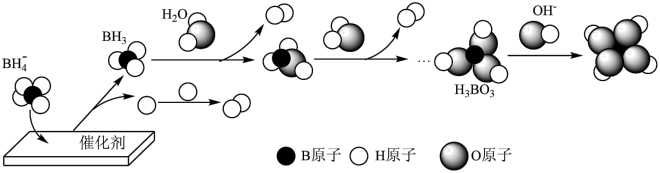
①其他条件不变时,以
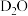 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为②已知:
 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是③在催化剂的作用下,
 与水反应。释氢体积及温度随反应时间的变化如图-4所示。
与水反应。释氢体积及温度随反应时间的变化如图-4所示。 内,温度随时间快速升高的原因是
内,温度随时间快速升高的原因是 后,氢气体积在增加,面温度却下降的原因是
后,氢气体积在增加,面温度却下降的原因是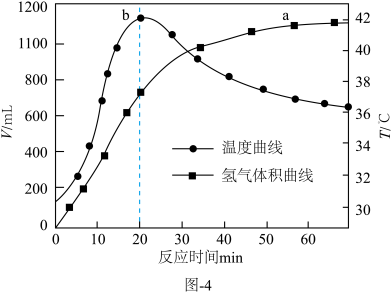
您最近一年使用:0次
名校
5 . 云南大学钱德云课题组最近合成一种用途广泛的手性N—烷基吲哚分子。反应历程如图所示:


已知:图示中 、
、 、R等表示烃基或氢原子且均不相同。下列叙述错误的是
、R等表示烃基或氢原子且均不相同。下列叙述错误的是


已知:图示中
 、
、 、R等表示烃基或氢原子且均不相同。下列叙述错误的是
、R等表示烃基或氢原子且均不相同。下列叙述错误的是| A.物质A是总反应的催化剂 |
| B.物质3分子含手性碳原子 |
| C.上述总反应为取代反应 |
| D.上述转化中Ni形成的共价键数目发生了变化 |
您最近一年使用:0次
6 . 钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述不正确的是
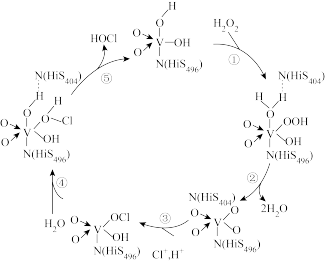

A.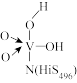 是该反应的催化剂 是该反应的催化剂 |
| B.过程①②④中反应的原子利用率为100% |
| C.该催化循环中V的成键数目发生变化 |
| D.该反应的离子方程式为:H2O2+Cl-+ H+= HOCl+ H2O |
您最近一年使用:0次
解题方法
7 . 化学创造美好生活,下列物质用途与所述的化学知识没有关联的是
| 选项 | 物质用途 | 化学知识 |
| A | 二氧化硫用作红酒防腐剂 |  溶于水显弱酸性 溶于水显弱酸性 |
| B | 乙炔用于金属切割与焊接 |  燃烧放出大量热 燃烧放出大量热 |
| C | 碳酸氢钠用作面团膨松剂 |  受热分解会产生 受热分解会产生 |
| D | 铁触媒用作合成氨的催化剂 | 催化剂可以提高反应速率 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 放热反应在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为_______ 。
(2)甲烷可以消除氮氧化物污染,发生的反应为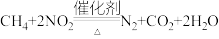 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使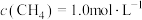 、
、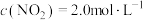 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得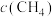 随时间的变化情况如下表:
随时间的变化情况如下表:
①实验1中,在10~20min内,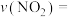
_______ ,40min时v(正)_______ v(逆)(填:“大于”、“小于”、“等于”)。
②0~20min内,实验2比实验1反应速率快的原因可能是_______ 。
(3)乙醇应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为_______ 。_______ 。 高温分解不可能生成
高温分解不可能生成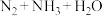 。理由是
。理由是_______ 。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为
(2)甲烷可以消除氮氧化物污染,发生的反应为
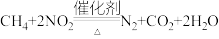 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使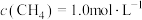 、
、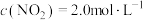 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得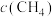 随时间的变化情况如下表:
随时间的变化情况如下表:| 实验 序号 | 时间/min 浓度 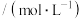 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
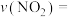
②0~20min内,实验2比实验1反应速率快的原因可能是
(3)乙醇应用于燃料电池,该电池采用可传导
 的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为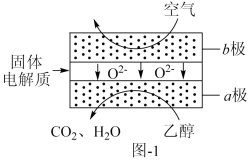
 高温分解不可能生成
高温分解不可能生成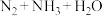 。理由是
。理由是
您最近一年使用:0次
2022-06-26更新
|
823次组卷
|
2卷引用:江苏省连云港市2021-2022学年高一下学期期末考试化学试题
9 . 低碳烯烃是指乙烯、丙烯和丁烯等小分子烯烃的总称。其用途十分广泛,是塑料、橡胶、树脂、高分子、医药、农药等后续产业链赖以生存的基石。请结合所学知识,回答下列问题:
(1)研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2与H2合成乙烯相关的热化学方程式如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应II:2CH3OH(g)=C2H4(g)+2H2O(g) ΔH2=-29.98kJ·mol-1
反应III:2CO2(g)+6H2(g)=4H2O(g)+C2H4(g) ΔH3=_______ kJ·mol-1
(2)一定条件下,在2L的恒容密闭容器中以不同的氢碳比[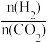 ]发生反应III,CO2的平衡转化率α(CO2)与温度的关系如图所示。
]发生反应III,CO2的平衡转化率α(CO2)与温度的关系如图所示。_______ (填“是”“否”或“无法确定”);
②下列能提高CO2平衡转化率的措施有_______ ;
a.降低反应温度
b.使用高效催化剂
c.通入He气体使体系的压强增大
d.以相同的投料比增加反应物的物质的量
③R点处,X_______ 2.0(填“>”“<”或“=”);
④若起始加入1molCO2和2molH2,则Q点的平衡常数K=_______ ;
(3)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃-乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
①催化剂助剂主要在_______ 起作用(填“第i步”或“第ii步”“第iii步”);
②在Fe3(CO)12/ZSM-5中添加_______ 助剂效果最好,加入助剂能提高单位时间内乙烯产量的根本原因是_______ 。
(1)研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2与H2合成乙烯相关的热化学方程式如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应II:2CH3OH(g)=C2H4(g)+2H2O(g) ΔH2=-29.98kJ·mol-1
反应III:2CO2(g)+6H2(g)=4H2O(g)+C2H4(g) ΔH3=
(2)一定条件下,在2L的恒容密闭容器中以不同的氢碳比[
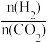 ]发生反应III,CO2的平衡转化率α(CO2)与温度的关系如图所示。
]发生反应III,CO2的平衡转化率α(CO2)与温度的关系如图所示。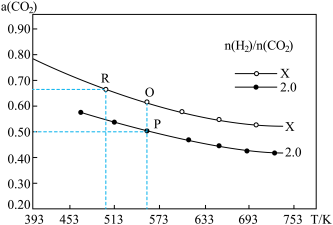
②下列能提高CO2平衡转化率的措施有
a.降低反应温度
b.使用高效催化剂
c.通入He气体使体系的压强增大
d.以相同的投料比增加反应物的物质的量
③R点处,X
④若起始加入1molCO2和2molH2,则Q点的平衡常数K=
(3)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃-乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
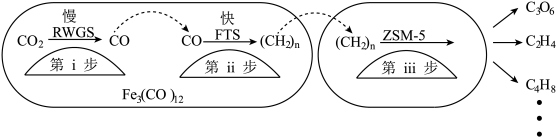
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
②在Fe3(CO)12/ZSM-5中添加
您最近一年使用:0次
名校
10 . 硫酸、硝酸均为重要的化工产品,它们的制备工艺流程示意图如下:

回答下列问题。
(1)若上述过程为工业制硫酸。
①若原料A为黄铁矿(主要成分为FeS2)时,设备I中高温煅烧后会生成固体废渣,该废渣的一种用途是_______ 。
②气体B制备气体C可在V2O5催化下进行,该反应的机理分为两步:
第一步:V2O5+SO2=2VO2+SO3(快)
第二步:_______ (慢)
关于该过程,说法正确的是_______ (填标号)。
A.该过程的反应速率主要取决于第一步
B.VO2是该反应的催化剂
C.增大SO2的浓度可显著提高反应速率
D.增大O2的浓度可显著提高反应速率
(2)若上述过程为工业制硝酸,原料A为氨气。
①气体C在设备III中转化为硝酸时,还需要通入气体E,则气体E的化学式为_______ ,通入气体E的目的是_______ 。
②尾气中的NO2会形成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知NO2用碳酸钠溶液吸收时会生成NaNO2,则吸收NO2的离子方程式为_______ 。
(3)目前,NaClO溶液广泛应用于脱硫脱硝。
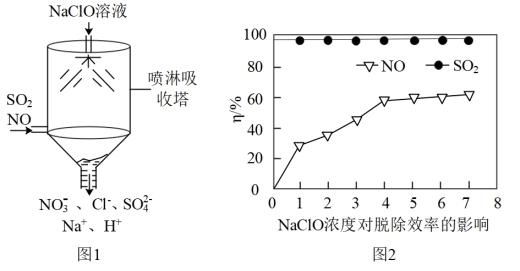
①某课外小组同学设计了如图喷淋吸收塔装置(如图1),设计该装置的优点是_______ 。
②如图2为NaClO浓度对脱硫脱硝效率(η/%)的影响。当温度为50°C,溶液的pH=10(溶液显碱性),c(SO2)=c(NO)=300mg·m-3时,SO2的脱除效率一直维持在98%以上,而NO脱除效率相对较低,其原因是_______ 。

回答下列问题。
(1)若上述过程为工业制硫酸。
①若原料A为黄铁矿(主要成分为FeS2)时,设备I中高温煅烧后会生成固体废渣,该废渣的一种用途是
②气体B制备气体C可在V2O5催化下进行,该反应的机理分为两步:
第一步:V2O5+SO2=2VO2+SO3(快)
第二步:
关于该过程,说法正确的是
A.该过程的反应速率主要取决于第一步
B.VO2是该反应的催化剂
C.增大SO2的浓度可显著提高反应速率
D.增大O2的浓度可显著提高反应速率
(2)若上述过程为工业制硝酸,原料A为氨气。
①气体C在设备III中转化为硝酸时,还需要通入气体E,则气体E的化学式为
②尾气中的NO2会形成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知NO2用碳酸钠溶液吸收时会生成NaNO2,则吸收NO2的离子方程式为
(3)目前,NaClO溶液广泛应用于脱硫脱硝。

①某课外小组同学设计了如图喷淋吸收塔装置(如图1),设计该装置的优点是
②如图2为NaClO浓度对脱硫脱硝效率(η/%)的影响。当温度为50°C,溶液的pH=10(溶液显碱性),c(SO2)=c(NO)=300mg·m-3时,SO2的脱除效率一直维持在98%以上,而NO脱除效率相对较低,其原因是
您最近一年使用:0次
2022-04-21更新
|
308次组卷
|
2卷引用:湖北省武汉市部分重点中学2021-2022学年高一下学期期中联考化学试题



