1 . 下列实验操作或现象可以达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 探究次氯酸钠溶液的酸碱性 | 用pH试纸测溶液的pH值 |
B | 证明 和 和 之间是可逆反应 之间是可逆反应 | 向   溶液中滴加 溶液中滴加  的 的 溶液,充分反应后,滴加几滴 溶液,充分反应后,滴加几滴 溶液后变为红色 溶液后变为红色 |
C | 证明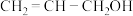 中含有碳碳双键 中含有碳碳双键 | 向酸性 溶液中加入 溶液中加入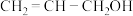 |
D | 除去 溶液中混有的 溶液中混有的 | 加入过量铁粉,充分反应后,过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 在催化剂作用下, 发生如下反应:
发生如下反应:
①
②
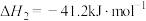
回答下列问题:
(1)

___________  。
。
(2)一定温度下,向恒容密闭容器中充入 和
和 发生反应①,达到平衡时
发生反应①,达到平衡时 转化率为20%。下列叙述正确的是___________(填标号)。
转化率为20%。下列叙述正确的是___________(填标号)。
(3) 和
和 在催化剂作用下能发生反应:
在催化剂作用下能发生反应:
 。在1L恒容密闭容器中充入
。在1L恒容密闭容器中充入 和
和 ,测定
,测定 平衡转化率、催化效率与温度的关系如图1所示。
平衡转化率、催化效率与温度的关系如图1所示。
___________ (填“>”“<”或“=”)0。
②温度高于400℃,催化效率降低的原因是___________ 。T点平衡常数K___________ (填“>”“<”或“=”)0.5。
(4)在恒温条件下,向反应器充入 和
和 发生反应①,测得平衡时
发生反应①,测得平衡时 和
和 的物质的量浓度与平衡总压强的关系如图2所示。表示平衡时
的物质的量浓度与平衡总压强的关系如图2所示。表示平衡时 的物质的量浓度与平衡总压强的关系的是曲线
的物质的量浓度与平衡总压强的关系的是曲线___________ (填“ ”或“
”或“ ”)。M点时该反应的压强平衡常数
”)。M点时该反应的压强平衡常数
___________ 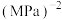 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 制备乙炔,其阴极的电极反应式为
制备乙炔,其阴极的电极反应式为___________ 。
 发生如下反应:
发生如下反应:①

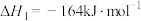
②

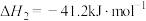
回答下列问题:
(1)


 。
。(2)一定温度下,向恒容密闭容器中充入
 和
和 发生反应①,达到平衡时
发生反应①,达到平衡时 转化率为20%。下列叙述正确的是___________(填标号)。
转化率为20%。下列叙述正确的是___________(填标号)。A.当 体积分数不随时间变化时达到平衡状态 体积分数不随时间变化时达到平衡状态 |
| B.上述反应达到平衡时放出热量为131.2kJ |
| C.平衡时向容器充入氩气,逆反应速率大于正反应速率 |
| D.加入催化剂,正反应速率等于逆反应速率且都增大 |
(3)
 和
和 在催化剂作用下能发生反应:
在催化剂作用下能发生反应:
 。在1L恒容密闭容器中充入
。在1L恒容密闭容器中充入 和
和 ,测定
,测定 平衡转化率、催化效率与温度的关系如图1所示。
平衡转化率、催化效率与温度的关系如图1所示。

②温度高于400℃,催化效率降低的原因是
(4)在恒温条件下,向反应器充入
 和
和 发生反应①,测得平衡时
发生反应①,测得平衡时 和
和 的物质的量浓度与平衡总压强的关系如图2所示。表示平衡时
的物质的量浓度与平衡总压强的关系如图2所示。表示平衡时 的物质的量浓度与平衡总压强的关系的是曲线
的物质的量浓度与平衡总压强的关系的是曲线 ”或“
”或“ ”)。M点时该反应的压强平衡常数
”)。M点时该反应的压强平衡常数
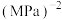 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 制备乙炔,其阴极的电极反应式为
制备乙炔,其阴极的电极反应式为
您最近一年使用:0次
解题方法
3 . 下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 室温下,向浓度均为 0.1mol·L-1的NaCl和 NaI的混合溶液中滴加几滴AgNO3溶液,观察生成沉淀的颜色 | 比较Ksp(AgCl)、Ksp(AgI)的大小 |
| B | 室温下,用pH计分别测量CH3COONa溶液和NaNO2溶液的pH,比较pH大小 | 比较CH3COO-、NO 结合 H+的能力 结合 H+的能力 |
| C | 室温下,取1 mL 0.1 mol·L-1 KI溶液和2 mL 0.1 mol·L-1 FeCl3溶液充分反应后,再加2 mL CCl4振荡、静置后,取上层清液滴加少量KSCN溶液,观察溶液颜色变化 | Fe3+和I-的反应有一定的限度 |
| D | 向淀粉溶液中加入少量稀硫酸,加热,再加入银氨溶液水浴加热,观察是否有银镜生成 | 淀粉水解产物具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 甲醇是重要的化工原料,应用前景广阔。工业上一般采用以下方法合成:
(1)反应Ⅰ:
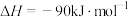
反应Ⅱ:

则反应Ⅲ: 的
的
________ 
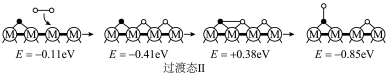
(2)在催化剂M的作用下,反应Ⅱ的微观反应历程和相对能量(E)如下表所示,其中吸附在催化剂表面上的物种用“*”标注。已知;●表示C,·表示O,○表示H。
①历程c对应的反应________ 。
②决定反应Ⅱ总反应速率的是历程________ (填“a”、“b”或“c”)。
(3)将 和
和 按物质的量之比1:3充入一恒容密闭容器中
按物质的量之比1:3充入一恒容密闭容器中
①若只发生反应Ⅲ,下列叙述能说明该反应达到平衡状态的是________ 。
A. 和
和 的转化率相等
的转化率相等
B.生成3molO-H键的同时生成3molH-H键
C. 时
时
D.混合气体的密度保持不变
②若同时发生反应Ⅱ和反应Ⅲ,测得 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。 、
、 、
、 的大小关系为
的大小关系为________ 。
ii.A点、B点的化学反应速率大小: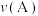
________  (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。
③图中M点对应的温度下,已知CO的选择性(生成的CO与转化的 的百分比)为50%,该温度下反应Ⅱ的平衡常数为
的百分比)为50%,该温度下反应Ⅱ的平衡常数为________ (结果保留3位小数)。
(1)反应Ⅰ:

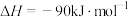
反应Ⅱ:


则反应Ⅲ:
 的
的

(2)在催化剂M的作用下,反应Ⅱ的微观反应历程和相对能量(E)如下表所示,其中吸附在催化剂表面上的物种用“*”标注。已知;●表示C,·表示O,○表示H。
历程 | 反应 |
历程a |
|
历程b
|
|
历程c | ________ |
②决定反应Ⅱ总反应速率的是历程
(3)将
 和
和 按物质的量之比1:3充入一恒容密闭容器中
按物质的量之比1:3充入一恒容密闭容器中①若只发生反应Ⅲ,下列叙述能说明该反应达到平衡状态的是
A.
 和
和 的转化率相等
的转化率相等B.生成3molO-H键的同时生成3molH-H键
C.
 时
时D.混合气体的密度保持不变
②若同时发生反应Ⅱ和反应Ⅲ,测得
 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。
 、
、 、
、 的大小关系为
的大小关系为ii.A点、B点的化学反应速率大小:
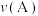
 (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。③图中M点对应的温度下,已知CO的选择性(生成的CO与转化的
 的百分比)为50%,该温度下反应Ⅱ的平衡常数为
的百分比)为50%,该温度下反应Ⅱ的平衡常数为
您最近一年使用:0次
解题方法
5 . CH3OH是一种绿色能源,也是一种化工原料。回答下列问题:
Ⅰ.合成甲醇。
工业上常用CO和H2制备CH3OH,反应原理是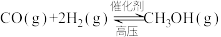
 。
。
(1)已知:①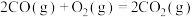
 kJ⋅mol
kJ⋅mol
②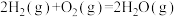
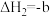 kJ⋅mol
kJ⋅mol
③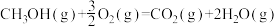
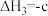 kJ⋅mol
kJ⋅mol
上述反应的
___________ kJ⋅mol (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。
(2)在恒温恒容密闭容器中充入1 mol 和1 mol
和1 mol  合成
合成 。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
(3)向体积相同的甲、乙恒容密闭容器中均充入1 mol 和3 mol
和3 mol  同时发生反应合成
同时发生反应合成 ,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。
,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。___________ (填“高于”或“低于”)乙,判断依据是___________ 。
②
___________ (填“>”“<”或“=”)0,判断依据是___________ 。
③若容器体积为1 L,甲容器中0~4 min内用H2表示的平均反应速率为___________ mol⋅L ⋅min
⋅min 。
。
Ⅱ.可用于合成有机物。
近日,中国科学院大连化学物理研究所丁云杰团队利用Rh单核配合物催化剂以和CO为原料合成了CH3COOH,相关反应为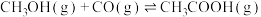 、
、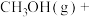
 。
。
(4)以CH3OH和CO为原料,从原子利用率分析,合成___________ (填“CH3COOH”或“CH3COOCH3”)是最理想的绿色化学工艺。
(5)一定温度下,总压强保持1.5a kPa,向反应器中充入1 mol 和1 mol
和1 mol  ,在一定条件下合成
,在一定条件下合成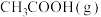 和
和 。达到平衡时,
。达到平衡时, 的转化率为60%,
的转化率为60%,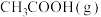 的选择性为80%,(
的选择性为80%,( 的选择性
的选择性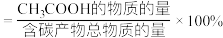 )。该温度下合成
)。该温度下合成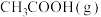 反应的平衡常数
反应的平衡常数
___________  (用含a的代数式表示,
(用含a的代数式表示, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅰ.合成甲醇。
工业上常用CO和H2制备CH3OH,反应原理是
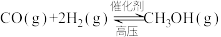
 。
。(1)已知:①
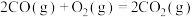
 kJ⋅mol
kJ⋅mol
②
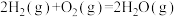
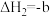 kJ⋅mol
kJ⋅mol
③
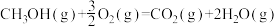
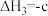 kJ⋅mol
kJ⋅mol
上述反应的

 (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。(2)在恒温恒容密闭容器中充入1 mol
 和1 mol
和1 mol  合成
合成 。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
。下列情况表明该反应一定达到平衡状态的是___________(填字母)。| A.气体压强不随时间变化 | B.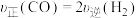 |
| C.气体密度不随时间变化 | D.气体平均摩尔质量不随时间变化 |
(3)向体积相同的甲、乙恒容密闭容器中均充入1 mol
 和3 mol
和3 mol  同时发生反应合成
同时发生反应合成 ,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。
,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。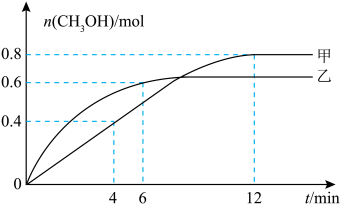
②

③若容器体积为1 L,甲容器中0~4 min内用H2表示的平均反应速率为
 ⋅min
⋅min 。
。Ⅱ.可用于合成有机物。
近日,中国科学院大连化学物理研究所丁云杰团队利用Rh单核配合物催化剂以和CO为原料合成了CH3COOH,相关反应为
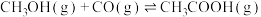 、
、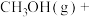
 。
。(4)以CH3OH和CO为原料,从原子利用率分析,合成
(5)一定温度下,总压强保持1.5a kPa,向反应器中充入1 mol
 和1 mol
和1 mol  ,在一定条件下合成
,在一定条件下合成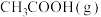 和
和 。达到平衡时,
。达到平衡时, 的转化率为60%,
的转化率为60%,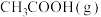 的选择性为80%,(
的选择性为80%,( 的选择性
的选择性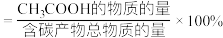 )。该温度下合成
)。该温度下合成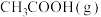 反应的平衡常数
反应的平衡常数
 (用含a的代数式表示,
(用含a的代数式表示, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
6 . 反应 在工业上有重要应用。
在工业上有重要应用。
(1)已知 和
和 的燃烧热分别为
的燃烧热分别为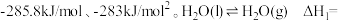
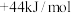 ,则
,则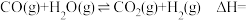
_______ 。
(2)在恒温恒容的密闭容器中发生反应: ,下列能说明该反应达平衡状态的是_______(填字母)。
,下列能说明该反应达平衡状态的是_______(填字母)。
(3)该反应常在 膜反应器中进行,其工作原理如图1所示。
膜反应器中进行,其工作原理如图1所示。 膜时具有更高转化率的原因是
膜时具有更高转化率的原因是_______ 。
②某温度下, 在
在 膜表面上的解离过程存在如下平衡:
膜表面上的解离过程存在如下平衡: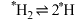 (*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是
(*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是_______ (填字母)。
A.Pd膜对气体分子的透过具有选择性
B.过程2的
C.加快 膜内
膜内 原子迁移有利于
原子迁移有利于 的解离
的解离
D. 原子在
原子在 膜表面上结合为
膜表面上结合为 的过程为放热反应
的过程为放热反应
③同温同压下,已知等物质的量的 和
和 通入无
通入无 膜反应器和
膜反应器和 膜反应器发生反应
膜反应器发生反应 ,无
,无 膜反应器中
膜反应器中 的平衡转化率为
的平衡转化率为 ,相同时间内
,相同时间内 膜反应器出口
膜反应器出口 和出口
和出口 中
中 的物质的量之比为1:8,则使用
的物质的量之比为1:8,则使用 膜反应器
膜反应器 的平衡转化率提高了
的平衡转化率提高了_______  。
。
(4) 也可采用电化学方法实现,反应装置如图2所示。
也可采用电化学方法实现,反应装置如图2所示。_______ (填“正极”或“负极”),该电极上的反应为_______ 。
 在工业上有重要应用。
在工业上有重要应用。(1)已知
 和
和 的燃烧热分别为
的燃烧热分别为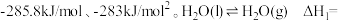
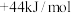 ,则
,则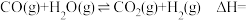
(2)在恒温恒容的密闭容器中发生反应:
 ,下列能说明该反应达平衡状态的是_______(填字母)。
,下列能说明该反应达平衡状态的是_______(填字母)。| A.容器中混合气体的平均摩尔质量不变 | B. 的体积分数保持不变 的体积分数保持不变 |
| C.体系中压强不变 | D.容器中混合气体的密度不变 |
(3)该反应常在
 膜反应器中进行,其工作原理如图1所示。
膜反应器中进行,其工作原理如图1所示。
 膜时具有更高转化率的原因是
膜时具有更高转化率的原因是②某温度下,
 在
在 膜表面上的解离过程存在如下平衡:
膜表面上的解离过程存在如下平衡: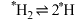 (*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是
(*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是A.Pd膜对气体分子的透过具有选择性
B.过程2的

C.加快
 膜内
膜内 原子迁移有利于
原子迁移有利于 的解离
的解离D.
 原子在
原子在 膜表面上结合为
膜表面上结合为 的过程为放热反应
的过程为放热反应③同温同压下,已知等物质的量的
 和
和 通入无
通入无 膜反应器和
膜反应器和 膜反应器发生反应
膜反应器发生反应 ,无
,无 膜反应器中
膜反应器中 的平衡转化率为
的平衡转化率为 ,相同时间内
,相同时间内 膜反应器出口
膜反应器出口 和出口
和出口 中
中 的物质的量之比为1:8,则使用
的物质的量之比为1:8,则使用 膜反应器
膜反应器 的平衡转化率提高了
的平衡转化率提高了 。
。(4)
 也可采用电化学方法实现,反应装置如图2所示。
也可采用电化学方法实现,反应装置如图2所示。
您最近一年使用:0次
7 . 某实验室测定并计算了在136~180℃范围内下列反应的平衡常数 :
:
①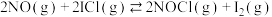
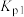
②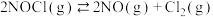
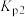
得到 和
和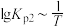 均为线性关系,如下图所示,有关下列说法错误的是
均为线性关系,如下图所示,有关下列说法错误的是
 :
:①
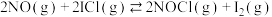
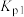
②
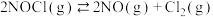
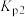
得到
 和
和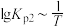 均为线性关系,如下图所示,有关下列说法错误的是
均为线性关系,如下图所示,有关下列说法错误的是
| A.反应②高温下可自发进行 |
B.反应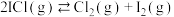 的 的 |
| C.升温,反应体系中分子总数会增大 |
| D.当混合气体颜色不变时,说明反应①和②已达平衡状态 |
您最近一年使用:0次
8 . 为助力实现碳达峰碳中和目标, 资源化利用是重要研究方向。
资源化利用是重要研究方向。
Ⅰ. 催化加氢制烯烃
催化加氢制烯烃 是资源化利用的重要途径之一。该转化过程中涉及的主要反应如下:
是资源化利用的重要途径之一。该转化过程中涉及的主要反应如下:
ⅰ.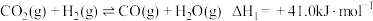
ⅱ.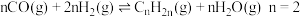 时,
时,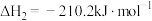
ⅲ.
回答下列问题:
(1)
_______ 。
(2)对于上述(1)的反应,下列说法正确的是_______(填序号)。
(3) 投料比为
投料比为 ,压强为2MPa时,无烷烃产物的平衡体系中
,压强为2MPa时,无烷烃产物的平衡体系中 转化率和产物选择性随反应温度变化曲线如图所示。(已知:含碳物质选择性=n(生成含碳物质所用的
转化率和产物选择性随反应温度变化曲线如图所示。(已知:含碳物质选择性=n(生成含碳物质所用的 )/n(转化的
)/n(转化的 )
)_______ (填化学式)。
②计算1083K时,发生反应的
_______ 。
③373~1173K范围内,773K以后 的转化率升高的原因是
的转化率升高的原因是_______ 。
Ⅱ.一种以甲醇和二氧化碳为原料,利用 和CuO纳米片
和CuO纳米片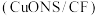 作催化电极,电化学法制备甲酸(甲酸盐)的工作原理如图所示。
作催化电极,电化学法制备甲酸(甲酸盐)的工作原理如图所示。_______ 。
②若有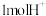 通过质子交换膜时,生成
通过质子交换膜时,生成 和HCOOH共
和HCOOH共_______ mol。
 资源化利用是重要研究方向。
资源化利用是重要研究方向。Ⅰ.
 催化加氢制烯烃
催化加氢制烯烃 是资源化利用的重要途径之一。该转化过程中涉及的主要反应如下:
是资源化利用的重要途径之一。该转化过程中涉及的主要反应如下:ⅰ.
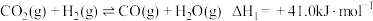
ⅱ.
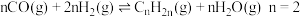 时,
时,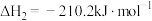
ⅲ.

回答下列问题:
(1)

(2)对于上述(1)的反应,下列说法正确的是_______(填序号)。
| A.低温条件有利于反应自发进行 |
B.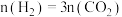 时,反应达平衡 时,反应达平衡 |
| C.恒温恒压下混合气体密度保持不变,则反应达到平衡 |
D.在该反应中增大 投料比可提高 投料比可提高 的平衡转化率 的平衡转化率 |
(3)
 投料比为
投料比为 ,压强为2MPa时,无烷烃产物的平衡体系中
,压强为2MPa时,无烷烃产物的平衡体系中 转化率和产物选择性随反应温度变化曲线如图所示。(已知:含碳物质选择性=n(生成含碳物质所用的
转化率和产物选择性随反应温度变化曲线如图所示。(已知:含碳物质选择性=n(生成含碳物质所用的 )/n(转化的
)/n(转化的 )
)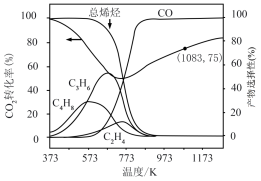
②计算1083K时,发生反应的

③373~1173K范围内,773K以后
 的转化率升高的原因是
的转化率升高的原因是Ⅱ.一种以甲醇和二氧化碳为原料,利用
 和CuO纳米片
和CuO纳米片 作催化电极,电化学法制备甲酸(甲酸盐)的工作原理如图所示。
作催化电极,电化学法制备甲酸(甲酸盐)的工作原理如图所示。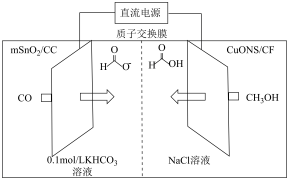
②若有
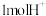 通过质子交换膜时,生成
通过质子交换膜时,生成 和HCOOH共
和HCOOH共
您最近一年使用:0次
名校
解题方法
9 . 深入研究碳、氮元素的物质转化有着重要的实际意义,按要求回答下列问题:
(1)合成尿素的反应为:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。
CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。
(2)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g) CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。___________ ;该总反应的决速步是反应___________ (填“①”或“②”)
(3)已知:CO(g)+N2O(g) CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
(4)在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与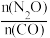 、在
、在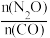 =1时N2O的转化率与
=1时N2O的转化率与 的变化曲线如图3所示:
的变化曲线如图3所示: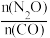 的变化曲线为
的变化曲线为___________ 曲线(填“I”或“Ⅱ”);
②T1___________ T2(填“>”或“<”);
③已知:该反应的标准平衡常数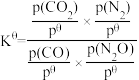 ,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=___________ (列出计算式)。
(1)合成尿素的反应为:2NH3(g)+CO2(g)
 CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。
CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。| A.2v正(NH3)=v逆[CO(NH2)2] | B.压强不再变化 |
| C.混合气体的密度不再变化 | D.CO2的体积分数不再变化 |
(2)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g)
 CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。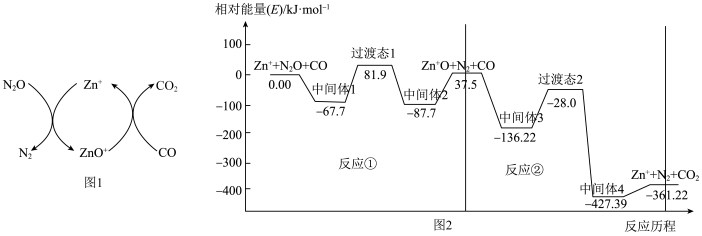
(3)已知:CO(g)+N2O(g)
 CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。| A.升温 | B.恒容时,再充入CO | C.恒容时,再充入N2O | D.恒压时,再充入N2 |
(4)在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与
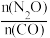 、在
、在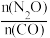 =1时N2O的转化率与
=1时N2O的转化率与 的变化曲线如图3所示:
的变化曲线如图3所示: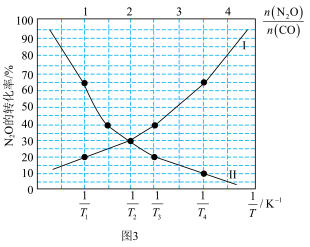
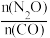 的变化曲线为
的变化曲线为②T1
③已知:该反应的标准平衡常数
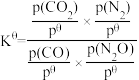 ,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
您最近一年使用:0次
名校
10 . 烟道气中的 本身对于
本身对于 是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。
是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。 还原
还原 的反应有:
的反应有:
ⅰ.
ⅱ.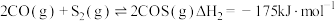
ⅲ.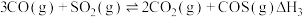
(1)已知:在标准压强、 时,由最稳定的单质合成
时,由最稳定的单质合成 物质
物质 的反应焓变,叫做物质B的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
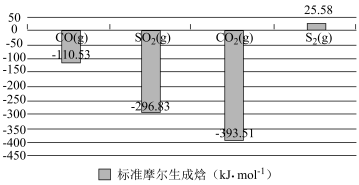
的反应焓变,叫做物质B的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
______ 。 与
与 按物质的量之比为
按物质的量之比为 进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下,
进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下, 的转化率及生成硫的选择性[硫的选择性
的转化率及生成硫的选择性[硫的选择性 ]随反应温度变化的结果如下表所示:
]随反应温度变化的结果如下表所示:
①当以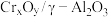 作催化剂时,试分析400℃时反应是否达到平衡状态
作催化剂时,试分析400℃时反应是否达到平衡状态______ (填“平衡”或“未平衡”),理由______ ;请解释 转化率随温度变化的可能原因是
转化率随温度变化的可能原因是______ 。
②根据以上数据判断, 与
与 反应得到硫磺的最合适条件是
反应得到硫磺的最合适条件是______ 。
(3)在一定温度和某催化剂的条件下,将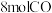 和
和 混合气体置于
混合气体置于 刚性密闭容器中进行上述反应,
刚性密闭容器中进行上述反应, 时反应达到平衡状态,测得
时反应达到平衡状态,测得 的转化率为
的转化率为 ,得到
,得到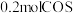 ,计算
,计算 内用
内用 表示的平均反应速率为
表示的平均反应速率为______ ;硫的选择性
______ ;反应ⅰ的平衡常数
______ (列出计算式,不用化简)。
 本身对于
本身对于 是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。
是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。 还原
还原 的反应有:
的反应有:ⅰ.

ⅱ.
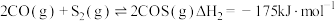
ⅲ.
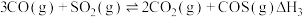
(1)已知:在标准压强、
 时,由最稳定的单质合成
时,由最稳定的单质合成 物质
物质 的反应焓变,叫做物质B的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
的反应焓变,叫做物质B的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
 与
与 按物质的量之比为
按物质的量之比为 进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下,
进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下, 的转化率及生成硫的选择性[硫的选择性
的转化率及生成硫的选择性[硫的选择性 ]随反应温度变化的结果如下表所示:
]随反应温度变化的结果如下表所示:| 温度(℃) | 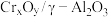 | 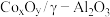 | 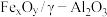 | 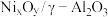 | ||||
| 转化率 | 选择性 | 转化率 | 选择性 | 转化率 | 选择性 | 转化率 | 选择性 | |
| 300 | 0.30 | 0.33 | 0.05 | 0.84 | 0.24 | 0.48 | 0.11 | 0.48 |
| 350 | 0.32 | 0.55 | 0.11 | 0.90 | 0.34 | 0.70 | 0.12 | 0.48 |
| 400 | 0.30 | 0.68 | 0.25 | 0.95 | 0.45 | 0.87 | 0.14 | 0.50 |
| 450 | 0.29 | 0.72 | 0.40 | 0.95 | 0.49 | 0.98 | 0.15 | 0.50 |
| 500 | 0.28 | 0.85 | 0.48 | 0.95 | 0.50 | 1.00 | 0.17 | 0.51 |
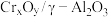 作催化剂时,试分析400℃时反应是否达到平衡状态
作催化剂时,试分析400℃时反应是否达到平衡状态 转化率随温度变化的可能原因是
转化率随温度变化的可能原因是②根据以上数据判断,
 与
与 反应得到硫磺的最合适条件是
反应得到硫磺的最合适条件是(3)在一定温度和某催化剂的条件下,将
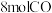 和
和 混合气体置于
混合气体置于 刚性密闭容器中进行上述反应,
刚性密闭容器中进行上述反应, 时反应达到平衡状态,测得
时反应达到平衡状态,测得 的转化率为
的转化率为 ,得到
,得到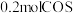 ,计算
,计算 内用
内用 表示的平均反应速率为
表示的平均反应速率为

您最近一年使用:0次