名校
1 . 甲醇是一种理想的储氢载体,我国科学家研发的全球首套太阳能燃料合成项目被称为“液态阳光”计划,可利用太阳能电解水产生 ,再与
,再与 转化为甲醇,以实现碳中和。
转化为甲醇,以实现碳中和。
已知, 生产甲醇过程中涉及反应:
生产甲醇过程中涉及反应:
(1)向某恒温恒压密闭容器中充入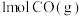 和
和 ,下列能说明反应达到平衡的是___________。
,下列能说明反应达到平衡的是___________。
(2)在 恒温密闭容器中充入
恒温密闭容器中充入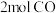 和
和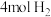 ,在一定条件下经
,在一定条件下经 ,
, 的物质的量为
的物质的量为 。在该条件下,
。在该条件下,
___________  。
。
(3)为了提高CO的转化率,可采取的措施是(写出两条):___________ 。
 ,再与
,再与 转化为甲醇,以实现碳中和。
转化为甲醇,以实现碳中和。已知,
 生产甲醇过程中涉及反应:
生产甲醇过程中涉及反应:
(1)向某恒温恒压密闭容器中充入
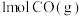 和
和 ,下列能说明反应达到平衡的是___________。
,下列能说明反应达到平衡的是___________。| A.混合气体的密度不再改变 | B.混合气体的平均相对分子质量不再改变 |
| C.两种反应物转化率的比值不再改变 | D.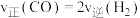 |
 恒温密闭容器中充入
恒温密闭容器中充入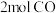 和
和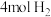 ,在一定条件下经
,在一定条件下经 ,
, 的物质的量为
的物质的量为 。在该条件下,
。在该条件下,
 。
。(3)为了提高CO的转化率,可采取的措施是(写出两条):
您最近一年使用:0次
名校
解题方法
2 . 一定温度下,在容积为 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示:
2.根据图上信息,从反应开始到第一次达到平衡状态时, 的平均反应速率为
的平均反应速率为___________ 。
3.在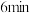 时,可能改变的条件是___________。
时,可能改变的条件是___________。
4.对于该反应,能否通过改变条件使 完全转化为
完全转化为 ?
?___________ (选填“能”或“不能”,原因是___________ 。
 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示: 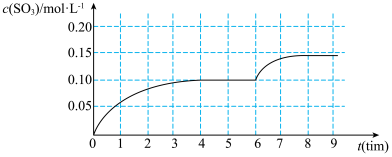
A. | B.压强不变 |
C. 浓度不再发生变化 浓度不再发生变化 | D.密度不变 |
 的平均反应速率为
的平均反应速率为3.在
 时,可能改变的条件是___________。
时,可能改变的条件是___________。| A.降低温度 | B.增加 浓度 浓度 | C.减小压强 | D.增加 浓度 浓度 |
 完全转化为
完全转化为 ?
?
您最近一年使用:0次
名校
3 . 工业上以CO2和NH3为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
反应Ⅱ:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3
(1)反应Ⅰ的熵变ΔS___________  填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=___________ ,反应Ⅲ自发进行的条件是___________ (填“低温”、“高温”、“任何温度”)。
(2)下列关于尿素合成的说法正确的是___________。
(3)1mol CO(NH2)2(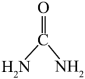 )中含有
)中含有___________ molπ键。NH 离子的VSEPR模型是
离子的VSEPR模型是___________ ,空间构型是___________ 。
(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
反应Ⅰ:2NH3(g)+CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1反应Ⅱ:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;总反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3(1)反应Ⅰ的熵变ΔS
 填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=(2)下列关于尿素合成的说法正确的是___________。
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后其余气体可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
| D.保持压强不变,降低氨碳比[n(NH3)/n(CO2)]可提高反应Ⅰ中NH3的平衡转化率 |
 )中含有
)中含有 离子的VSEPR模型是
离子的VSEPR模型是(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
| A.N的半径较小 | B.N的未成对电子数较多 |
| C.N的电负性较大 | D.N的第一电离能较高 |
您最近一年使用:0次
名校
解题方法
4 . 硅是重要的半导体材料,构成现代电子工业的基础。磷及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途。在工业上,高纯硅可以通过下列流程制取:
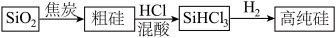
(1)基态硅原子核外电子的运动状态有___________ 种,占据的最高能层符号为___________ 。
(2)流程中由 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是___________ 。请写出一个能说明碳的非金属性强于硅的化学方程式___________ 。
(3) 甲硅烷 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:___________ 。
(4) 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是___________ 。
(5)工业上硅铁可以用于冶镁。以煅白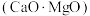 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于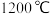 发生反应:
发生反应: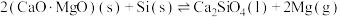 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:___________ 。
(6)有关碳和硅的有关化学键链能如下所示。
硅也有系列氢化物,如甲硅烷等。但硅烷在种类和数量上都远不如烷烃多,原因是___________ 。

(1)基态硅原子核外电子的运动状态有
(2)流程中由
 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是(3) 甲硅烷
 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:(4)
 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是(5)工业上硅铁可以用于冶镁。以煅白
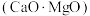 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于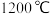 发生反应:
发生反应: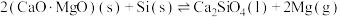 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:(6)有关碳和硅的有关化学键链能如下所示。
| 化学键 |  |  |  |  |  |  |
键能/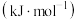 | 356 | 413 | 336 | 226 | 318 | 452 |
您最近一年使用:0次
名校
5 . 习近平主席在《中央城镇化工作会议》发出号召:“让居民望得见山、看得见水、记得住乡愁”。
I.CO2捕集技术能有效解决温室效应及能源短缺问题。
CO2催化加氢制CH3OH的反应体系中,发生的反应如下:
反应a:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
反应b:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应c:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
将CO2与H2按照一定流速通过催化剂反应,测得CO2的转化率与产物的选择性[CH3OH选择性=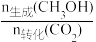 ×100%]随温度变化如图所示:
×100%]随温度变化如图所示:
(1)①ΔH3=______ 。
A.ΔH1+ΔH2 B.ΔH1-ΔH2 C.ΔH1×ΔH2 D.ΔH1÷ΔH2
②反应b的平衡常数表达式为______ 。
(2)电催化还原CO2生成含碳产物(如CO、CH3OH等)原理如图所示:若用Ag负载在TiO2载体上制得Ag/TiO2催化剂,作为电极可促进CO2还原为CO,其机理如图所示。该机理中CO2还原为CO的过程可表述为___________ 。

Ⅱ.NO2和CO是常见的环境污染气体,消除污染对建设美丽家乡,打造宜居环境具有重要意义。
汽车尾气中C、NO2在一定条件下可以发生反应:4CO(g) + 2NO2(g) 4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。

(3)①从反应开始到10 min的平衡状态,N2的平均反应速率为______ 。从11 min起,其他条件不变,压缩容器的容积为1 L,则n(NO2)的变化曲线可能为图中的______ (填abcd字母)。
②使用氢能源可以减少汽车尾气中有害气体的排放。利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g) =CO2(g)+3H2(g),该反应过程中的能量变化如图:

途径(Ⅰ)变为途径(Ⅱ):活化分子的百分率______ 。
A.增大 B.减小 C.不变 D.不一定
Ⅲ.SO2是大气的主要污染物,工业上利用钠碱循环法可除去SO2。
(4)已知:25OC时,H3PO4的电离常数为Ka1=7.5×10-3,Ka2=6.2×10-8 ,Ka3=4.4×10-13;H2SO3的电离常数为Ka1=1.3×10-2,Ka2=6.6×10-8,则下列各组微粒可以大量共存的是_______。
(5)25OC时,H2SO3及其钠盐的溶液中,H2SO3、 、
、 的物质的量分数随溶液pH变化关系如图所示。钠碱循环法中,吸收液为Na2SO3溶液,可用Na2SO3溶液吸收SO2制备NaHSO3。
的物质的量分数随溶液pH变化关系如图所示。钠碱循环法中,吸收液为Na2SO3溶液,可用Na2SO3溶液吸收SO2制备NaHSO3。

①NaHSO3溶液呈酸性,溶液中离子浓度的由大到小排序为_______ 。
②当溶液恰好呈中性时:c(Na+)、c( )、c(
)、c( )的等量关系关系为
)的等量关系关系为_______ 。
I.CO2捕集技术能有效解决温室效应及能源短缺问题。
CO2催化加氢制CH3OH的反应体系中,发生的反应如下:
反应a:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1反应b:CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2反应c:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3将CO2与H2按照一定流速通过催化剂反应,测得CO2的转化率与产物的选择性[CH3OH选择性=
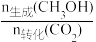 ×100%]随温度变化如图所示:
×100%]随温度变化如图所示:(1)①ΔH3=
A.ΔH1+ΔH2 B.ΔH1-ΔH2 C.ΔH1×ΔH2 D.ΔH1÷ΔH2
②反应b的平衡常数表达式为
(2)电催化还原CO2生成含碳产物(如CO、CH3OH等)原理如图所示:若用Ag负载在TiO2载体上制得Ag/TiO2催化剂,作为电极可促进CO2还原为CO,其机理如图所示。该机理中CO2还原为CO的过程可表述为

Ⅱ.NO2和CO是常见的环境污染气体,消除污染对建设美丽家乡,打造宜居环境具有重要意义。
汽车尾气中C、NO2在一定条件下可以发生反应:4CO(g) + 2NO2(g)
 4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
(3)①从反应开始到10 min的平衡状态,N2的平均反应速率为
②使用氢能源可以减少汽车尾气中有害气体的排放。利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g) =CO2(g)+3H2(g),该反应过程中的能量变化如图:

途径(Ⅰ)变为途径(Ⅱ):活化分子的百分率
A.增大 B.减小 C.不变 D.不一定
Ⅲ.SO2是大气的主要污染物,工业上利用钠碱循环法可除去SO2。
(4)已知:25OC时,H3PO4的电离常数为Ka1=7.5×10-3,Ka2=6.2×10-8 ,Ka3=4.4×10-13;H2SO3的电离常数为Ka1=1.3×10-2,Ka2=6.6×10-8,则下列各组微粒可以大量共存的是_______。
A. 和H3PO4 和H3PO4 | B.H3PO4和 | C. 和 和 | D. 和 和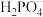 |
(5)25OC时,H2SO3及其钠盐的溶液中,H2SO3、
 、
、 的物质的量分数随溶液pH变化关系如图所示。钠碱循环法中,吸收液为Na2SO3溶液,可用Na2SO3溶液吸收SO2制备NaHSO3。
的物质的量分数随溶液pH变化关系如图所示。钠碱循环法中,吸收液为Na2SO3溶液,可用Na2SO3溶液吸收SO2制备NaHSO3。
①NaHSO3溶液呈酸性,溶液中离子浓度的由大到小排序为
②当溶液恰好呈中性时:c(Na+)、c(
 )、c(
)、c( )的等量关系关系为
)的等量关系关系为
您最近一年使用:0次
名校
6 . 完成下列问题。
(1)合成氨是工业上的重要反应: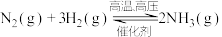 △H<0,下列说法错误的是
△H<0,下列说法错误的是_______ 。
A.增大压强既加快反应速率,又有利于平衡向合成氨方向移动
B.反应达平衡状态后,单位时间内生成1mol N2的同时消耗3mol H2
C.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动
(2)合成氨工业中: △H<0,其化学平衡常数K与温度t的关系如表:
△H<0,其化学平衡常数K与温度t的关系如表:
完成下列填空:
①试比较K1、K2的大小,K1___________ K2(填写“>”、“=”或“<”)。
②400℃时,该反应的化学平衡常数的表达式_______ 。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则此时平衡___________ (填“正向移动”或“逆向移动”或“不移动”),此时
___________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
③已知

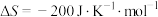 ,则该反应在温度低于
,则该反应在温度低于___________ K时能自发,但工业上选择反应温度在400℃~500℃是为了___________ 。
(1)合成氨是工业上的重要反应:
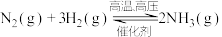 △H<0,下列说法错误的是
△H<0,下列说法错误的是A.增大压强既加快反应速率,又有利于平衡向合成氨方向移动
B.反应达平衡状态后,单位时间内生成1mol N2的同时消耗3mol H2
C.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动
(2)合成氨工业中:
 △H<0,其化学平衡常数K与温度t的关系如表:
△H<0,其化学平衡常数K与温度t的关系如表:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②400℃时,该反应的化学平衡常数的表达式

 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)③已知


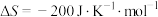 ,则该反应在温度低于
,则该反应在温度低于
您最近一年使用:0次
7 . 我们知道,电解质在溶液中的反应实质是离子之间的反应。通常,离子反应有两种情况,一种是没有电子转移的,是离子互换反应;另一种是有电子转移的,属于氧化还原反应。
在溶液中发生的离子互换反应一般总是向离子浓度减小的方向进行。取4mL1mol·L-1醋酸溶液在试管中,逐滴滴入1mL1mol·L-1碳酸钠溶液。
(1)写出该反应的离子方程式______________ 。
随着碳酸钠溶液的滴加,溶液的pH___________ (填“增大”、“减小”或“不变”)。
(2)这一离子互换反应是否向离子浓度减小方向进行?请应用平衡移动原理进行说明。___________ 。
(3)当碳酸钠溶液全部滴加完后,测得该溶液显酸性,比较该溶液中除H2O以外的微粒浓度大小(不考虑CO2的溶解)_____________________ 。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO +4H++3e-=NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生。
+4H++3e-=NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生。
(4)写出并配平该氧化还原反应的离子方程式,用单线桥法标出电子转移方向和数目。_________ 。
在溶液中发生的离子互换反应一般总是向离子浓度减小的方向进行。取4mL1mol·L-1醋酸溶液在试管中,逐滴滴入1mL1mol·L-1碳酸钠溶液。
(1)写出该反应的离子方程式
随着碳酸钠溶液的滴加,溶液的pH
(2)这一离子互换反应是否向离子浓度减小方向进行?请应用平衡移动原理进行说明。
(3)当碳酸钠溶液全部滴加完后,测得该溶液显酸性,比较该溶液中除H2O以外的微粒浓度大小(不考虑CO2的溶解)
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO
 +4H++3e-=NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生。
+4H++3e-=NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生。(4)写出并配平该氧化还原反应的离子方程式,用单线桥法标出电子转移方向和数目。
您最近一年使用:0次
名校
8 . 利用化学原理研究对废气进行脱硝处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。合理应用和处理氮氧化合物,在生产生活中有着重要的意义。
I.
(1)闪电时空气中的 和
和 会发生反应:
会发生反应:
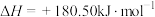 ,
,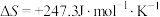 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
II.已知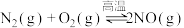 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。
(2)该温度下,向 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是___________ %(保留整数)。
(3)该温度下,某时刻测得容器内 、
、 、
、 的浓度分别为
的浓度分别为 、
、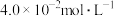 、
、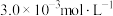 ,此时反应
,此时反应___________ (填“处于化学平衡状态”“正向进行”或“逆向进行”)。请说明理由___________ 。
(4)将 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是___________ 。
A.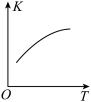 B.
B.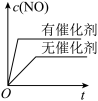 C.
C.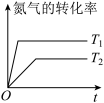
(5)向恒温恒容的密闭容器中充入等物质的量的 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数___________ (填“变大”“变小”或“不变”)。
I.
(1)闪电时空气中的
 和
和 会发生反应:
会发生反应:
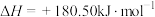 ,
,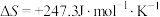 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。| A.在1000℃时,此反应能自发进行 |
| B.在1000℃时,此反应不能自发进行 |
| C.该反应能自发进行的最低温度约为730℃ |
D.该反应能自发进行的最高温度约为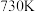 |
II.已知
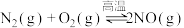 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。(2)该温度下,向
 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是(3)该温度下,某时刻测得容器内
 、
、 、
、 的浓度分别为
的浓度分别为 、
、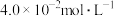 、
、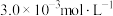 ,此时反应
,此时反应(4)将
 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是A.
 B.
B. C.
C.
(5)向恒温恒容的密闭容器中充入等物质的量的
 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数
您最近一年使用:0次
2023-04-15更新
|
402次组卷
|
3卷引用:上海市卢湾高级中学2022-2023学年高二下学期期中考试(等级考)化学试题
名校
解题方法
9 . 已知反应:

(1)该反应的平衡常数表达式是K=________________________ 。根据表中数据计算1300℃时, 在4分钟内的反应速率=
在4分钟内的反应速率=__________________  。达到平衡时
。达到平衡时 的转化率=
的转化率=__________________ %(结果保留到0.1%)
(2)表中a_________ b,c_________ 1.23(选填“>”、“<”或“=”)。
(3)若在1300℃时达到平衡后,继续往该容器内通入一定量的 (g),则该反应将
(g),则该反应将_________ (填写“向右”、“向左”或“不”)移动,平衡常数K_________ (填写“增大、减小或不变”)。


(1)该反应的平衡常数表达式是K=
 在4分钟内的反应速率=
在4分钟内的反应速率= 。达到平衡时
。达到平衡时 的转化率=
的转化率=(2)表中a
(3)若在1300℃时达到平衡后,继续往该容器内通入一定量的
 (g),则该反应将
(g),则该反应将
您最近一年使用:0次
10 . 黑火药是我国四大发明之一,它爆炸时发生多种化学反应,其中主要的化学反应方程式为:
(1)反应物中被称为“中国盐”的化学式是_______ 。生成物中属于非电解质的电子式是_______ 。收集黑火药爆炸后的烟尘与酸性高锰酸钾溶液反应,能使溶液紫红色褪去,烟尘中能使酸性高锰酸钾溶液褪色的物质名称是_______ 。
(2)反应中,还原剂是_______ ,被还原的元素是_______ 。每生成 氧化产物,转移的电子数是
氧化产物,转移的电子数是_______  ,消耗
,消耗 的质量为
的质量为_______ g(保留1位小数)。
(3)有人提出将 通过管道输送到海底,可减缓空气中
通过管道输送到海底,可减缓空气中 浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。结合必要的化学用语,简要分析海水酸性增强的原因
浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。结合必要的化学用语,简要分析海水酸性增强的原因_______ 。

(1)反应物中被称为“中国盐”的化学式是
(2)反应中,还原剂是
 氧化产物,转移的电子数是
氧化产物,转移的电子数是 ,消耗
,消耗 的质量为
的质量为(3)有人提出将
 通过管道输送到海底,可减缓空气中
通过管道输送到海底,可减缓空气中 浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。结合必要的化学用语,简要分析海水酸性增强的原因
浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。结合必要的化学用语,简要分析海水酸性增强的原因
您最近一年使用:0次



