名校
1 . 工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。
,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。
1. 和
和 在溶液中有如下的转化关系:
在溶液中有如下的转化关系: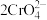 (黄色)
(黄色)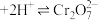 (橙色)
(橙色) 若平衡体系pH较低时,此时溶液显
若平衡体系pH较低时,此时溶液显___________ 色。
2.室温下,初始浓度为1.0 的
的 溶液中
溶液中 的平衡浓度随
的平衡浓度随 的变化如图所示,下列关于该反应的说法错误的是
的变化如图所示,下列关于该反应的说法错误的是___________ 。
B.A点的平衡转化率为50%
C.若向A点溶液中加入少量 固体,达到新平衡后,pH值升高,转化率升高
固体,达到新平衡后,pH值升高,转化率升高
D.若达到A点的时间为5s,则0~5s内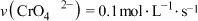
请根据图中A点数据,计算反应的平衡常数为___________ 。
某工厂采取还原沉淀法处理,该法的工艺流程为:
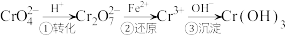
3. 的核外电子排布式是
的核外电子排布式是___________ 。
4.第②步反应的离子方程式为___________ 。
5. 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: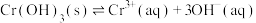 ,常温下,
,常温下, 的溶度积
的溶度积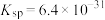 ,要使
,要使 降至
降至 时,溶液的pH应调至
时,溶液的pH应调至___________ 。(写出简单的计算过程)
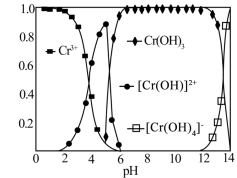
6.常温下,Cr(Ⅲ)(表示+3价的铬)在水溶液中的存在形态分布如图所示。当pH>12时,溶液中Cr(Ⅲ)去除率下降的原因可用离子方程式表示为___________ 。 ,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是
,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是___________ 。
 和
和 ,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。
,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。1.
 和
和 在溶液中有如下的转化关系:
在溶液中有如下的转化关系: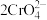 (黄色)
(黄色)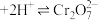 (橙色)
(橙色) 若平衡体系pH较低时,此时溶液显
若平衡体系pH较低时,此时溶液显2.室温下,初始浓度为1.0
 的
的 溶液中
溶液中 的平衡浓度随
的平衡浓度随 的变化如图所示,下列关于该反应的说法错误的是
的变化如图所示,下列关于该反应的说法错误的是
B.A点的平衡转化率为50%
C.若向A点溶液中加入少量
 固体,达到新平衡后,pH值升高,转化率升高
固体,达到新平衡后,pH值升高,转化率升高D.若达到A点的时间为5s,则0~5s内
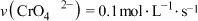
请根据图中A点数据,计算反应的平衡常数为
某工厂采取还原沉淀法处理,该法的工艺流程为:
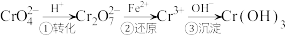
3.
 的核外电子排布式是
的核外电子排布式是4.第②步反应的离子方程式为
5.
 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: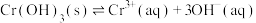 ,常温下,
,常温下, 的溶度积
的溶度积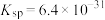 ,要使
,要使 降至
降至 时,溶液的pH应调至
时,溶液的pH应调至6.常温下,Cr(Ⅲ)(表示+3价的铬)在水溶液中的存在形态分布如图所示。当pH>12时,溶液中Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
 ,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是
,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是
您最近一年使用:0次
名校
2 . 含氯化合物在工农业生产和日常生活中用途十分广泛。
Ⅰ.使用软锰矿为原料精制高纯度的MnO2,并运用综合制取技术最终制取含氯漂白液、漂白粉的工艺流程如图。

(1)过程Ⅳ中,MnO2与浓盐酸反应的离子方程式为______ 。
(2)过程Ⅲ中,MnO2 在___________极产生。
(3)过程Ⅴ制备漂白液(有效成分NaClO)和漂白粉(有效成分Ca(ClO)2)。
①有关漂白粉的说法正确的是:______ 。
A.漂白粉是混合物,其有效成分是次氯酸钙
B.为了增强漂白粉漂白效果,使用时可加少量食醋
C.漂白粉见光不稳定,应当避光放置
D.漂白粉可与CO2 、 H2O 反应,由此可判断次氯酸的酸性弱于碳酸
②漂白液与洁厕灵(主要成分为浓盐酸)禁止混用的原因(用离子方程式表示):______ 。
Ⅱ.氯气可用于海水提溴,其工艺流程如图。

(4)进入吹出塔前海水与Cl2发生反应时往往向其中滴入一些稀硫酸,原因为________ 。
(5)从吸收塔流出的溶液中主要含的负离子有___________。
Ⅲ.为探究氯气的性质,某同学设计了如图所示的实验装置。

(6)A为氯气制备装置,装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,请提出合理的改进方法:________ 。E中的反应的离子方程方程式为________ 。
(7)为验证尾气吸收后的溶液中存在Cl-,正确的操作是________ 。
Ⅰ.使用软锰矿为原料精制高纯度的MnO2,并运用综合制取技术最终制取含氯漂白液、漂白粉的工艺流程如图。

(1)过程Ⅳ中,MnO2与浓盐酸反应的离子方程式为
(2)过程Ⅲ中,MnO2 在___________极产生。
| A.正极 | B.负极 | C.阳极 | D.阴极 |
(3)过程Ⅴ制备漂白液(有效成分NaClO)和漂白粉(有效成分Ca(ClO)2)。
①有关漂白粉的说法正确的是:
A.漂白粉是混合物,其有效成分是次氯酸钙
B.为了增强漂白粉漂白效果,使用时可加少量食醋
C.漂白粉见光不稳定,应当避光放置
D.漂白粉可与CO2 、 H2O 反应,由此可判断次氯酸的酸性弱于碳酸
②漂白液与洁厕灵(主要成分为浓盐酸)禁止混用的原因(用离子方程式表示):
Ⅱ.氯气可用于海水提溴,其工艺流程如图。

(4)进入吹出塔前海水与Cl2发生反应时往往向其中滴入一些稀硫酸,原因为
(5)从吸收塔流出的溶液中主要含的负离子有___________。
| A.OH- | B.Br- | C. | D. |
Ⅲ.为探究氯气的性质,某同学设计了如图所示的实验装置。

(6)A为氯气制备装置,装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,请提出合理的改进方法:
(7)为验证尾气吸收后的溶液中存在Cl-,正确的操作是
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题。
(1)为探究 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:
将适量 加入
加入 溶液中,若观察到
溶液中,若观察到___________ ,则可证明还原性 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:___________ 。
(2)为了证明 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:___________

(1)为探究
 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:将适量
 加入
加入 溶液中,若观察到
溶液中,若观察到 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:(2)为了证明
 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
您最近一年使用:0次
4 . CO2的综合利用,通过化学的方法实现CO2的资源化利用是一种理想的CO2减排途径。
Ⅰ.利用酸性水溶液电解池在铂电极上捕集CO2制储氢物质HCOOH
(1)CO2被___________ (填“氧化”或“还原”)为HCOOH,该铂电极为___________ 极。
(2)写出该铂电极的电极方程式___________ 。
(3)当电路中转移3 mol电子时,理论上可生成HCOOH___________ g。
Ⅱ.利用CO2制备CO
一定温度下,在恒容密闭容器中投入一定量CO2和H2进行反应:CO2(g) + H2(g) CO(g) + H2O(g)。
CO(g) + H2O(g)。
(4)下列事实能说明上述反应达到平衡状态的是__________。
(5)在恒定温度与容积下,可以提高CO2平衡转化率的措施有__________。
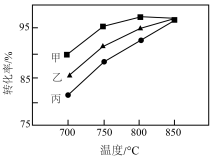
(6)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得氢气转化率随温度变化如图所示。下列说法错误的是_________。
Ⅲ.利用CO2制备甲醇
一定条件下,向恒容密闭容器中通入一定量的CO2和H2.涉及反应如下:
主反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH = −90.4 kJ/mol
CH3OH(g) + H2O(g) ΔH = −90.4 kJ/mol
副反应:CO2(g) + H2(g) CO(g) + H2O(g) ΔH = +40.5 kJ/mol
CO(g) + H2O(g) ΔH = +40.5 kJ/mol
(7)其他条件相同,不同压强下,平衡时CO2转化率随温度的变化关系如图所示。
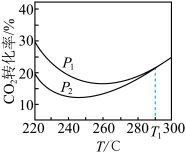
①压强P1___________ P2(填“<”或“>”)。
②图中温度高于T1时,两条曲线重叠的原因是:___________ 。
(8)实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、n(CO2):n(H2) = 1:3,持续通入原料,同时控制出气流量。
①为了维持体系压强恒定,需控制出气流量小于进气流量,原因为:___________ 。
②已知出气流量为0.03 mol/min,单位时间CO2的转化率为60 %,则流出气体中CO的百分含量为___________ 。
Ⅰ.利用酸性水溶液电解池在铂电极上捕集CO2制储氢物质HCOOH
(1)CO2被
(2)写出该铂电极的电极方程式
(3)当电路中转移3 mol电子时,理论上可生成HCOOH
Ⅱ.利用CO2制备CO
一定温度下,在恒容密闭容器中投入一定量CO2和H2进行反应:CO2(g) + H2(g)
 CO(g) + H2O(g)。
CO(g) + H2O(g)。(4)下列事实能说明上述反应达到平衡状态的是__________。
| A.体系内n(CO) : n(H2O) = 1 : 1 | B.体系压强不再发生变化 |
| C.体系内各物质浓度不再发生变化 | D.体系内CO的体积分数不再发生变化 |
(5)在恒定温度与容积下,可以提高CO2平衡转化率的措施有__________。
| A.向反应容器中充入H2 | B.向反应容器中充入CO2 |
| C.添加更有效的催化剂 | D.利用合适试剂干燥混合气体 |
(6)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得氢气转化率随温度变化如图所示。下列说法错误的是_________。

| A.850℃下,该时间段内甲、乙、丙可能均达到平衡 |
| B.700℃下,甲对应的活化能最大 |
| C.一般催化剂既能降低活化能,又能降低过渡态的能量 |
| D.其它条件一定时,随着温度升高,单位体积内活化分子数占比增大 |
Ⅲ.利用CO2制备甲醇
一定条件下,向恒容密闭容器中通入一定量的CO2和H2.涉及反应如下:
主反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH = −90.4 kJ/mol
CH3OH(g) + H2O(g) ΔH = −90.4 kJ/mol副反应:CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH = +40.5 kJ/mol
CO(g) + H2O(g) ΔH = +40.5 kJ/mol(7)其他条件相同,不同压强下,平衡时CO2转化率随温度的变化关系如图所示。

①压强P1
②图中温度高于T1时,两条曲线重叠的原因是:
(8)实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、n(CO2):n(H2) = 1:3,持续通入原料,同时控制出气流量。
①为了维持体系压强恒定,需控制出气流量小于进气流量,原因为:
②已知出气流量为0.03 mol/min,单位时间CO2的转化率为60 %,则流出气体中CO的百分含量为
您最近一年使用:0次
5 . Ⅰ.氮的固定是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分K值。
(1)分析数据可知:大气固氮反应属于___________ (“吸热”或 “放热”)反应。
(2)分析数据可知:人类___________ ( “适合”或 “不适合”)大规模模拟大气固氮。
(3)从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择 左右的高温,解释其原因:
左右的高温,解释其原因:___________ 。
Ⅱ.已知工业固氮反应: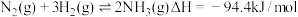 。恒容时,体系中各物质浓度随时间变化的曲线如图所示,各时间段最终均达平衡状态。
。恒容时,体系中各物质浓度随时间变化的曲线如图所示,各时间段最终均达平衡状态。
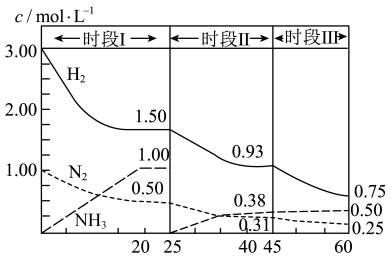
(4)在 容器中发生反应,前
容器中发生反应,前 内,
内,
___________ 。
(5) 时采取的某种措施是
时采取的某种措施是___________ 。
(6)时段Ⅲ条件下反应的平衡常数为___________ (保留2位小数)。
Ⅲ.20世纪末,科学家采用高质子导电性的 陶瓷(能传递
陶瓷(能传递 )为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如下图所示:
)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如下图所示:
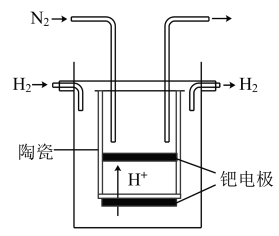
(7)阴极的电极反应式是___________ 。
| 反应 | 大气固氮 | 工业固氮 | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K |  | 0.1 | 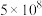 | 0.507 | 0.152 |
(1)分析数据可知:大气固氮反应属于
(2)分析数据可知:人类
(3)从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择
 左右的高温,解释其原因:
左右的高温,解释其原因:Ⅱ.已知工业固氮反应:
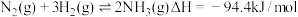 。恒容时,体系中各物质浓度随时间变化的曲线如图所示,各时间段最终均达平衡状态。
。恒容时,体系中各物质浓度随时间变化的曲线如图所示,各时间段最终均达平衡状态。
(4)在
 容器中发生反应,前
容器中发生反应,前 内,
内,
(5)
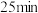 时采取的某种措施是
时采取的某种措施是(6)时段Ⅲ条件下反应的平衡常数为
Ⅲ.20世纪末,科学家采用高质子导电性的
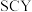 陶瓷(能传递
陶瓷(能传递 )为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如下图所示:
)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如下图所示:
(7)阴极的电极反应式是
您最近一年使用:0次
名校
解题方法
6 . 工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g) ΔH<0
(1)书写该反应的平衡常数表达式K=___________ 。
(2)反应达到平衡后,为提高反应速率的同时提高NO2的转化率,可采取的措施有___________。
(3)在体积一定的容器中进行上述反应并达到平衡,保持其它条件不变,通入一定量的CH4,下列说法正确的是___________。
(1)书写该反应的平衡常数表达式K=
(2)反应达到平衡后,为提高反应速率的同时提高NO2的转化率,可采取的措施有___________。
| A.改用高效催化剂 | B.升高温度 |
| C.缩小容器的体积 | D.增加CH4的浓度 |
| A.正反应速率先增大后减小 | B.混合气体的平均密度增大 |
| C.化学平衡常数增大 | D.达到新平衡时 增大 增大 |
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.下图为工业合成氨的流程图:
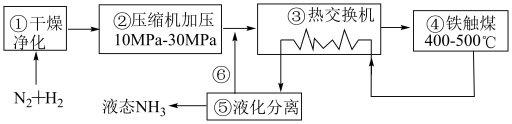
(1)⑥循环利用的物质是___________ ,①的气体若不进化,容易造成的问题是___________
(2)上述流程中能增加反应速率的是___________ ,能提高原料转化率的是___________ 。(填数字编号)
Ⅱ.某兴趣小组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:(反应起始的温度和体积均相同):
(3)则:
___________  、
、
___________ 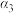 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)

(1)⑥循环利用的物质是
(2)上述流程中能增加反应速率的是
Ⅱ.某兴趣小组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:(反应起始的温度和体积均相同):
| 序号 | 起始投入量 | 平衡转化率 | ||
 |  |  | ||
| ①恒温恒容 |  |  | 0 |  |
| ②绝热恒容 |  |  | 0 |  |
| ③恒温恒压 |  |  | 0 | 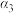 |
(3)则:

 、
、
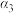 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
您最近一年使用:0次
名校
解题方法
8 . 一碳化学是指以分子中只含一个碳原子的化合物为原料,用化工的方法制造产品的化学体系的名称。甲烷、一氧化碳是常见的一碳化学的原料。已知反应:
①
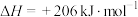
②
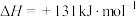
③
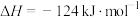
(1)工业制炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。该反应的热化学方程式为_______ 。
(2)已知反应①中相关的化学键键能数据如下:
可知CO中C≡O键的键能为_______  。
。
(3)向恒容绝热的密闭容器中充入a mol 与2a mol
与2a mol  (g),进行反应①,下列能判断反应已达化学平衡状态的是
(g),进行反应①,下列能判断反应已达化学平衡状态的是_______ 。
a.容器中混合气体密度不变 b.混合气体中 与
与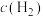 之比不变
之比不变
c.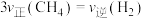 d.容器内温度不变
d.容器内温度不变
(4)反应②的正反应活化能为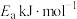 ,则逆反应的活化能为
,则逆反应的活化能为_______  。对反应②的自发性进行判断并说明理由。
。对反应②的自发性进行判断并说明理由。_______
(5)向容积固定为1L的密闭容器内充入2mol CO和4mol ,保持250℃发生反应③,用压力计监测反应过程中容器内压强的变化如下表:
,保持250℃发生反应③,用压力计监测反应过程中容器内压强的变化如下表:
①从开始到20min时,以CO浓度变化表示的平均反应速率
_______ 。
②25℃时反应③平衡常数 的值为
的值为_______ 。
③在容器容积不变的前提下,欲提高反应③中 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有_______ 、_______ (任写两项)。
①

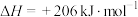
②

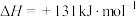
③

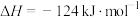
(1)工业制炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。该反应的热化学方程式为
(2)已知反应①中相关的化学键键能数据如下:
| 化学键 | C-H | O-H | H-H |
键能/ | 413 | 465 | 436 |
 。
。(3)向恒容绝热的密闭容器中充入a mol
 与2a mol
与2a mol  (g),进行反应①,下列能判断反应已达化学平衡状态的是
(g),进行反应①,下列能判断反应已达化学平衡状态的是a.容器中混合气体密度不变 b.混合气体中
 与
与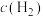 之比不变
之比不变c.
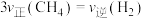 d.容器内温度不变
d.容器内温度不变(4)反应②的正反应活化能为
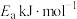 ,则逆反应的活化能为
,则逆反应的活化能为 。对反应②的自发性进行判断并说明理由。
。对反应②的自发性进行判断并说明理由。(5)向容积固定为1L的密闭容器内充入2mol CO和4mol
 ,保持250℃发生反应③,用压力计监测反应过程中容器内压强的变化如下表:
,保持250℃发生反应③,用压力计监测反应过程中容器内压强的变化如下表:| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | p | 0.82p | 0.68p | 0.56p | 0.50p | 0.50p |

②25℃时反应③平衡常数
 的值为
的值为③在容器容积不变的前提下,欲提高反应③中
 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有
您最近一年使用:0次
名校
9 . CO 变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol⁻1。
(1)一定温度下,反应后测得各组分的平衡压强(即该组分的物质的量分数×总压): p(CO)=0.25 MPa、p(H2O)=0.25 MPa、p(CO2)=0.75 MPa 和 p(H2)=0.75 MPa,则该反应的平衡常数 Kp=___________ 。维持相同的温度和总压,提高水蒸气的投料比例,使 CO 的平衡转化率提高到 90%,则原料气中水蒸气和 CO 的物质的量之比为___________ 。
(2)生产过程中,为了提高变换反应的速率,下列措施中合适的是___________。
(3)以固体催化剂 M 催化 CO 变换反应,能量-反应过程关系如下图所示。步骤___________ 为决速步。(选填“I”或“II”)

用化学方程式表示该催化反应历程:
步骤 I: M(s)+H2O(g)=MO(s)+H2(g), 步骤 II:___________ 。
(1)一定温度下,反应后测得各组分的平衡压强(即该组分的物质的量分数×总压): p(CO)=0.25 MPa、p(H2O)=0.25 MPa、p(CO2)=0.75 MPa 和 p(H2)=0.75 MPa,则该反应的平衡常数 Kp=
(2)生产过程中,为了提高变换反应的速率,下列措施中合适的是___________。
| A.反应温度越高越好 | B.适当提高反应物压强 |
| C.选择合适的催化剂 | D.通入一定量的 N2 |

用化学方程式表示该催化反应历程:
步骤 I: M(s)+H2O(g)=MO(s)+H2(g), 步骤 II:
您最近一年使用:0次
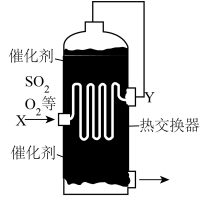
10 . 硫、氮是主要的非金属元素,也是人类较早认识的化学元素。硫元素与氮元素也都是生命元素,在自然界中有重要的循环过程。人类对硫、氮元素的利用,其本质就是通过各种化学反应,实现物质之间的转化,如硫酸工业就是人类对硫元素的利用。
(1)生产、生活中,与SO2的大量排放有关的环境问题是_______。(选填编号)
(2)氮循环和硫循环是自然界中两种重要的元素循环过程。请选出下表中关于这两种循环的正确评价_______ 。(选填编号)
任选其中一种错误评价,解释判断理由:_______ 。
硫酸工业生产的核心阶段是转化,转化率越高,则硫的利用率越高,对环境影响也越小。转化阶段发生的反应:2SO2+O2 2SO3(放热反应)
2SO3(放热反应)
(3)上述反应中,反应物的总能量_______ (选填“大于”或“小于”)生成物的总能量。
(4)为合理利用反应中产生的热量,热交换器在硫酸工业中与下列_______设备合为一体。(选填编号)
(5)图中,Y处的气体是_______。(选填编号)
一定温度下,在容积为2L的密闭容器内,通入一定量的SO2和空气,在给定条件下发生反应生成SO3的物质的量浓度变化如下图所示:

(6)不能说明反应已达平衡状态的是_______。(选填编号)
(7)根据图上信息,从反应开始到第一次达到平衡状态时,SO3的平均反应速率为_______ 。
(8)在6min时,可能改变的条件是_______。(选填编号)
(9)对于该反应,能否通过改变条件使SO2完全转化为SO3?_______ (选填“能”或“不能”),原因是_______ 。
(1)生产、生活中,与SO2的大量排放有关的环境问题是_______。(选填编号)
| A.酸雨 | B.PM2.5 | C.温室效应 | D.白色污染 |
| 编号 | 比较 | 氮循环 | 硫循环 |
| ① | 异 | 氮元素会进入大气 | 硫循环不会进入大气 |
| ② | 氮元素可以有机化合物形式参与循环 | 硫元素都以无机化合物形式参与循环 | |
| ③ | 同 | 人类活动对氮循环和硫循环都造成了巨大影响 | |
| ④ | 氮循环和硫循环对环境影响都导致温室效应 | ||
硫酸工业生产的核心阶段是转化,转化率越高,则硫的利用率越高,对环境影响也越小。转化阶段发生的反应:2SO2+O2
 2SO3(放热反应)
2SO3(放热反应)(3)上述反应中,反应物的总能量
(4)为合理利用反应中产生的热量,热交换器在硫酸工业中与下列_______设备合为一体。(选填编号)
| A.沸腾炉 | B.净化器 | C.转化器 | D.吸收塔 |

| A.低温的SO2、O2 | B.低温的SO2、O2和SO3 |
| C.高温的SO2、O2 | D.高温的SO2、O2和SO3 |
一定温度下,在容积为2L的密闭容器内,通入一定量的SO2和空气,在给定条件下发生反应生成SO3的物质的量浓度变化如下图所示:

(6)不能说明反应已达平衡状态的是_______。(选填编号)
| A.v(SO2)正=2v(O2)逆 | B.压强不变 |
| C.SO2浓度不再发生变化 | D.密度不变 |
(8)在6min时,可能改变的条件是_______。(选填编号)
| A.降低温度 | B.增加O2浓度 |
| C.减小压强 | D.增加SO3浓度 |
您最近一年使用:0次



