名校
1 . 下列事实能用化学平衡移动原理解释的是
①光照新制的氯水时,溶液的pH逐渐减小
②在铂铑合金催化下缩短N2和H2合成氨的时间
③可用浓氨水和氢氧化钠固体快速制取氨气
④红棕色的NO2,加压后颜色先变深后变浅
⑤对容积可变的密闭容器中已达平衡的HI、I2、H2混合气体进行压缩,混合气体颜色变深
⑥打开可乐瓶盖后看到有大量气泡逸出
⑦实验室中常用排饱和食盐水的方法收集氯气
①光照新制的氯水时,溶液的pH逐渐减小
②在铂铑合金催化下缩短N2和H2合成氨的时间
③可用浓氨水和氢氧化钠固体快速制取氨气
④红棕色的NO2,加压后颜色先变深后变浅
⑤对容积可变的密闭容器中已达平衡的HI、I2、H2混合气体进行压缩,混合气体颜色变深
⑥打开可乐瓶盖后看到有大量气泡逸出
⑦实验室中常用排饱和食盐水的方法收集氯气
| A.①②④⑤⑦ | B.①③④⑥⑦ |
| C.①③④⑤⑥⑦ | D.①④⑤⑥⑦ |
您最近一年使用:0次
2021-09-26更新
|
424次组卷
|
2卷引用:湖北省武汉市江夏实验高级中学2021-2022学年高二上学期10月考试化学试题
11-12高二上·海南·期末
2 . 如图是关于反应A2(g)+3B2(g)⇌2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是


| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
您最近一年使用:0次
2021-09-02更新
|
871次组卷
|
52卷引用:2014-2015学年湖北省部分重点中学高二上学期期中考试化学试卷
(已下线)2014-2015学年湖北省部分重点中学高二上学期期中考试化学试卷(已下线)2010—2011学年海南省洋浦中学高二上学期期末考试化学试卷(已下线)2011-2012年吉林省长春外国语学校高二上学期第一次月考化学试卷(已下线)2011-2012学年云南省蒙自县文澜高级中学高二上学期期中考试化学试卷(已下线)2011-2012学年贵州省凯里一中高二上学期期中考试化学试卷(已下线)2011-2012学年云南蒙自高中高二上学期期中考试化学试卷(已下线)2012-2013学年安徽省舒城晓天中学高二上学期第一次月考化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷(已下线)2012-2013学年山东省临沭一中高二10月学情调查化学试卷(已下线)2014年高二化学人教版选修四 8化学平衡移动练习卷(已下线)2013-2014四川省雅安中学下学期期中考试高二化学试卷(已下线)2011-2012贵州省凯里一中第一学期期末考试高二化学试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷(已下线)2014-2015学年湖南省娄底市高二上学期期中联考化学试卷(已下线)2014秋河北省唐山一中高二上学期期中化学试卷(已下线)2014-2015学年辽宁师范大学附中高二10月模考化学试卷2014-2015学年山东省微山一中高二下学期期末考试化学试卷2015-2016学年河北省成安一中高二上学期10月月考化学试卷2015-2016学年江苏省海安实验中学高二上学期期中选修化学试卷2015-2016学年四川省成都市六校高二上学期期中联考化学试卷2015-2016学年山东省泰安市高二上学期期末考试化学试卷2016-2017学年贵州省安顺平坝第一高级中学高二上期中化学卷2016-2017学年浙江省余姚中学高二上期中化学试卷安徽省六安市第一中学2017-2018学年高二上学期开学考试化学试题河北省定州中学2017-2018学年高二上学期开学考试化学试题河南省林州市第一中学分校(林虑中学)2017-2018学年高二上学期开学检测化学试题河北省深州中学2016-2017学年高二下学期期末考试化学试题云南省姚安县第一中学2017-2018学年高二10月月考化学试题甘肃省武威市第十八中2018-2019学年高二上学期第一次月考化学试题步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析黑龙江桦南二中2019-2020学年高二上学期期中考试化学试题天津市和平区2018-2019高二期末考试化学试题黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题江苏省宿迁市沭阳县潼阳中学2020-2021学年高二下学期第一次月考化学试题湖南省长沙市周南中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.3.3 温度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)湖南省怀化市第五中学2021-2022学年高二上学期期中考试化学试题甘肃省武威市凉州区2020-2021学年高二上学期期末考试化学试题浙江省嘉兴市海盐第二高级中学2021-2022学年高二上学期(10月)阶段检测化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期11月期中化学试题2015届吉林省东北师大附中高三上学期第三次摸底化学试卷河北省故城县高级中学2018届高三12月月考化学试题【区级联考】山东省济南市莱芜区2019届高三第一学期期末质量检测化学试题2020届人教版高三专题基础复习专题7《化学反应速率与化学平衡》测试卷山西省运城市稷山中学2022届高三上学期月考(一)化学试题(已下线)第19讲 化学平衡 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题云南省玉溪师范学院附属中学2021-2022学年高三 上学期期末考试化学试题(已下线)第6章 化学反应速率和化学平衡复习-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)上海市嘉定区第一中学2021-2022学年高一下学期期期末考试化学试题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)
3 . 无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g)⇌4AlCl3(g)+3O2(g) ΔH>0。下列分析正确的是
| A.增大Al2O3用量,化学平衡向正反应方向移动 |
| B.电解熔融的Al2O3和AlCl3均能得到单质铝 |
| C.加入碳粉,平衡正向移动是因为碳与O2反应,降低了生成物的浓度且放出热量 |
| D.其他条件不变时,升高温度,正反应速率加快,逆反应速率减慢 |
您最近一年使用:0次
2021-07-16更新
|
174次组卷
|
2卷引用:湖北省新高考联考协作体2020-2021学年高二下学期收心考试化学试题
解题方法
4 . 下列实验方案设计中,能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 探究浓度对平衡移动的影响 | 对于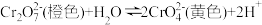 ,取两支试管各加入5mL0.1mol·L-1K2Cr2O7溶液,滴加3~10滴浓硫酸,溶液黄色加深 ,取两支试管各加入5mL0.1mol·L-1K2Cr2O7溶液,滴加3~10滴浓硫酸,溶液黄色加深 |
| B | 检验绿茶中是否含有酚类物质 | 取少量茶水于试管中,向其中滴加FeCl3溶液,观察溶液是否显紫色 |
| C | 验证溶度积:Ksp[Cu(OH)2]<Ksp[Mg(OH)2] | 取一支试管装入2mL2mol/LNaOH溶液,先滴加1mL1mol/LMgCl2溶液,再滴加几滴1mol/LCuCl2溶液,先生成白色沉淀,后沉淀变为蓝色 |
| D | 苯甲酸的重结晶实验 | 苯甲酸的溶解度随温度的降低而减小,故趁热过滤后,为了析出更多晶体,热滤液可用冰盐水充分冷却,同时缩短了结晶时间,所以温度越低越有利于苯甲酸的重结晶 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
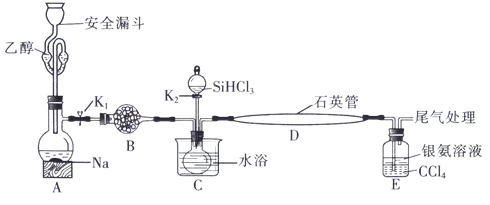
5 . 高纯硅被誉为“信息革命的催化剂”。某小组模拟工业上用 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:① 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为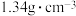 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
② ;
;
③银氨溶液中存在: 。
。
回答下列问题:
(1)装置B中试剂宜选择___________ (填字母,单选)。
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加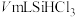 ;
;
④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为___________ (填序号)。
(3)E中CCl4的作用是防倒吸和___________ 。“防倒吸”原理是___________ 。用化学平衡原理解释银氨溶液中有白色沉淀生成:___________ 。
(4)石英管中发生反应的化学方程式为___________ 。
(5)本实验制得高纯硅ag,则SiHCl3的利用率为___________ (只列计算式)。实验结束后,有同学认为根据高纯硅与消耗钠或乙醇的量也可以计算SiHCl3的利用率,这种观点___________ (填“是”或“否”)正确。
 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:①
 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为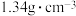 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;②
 ;
;③银氨溶液中存在:
 。
。回答下列问题:
(1)装置B中试剂宜选择
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加
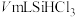 ;
;④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为
(3)E中CCl4的作用是防倒吸和
(4)石英管中发生反应的化学方程式为
(5)本实验制得高纯硅ag,则SiHCl3的利用率为
您最近一年使用:0次
2021-07-04更新
|
522次组卷
|
2卷引用:湖北省2020-2021学年高二下学期7月统一调研测试化学试题
6 . 含碳物质的价值型转化,有利于“减碳”和可持续发展。回答下列问题:
(1)科学家用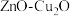 做催化剂,可将
做催化剂,可将 和
和 转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为
转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为___________ 。

(2)用惰性电极电解 溶液,可将空气中的
溶液,可将空气中的 转化为甲酸根(
转化为甲酸根( ),然后进一步可制得化工原料甲酸。
),然后进一步可制得化工原料甲酸。 发生反应的电极反应式为
发生反应的电极反应式为___________ ,若电解过程中转移1mol电子,阳极生成氧气的体积(标准状况)为___________ L。
(3)乙苯催化脱氢制取苯乙烯的反应为: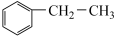 (g)+CO2(g)
(g)+CO2(g)
 (g)+H2O(g)+CO(g),其反应历程如下:
(g)+H2O(g)+CO(g),其反应历程如下:
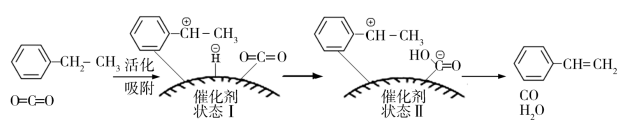
①由原料到“状态Ⅰ”___________ (填“放出”或“吸收”)能量。
②一定温度下,向恒容密闭容器中充入2mol乙苯和 ,起始压强为
,起始压强为 ,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
,平衡时容器内气体总物质的量为5mol,乙苯的转化率为___________ ,用平衡分压代替平衡浓度表示的化学平衡常数
___________ 。
③乙苯平衡转化率与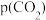 的关系如图所示,乙苯平衡转化率随着
的关系如图所示,乙苯平衡转化率随着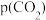 变化的原因是
变化的原因是___________ 。

(1)科学家用
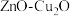 做催化剂,可将
做催化剂,可将 和
和 转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为
转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为
(2)用惰性电极电解
 溶液,可将空气中的
溶液,可将空气中的 转化为甲酸根(
转化为甲酸根( ),然后进一步可制得化工原料甲酸。
),然后进一步可制得化工原料甲酸。 发生反应的电极反应式为
发生反应的电极反应式为(3)乙苯催化脱氢制取苯乙烯的反应为:
 (g)+CO2(g)
(g)+CO2(g)
 (g)+H2O(g)+CO(g),其反应历程如下:
(g)+H2O(g)+CO(g),其反应历程如下:
①由原料到“状态Ⅰ”
②一定温度下,向恒容密闭容器中充入2mol乙苯和
 ,起始压强为
,起始压强为 ,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
③乙苯平衡转化率与
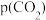 的关系如图所示,乙苯平衡转化率随着
的关系如图所示,乙苯平衡转化率随着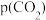 变化的原因是
变化的原因是
您最近一年使用:0次
19-20高三·江苏苏州·期末
名校
7 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
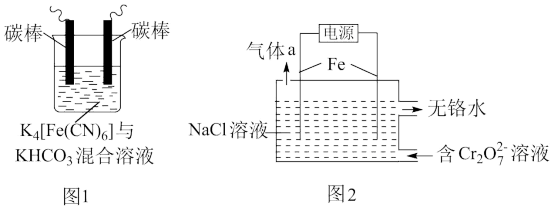
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
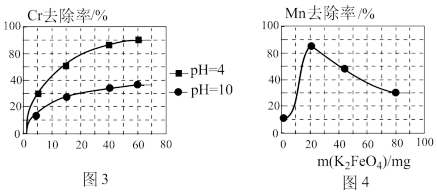
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
449次组卷
|
5卷引用:湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题
湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题(已下线)【苏州新东方】化学试卷
8 . 下列实验操作、现象与结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN⇌Fe(SCN)3+3KCl平衡向逆反应方向移动 |
| B | 浓度均为0.10mol/L的Na2CO3和Na2S的混合溶液中滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)>Ksp(Ag2CO3) |
| C | 向两支盛有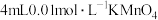 溶液的试管中分别加入 溶液的试管中分别加入 和 和 溶液 溶液 | 前者比后者褪色快 | 其他条件不变,反应物浓度增加,反应速率增大 |
| D | 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 都变红,但前者红色更深 | 结合质子的能力: > > |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . (1)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ的热量。写出该反应的热化学方程式_______ 。
(2)若25℃,101 kPa下,1 g CH4完全燃烧生成液态水和CO2气体,放出55.6 kJ的热量,则甲烷的燃烧热为_______ 。
(3)对于下列反应:2SO2(g)+ O2(g)⇌2SO3(g),如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为_______ 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ 。
(4)下图表示在密闭容器中反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是____ ;bc过程中改变的条件可能是_____ 。
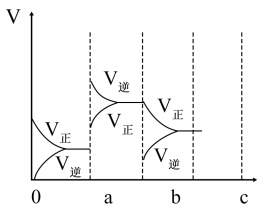
(2)若25℃,101 kPa下,1 g CH4完全燃烧生成液态水和CO2气体,放出55.6 kJ的热量,则甲烷的燃烧热为
(3)对于下列反应:2SO2(g)+ O2(g)⇌2SO3(g),如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
(4)下图表示在密闭容器中反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是

您最近一年使用:0次
10 . 已知:(SCN)2性质与卤素单质类似,其氧化性介于Br2和I2之间。将等体积等浓度的稀FeCl3溶液和稀KSCN溶液混合,发生反应:Fe3+ +3SCN-  Fe( SCN)3 ,得到浅红色的溶液。下列有关说法错误的是
Fe( SCN)3 ,得到浅红色的溶液。下列有关说法错误的是
 Fe( SCN)3 ,得到浅红色的溶液。下列有关说法错误的是
Fe( SCN)3 ,得到浅红色的溶液。下列有关说法错误的是| A.元素电负性大小顺序:N>S>C |
| B.通入适量Cl2 ,平衡向逆反应方向移动 |
| C.滴加浓KSCN溶液,平衡向正反应方向移动 |
| D.滴加NaOH稀溶液,溶液颜色加深 |
您最近一年使用:0次



