名校
解题方法
1 .  为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备
为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备 的流程如下:
的流程如下:
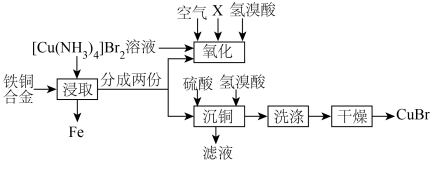
已知:“氧化”阶段存在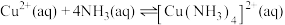 平衡。
平衡。
请回答下列问题:
(1) 在元素周期表中的位置为第
在元素周期表中的位置为第_______ 周期第_______ 族。
(2)“浸取”阶段的产物为 。
。
① 中含有
中含有_______  键。
键。
②其他条件不变, 浸出率与温度关系如图所示。
浸出率与温度关系如图所示。

请解释 以前随温度升高,
以前随温度升高, 浸出率增大的原因:
浸出率增大的原因:_______ 。
③该阶段被氧化的铜元素与被还原的铜元素质量之比为_______ 。
(3)“氧化”阶段试剂X选用_______ (填“液氨”“浓氨水”或“稀氨水”)更好,试从平衡移动角度解释其原因:_______ 。
(4)补全“沉铜”阶段的离子方程式:_______  。
。
(5)洗涤时宜选用_______ (填“冷水”或“乙醇”)。
 为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备
为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备 的流程如下:
的流程如下:
已知:“氧化”阶段存在
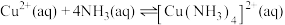 平衡。
平衡。请回答下列问题:
(1)
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)“浸取”阶段的产物为
 。
。①
 中含有
中含有 键。
键。②其他条件不变,
 浸出率与温度关系如图所示。
浸出率与温度关系如图所示。
请解释
 以前随温度升高,
以前随温度升高, 浸出率增大的原因:
浸出率增大的原因:③该阶段被氧化的铜元素与被还原的铜元素质量之比为
(3)“氧化”阶段试剂X选用
(4)补全“沉铜”阶段的离子方程式:
 。
。(5)洗涤时宜选用
您最近一年使用:0次
名校
解题方法
2 . 某实验小组同学用KSCN探究久置FeSO4固体变质的情况。将0.3gFeSO4固体用10mL蒸馏水溶解,配成待测液,进行实验。
【初步实验】
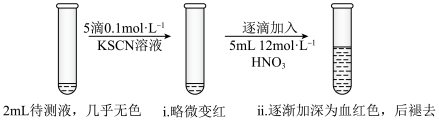
(1)用KSCN检验Fe3+的原理是___________ (用离子方程式表示)。
(2)甲同学认为FeSO4固体几乎未变质,ⅱ中变血红色是由于Fe2+被___________ (填化学式)氧化。结合平衡移动原理解释ⅱ中血红色褪去的可能原因___________ 。
(3)乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与其它因素有关,可能的影响因素是___________ 。
为验证该猜测,乙同学继续进行了以下实验。【继续探究】
(4)请补全步骤Ⅱ中的操作:___________ 。
(5)由Ⅰ~Ⅲ推测FeSO4固体变质的情况是___________ (填字母序号)。
a.几乎未变质 b.部分变质 c.完全变质
【反思与迁移】
(6)从上述探究中获得启发,在用KSCN检验Fe3+及进行Fe2+还原性验证实验时,需要注意的事项有___________ (至少2条)。
【初步实验】

(1)用KSCN检验Fe3+的原理是
(2)甲同学认为FeSO4固体几乎未变质,ⅱ中变血红色是由于Fe2+被
(3)乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与其它因素有关,可能的影响因素是
为验证该猜测,乙同学继续进行了以下实验。【继续探究】
| 步骤 | 操作 | 现象 |
| Ⅰ | 取2mL待测液,加入5滴0.1mol·L-1KSCN溶液,再加入5mL浓KNO3溶液 | 溶液无明显变化 |
| Ⅱ | 取2mL待测液,加入5滴0.1mol·L-1KSCN溶液,___________ | 溶液变为红色 |
| Ⅲ | 向Ⅱ中所得溶液中逐滴加入浓硝酸,边加边振荡 | 溶液逐渐加深为血红色,继续滴加浓硝酸,溶液褪色,pH变化始终不明显 |
(4)请补全步骤Ⅱ中的操作:
(5)由Ⅰ~Ⅲ推测FeSO4固体变质的情况是
a.几乎未变质 b.部分变质 c.完全变质
【反思与迁移】
(6)从上述探究中获得启发,在用KSCN检验Fe3+及进行Fe2+还原性验证实验时,需要注意的事项有
您最近一年使用:0次
3 . 工业上通过将 与氢气反应,实现碳中和。
与氢气反应,实现碳中和。
(1)已知反应 。根据理论计算,在恒压、起始物质的量之比
。根据理论计算,在恒压、起始物质的量之比 条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
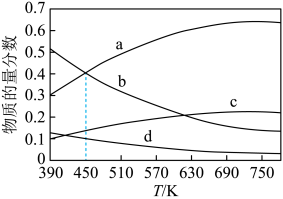
①该反应的平衡常数表达式为___________ ,该反应的
___________ 0(填“>”或“<”)。
②图中曲线b、c分别表示的是平衡时___________ 和___________ 的物质的量分数变化。
(2)用 和
和 合成
合成 的反应为
的反应为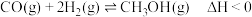 ,按照相同的物质的量投料,测得
,按照相同的物质的量投料,测得 在不同温度下的平衡转化率与压强的关系如图所示。
在不同温度下的平衡转化率与压强的关系如图所示。

①图中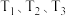 的大小关系为
的大小关系为___________ 。
②图中b、c、d点上正反应速率的关系为___________ 。
②图中a、b、d点上平衡常数的大小关系为___________ 。
(3)合成二甲醚:
反应Ⅰ:
反应Ⅱ: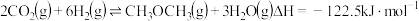
在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。其中:
的选择性随温度的变化如图所示。其中: 的选择性
的选择性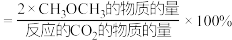 。
。

①温度高于 ,
, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是___________ 。
② 时,起始投入
时,起始投入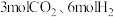 ,在催化剂作用下
,在催化剂作用下 与H2反应一段时间后,测得
与H2反应一段时间后,测得 平衡转化率为40%,
平衡转化率为40%, 的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗
的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗 的物质的量为
的物质的量为___________  。不改变反应时间和温度,一定能提高
。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有___________ 。
③合成二甲醚时较适宜的温度为 ,其原因是
,其原因是___________ 。
 与氢气反应,实现碳中和。
与氢气反应,实现碳中和。(1)已知反应
 。根据理论计算,在恒压、起始物质的量之比
。根据理论计算,在恒压、起始物质的量之比 条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
①该反应的平衡常数表达式为

②图中曲线b、c分别表示的是平衡时
(2)用
 和
和 合成
合成 的反应为
的反应为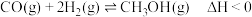 ,按照相同的物质的量投料,测得
,按照相同的物质的量投料,测得 在不同温度下的平衡转化率与压强的关系如图所示。
在不同温度下的平衡转化率与压强的关系如图所示。
①图中
 的大小关系为
的大小关系为②图中b、c、d点上正反应速率的关系为
②图中a、b、d点上平衡常数的大小关系为
(3)合成二甲醚:
反应Ⅰ:

反应Ⅱ:
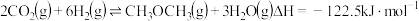
在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。其中:
的选择性随温度的变化如图所示。其中: 的选择性
的选择性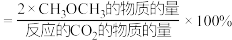 。
。
①温度高于
 ,
, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是②
 时,起始投入
时,起始投入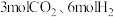 ,在催化剂作用下
,在催化剂作用下 与H2反应一段时间后,测得
与H2反应一段时间后,测得 平衡转化率为40%,
平衡转化率为40%, 的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗
的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗 的物质的量为
的物质的量为 。不改变反应时间和温度,一定能提高
。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有③合成二甲醚时较适宜的温度为
 ,其原因是
,其原因是
您最近一年使用:0次
4 . 探究外界因素对化学平衡的影响
Ⅰ. 利用“[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
[CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
实验过程:常温下,将CuCl2溶于水中得到CuCl2浓溶液,获得黄绿色溶液。并平均分为5份置于5个试管中并标记为a、b、c、d、e号试管
(1)b号试管的实验现象为________ ,c号试管相对于a号试管来说,c的溶液由黄绿色变为________ (填“蓝”或“黄”)色。对比a、b、c三支试管颜色变化,得到的结论是________________ 。
(2)对比a、d、e三支试管颜色变化,得到的结论是________ 。
Ⅱ.利用2N2O5(g) 4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
在初始体积为V 的、无色透明的、带有活塞的石英玻璃容器中充入一定量N2O5,将温度升到一定温度并保持不变使其充分反应,如下图所示。
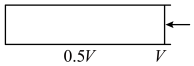
(3)待反应充分反应后,将容器的容积压缩为0.5V,可以观察到“混合气体颜色先快速变深,然后缓慢变浅”,说明该反应的平衡________ (填“正向”、“逆向”或“不”)移动;再将容积扩大到V,可以观察到“混合气体颜色先快速变浅,然后缓慢加深”,说明该反应的平衡________ (填“正向”、“逆向”或“不”)移动;
(4)通过上述实验,压强对化学平衡的影响是:________ 。
Ⅰ. 利用“[Cu(H2O)4]2+(蓝色)+4Cl-
 [CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
[CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。实验过程:常温下,将CuCl2溶于水中得到CuCl2浓溶液,获得黄绿色溶液。并平均分为5份置于5个试管中并标记为a、b、c、d、e号试管
| 试管编号 | 处理方式 |
| a | 加入1ml 的水 |
| b | 加入1mL 0.1mol·L-1 AgNO3溶液(足量)充分反应 |
| c | 加入1ml 0.1mol·L-1 NaCl溶液(足量)充分反应 |
| d | 加入1mL 的水 并置于50℃的热水浴中充分反应 |
| e | 加入1mL 的水 并置于冰水浴中充分反应 |
(1)b号试管的实验现象为
(2)对比a、d、e三支试管颜色变化,得到的结论是
Ⅱ.利用2N2O5(g)
 4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)在初始体积为V 的、无色透明的、带有活塞的石英玻璃容器中充入一定量N2O5,将温度升到一定温度并保持不变使其充分反应,如下图所示。

(3)待反应充分反应后,将容器的容积压缩为0.5V,可以观察到“混合气体颜色先快速变深,然后缓慢变浅”,说明该反应的平衡
(4)通过上述实验,压强对化学平衡的影响是:
您最近一年使用:0次
解题方法
5 . 已知 溶液中存在平衡:
溶液中存在平衡:
 。
。 溶液为橙色,
溶液为橙色, 溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
Ⅰ.方案讨论
(1)ⅰ~ⅳ中依据减少生成物浓度可导致平衡移动的原理设计的是___________ (填序号)。
(2)已知 为黄色沉淀。某同学认为试剂X还可设计为
为黄色沉淀。某同学认为试剂X还可设计为 溶液,加入该试剂后,平衡向着
溶液,加入该试剂后,平衡向着___________ (填“正反应”或“逆反应”)方向移动,溶液颜色将___________ (填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
(3)实验ⅰ没有观察到预期现象的原因是___________ ,实验ⅱ的原因与其相似。
(4)通过实验ⅲ和ⅳ得出的结论为___________ 。
(5)某同学认为将ⅲ中浓盐酸替换为浓硫酸也可得出相应的实验结论。用浓硫酸替换浓盐酸___________ (填“能”或“不能”)达到预期目的,理由是___________ 。
(6)某同学查阅资料发现: 溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
①方案一:取5mL浓盐酸,向其中加入15滴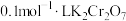 溶液,一段时间后,溶液变为绿色(
溶液,一段时间后,溶液变为绿色( 水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式
水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式___________ 。
②请你设计方案二:___________ 。
 溶液中存在平衡:
溶液中存在平衡:
 。
。 溶液为橙色,
溶液为橙色, 溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。 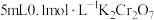 溶液 溶液 | 序号 | 试剂X |
| ⅰ | 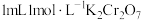 溶液 溶液 | |
| ⅱ | 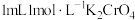 溶液 溶液 | |
| ⅲ | 5~15滴浓盐酸 | |
| ⅳ | 5~15滴 溶液 溶液 |
(1)ⅰ~ⅳ中依据减少生成物浓度可导致平衡移动的原理设计的是
(2)已知
 为黄色沉淀。某同学认为试剂X还可设计为
为黄色沉淀。某同学认为试剂X还可设计为 溶液,加入该试剂后,平衡向着
溶液,加入该试剂后,平衡向着Ⅱ.实验分析
| 序号 | 试剂X | 预期现象 | 实际现象 |
| ⅰ | 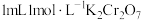 溶液 溶液 | 溶液变黄 | 溶液橙色加深 |
| ⅱ | 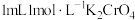 溶液 溶液 | 溶液橙色加深 | 溶液颜色变浅 |
| ⅲ | 5~15滴浓盐酸 | 溶液橙色加深 | 溶液橙色加深 |
| ⅳ | 5~15滴 溶液 溶液 | 溶液变黄 | 溶液变黄 |
(3)实验ⅰ没有观察到预期现象的原因是
(4)通过实验ⅲ和ⅳ得出的结论为
(5)某同学认为将ⅲ中浓盐酸替换为浓硫酸也可得出相应的实验结论。用浓硫酸替换浓盐酸
(6)某同学查阅资料发现:
 溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。①方案一:取5mL浓盐酸,向其中加入15滴
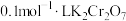 溶液,一段时间后,溶液变为绿色(
溶液,一段时间后,溶液变为绿色( 水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式
水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式②请你设计方案二:
您最近一年使用:0次
解题方法
6 . 某学习小组欲利用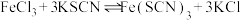 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变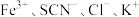 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是___________ (填A或B)。原因是:___________ 。
(2)取 溶液X,加入5滴
溶液X,加入5滴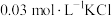 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:①___________ 对平衡产生了影响;②不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.为了探究KCl对 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
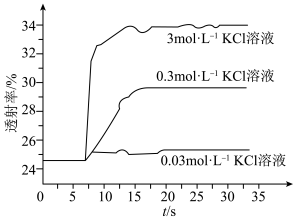
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响___________ 移动(填“正向、逆向或不”)。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:___________ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:
a.溶液中的 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②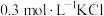 溶液、③
溶液、③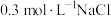 溶液、④
溶液、④ 溶液、⑤
溶液、⑤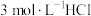 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
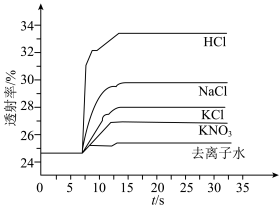
上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是___________ 。盐效应影响较大的阳离子是___________ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)已知 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:___________ 。
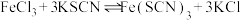 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
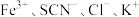 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取
 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是(2)取
 溶液X,加入5滴
溶液X,加入5滴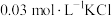 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:① 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.为了探究KCl对
 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。 猜想②:
 产生的影响。
产生的影响。 猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:a.溶液中的
 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取
 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②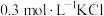 溶液、③
溶液、③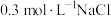 溶液、④
溶液、④ 溶液、⑤
溶液、⑤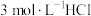 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)已知
 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:
您最近一年使用:0次
7 . 某小组以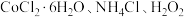 、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。如图为氨的测定装置(已省略加热和夹持装置)
、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。如图为氨的测定装置(已省略加热和夹持装置)
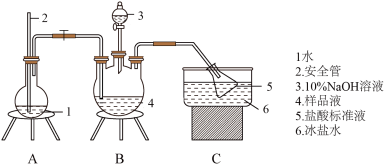
①氨的测定:准确称取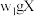 ,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量
,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量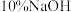 溶液,通入水蒸气,将样品液中的氨全部蒸出,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,用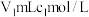 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,滴加指示剂,用
的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,滴加指示剂,用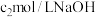 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗 溶液。
溶液。
②氯的测定:准确称取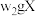 ,配成溶液后移取
,配成溶液后移取 于锥形瓶中,调
于锥形瓶中,调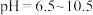 ,滴加指示剂
,滴加指示剂 溶液。在不断摇动下,用
溶液。在不断摇动下,用 标准溶液滴定至终点。(
标准溶液滴定至终点。( 为砖红色)
为砖红色)
回答下列问题:
(1)下列说法不正确 的是___________。
(2)滴定前,有关滴定管的正确操作为___________ (选出正确操作并按序排列)。
检漏→蒸馏水洗涤 开始滴定。
开始滴定。
A.烘干
B.装入滴定液至“0”刻度以上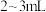 处
处
C.调整滴定液液面至“0”刻度或“0”刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(3)氯的测定过程中,滴定终点的现象是___________ 。当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中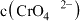 为
为___________  (保留两位有效数字)。已知
(保留两位有效数字)。已知 时,
时, 。
。
(4)测定 过程中,溶液
过程中,溶液 过低会使
过低会使 浓度降低,不能形成沉淀来指示终点。用相关的离子方程式解释
浓度降低,不能形成沉淀来指示终点。用相关的离子方程式解释 过低使
过低使 浓度降低的原因
浓度降低的原因___________ 。
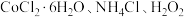 、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。如图为氨的测定装置(已省略加热和夹持装置)
、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。如图为氨的测定装置(已省略加热和夹持装置)
①氨的测定:准确称取
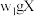 ,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量
,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量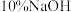 溶液,通入水蒸气,将样品液中的氨全部蒸出,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,用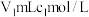 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,滴加指示剂,用
的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,滴加指示剂,用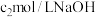 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗 溶液。
溶液。②氯的测定:准确称取
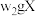 ,配成溶液后移取
,配成溶液后移取 于锥形瓶中,调
于锥形瓶中,调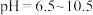 ,滴加指示剂
,滴加指示剂 溶液。在不断摇动下,用
溶液。在不断摇动下,用 标准溶液滴定至终点。(
标准溶液滴定至终点。( 为砖红色)
为砖红色)回答下列问题:
(1)下列说法
| A.安全管的作用是:当A中压力过大时,安全管中液面上升,使A瓶中压力稳定 |
| B.氨的测定过程中,滴定终点时仰视读数,氨的测定含量将偏高 |
| C.氨的测定接近终点时的“半滴操作”是:轻轻挤压玻璃珠下方的橡皮管,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁 |
| D.氯的测定过程中,使用棕色滴定管的原因是防止硝酸银见光分解 |
(2)滴定前,有关滴定管的正确操作为
检漏→蒸馏水洗涤
 开始滴定。
开始滴定。A.烘干
B.装入滴定液至“0”刻度以上
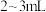 处
处C.调整滴定液液面至“0”刻度或“0”刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(3)氯的测定过程中,滴定终点的现象是
 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中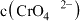 为
为 (保留两位有效数字)。已知
(保留两位有效数字)。已知 时,
时, 。
。(4)测定
 过程中,溶液
过程中,溶液 过低会使
过低会使 浓度降低,不能形成沉淀来指示终点。用相关的离子方程式解释
浓度降低,不能形成沉淀来指示终点。用相关的离子方程式解释 过低使
过低使 浓度降低的原因
浓度降低的原因
您最近一年使用:0次
解题方法
8 . 在一定体积的密闭容器中,进行化学反应 ,其化学平衡常数K和温度T的关系如表:
,其化学平衡常数K和温度T的关系如表:
(1)该反应的化学平衡常数表达式
______ 。
(2)该反应为______ (填“吸热”或“放热”)反应,判断依据为______ 。
(3)某温度下,各物质的平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为______ 。
(4)若1200℃时,在某时刻平衡体系中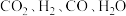 的浓度分别为
的浓度分别为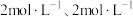 、
、 、
、 ,则此时上述反应的平衡移动方向为
,则此时上述反应的平衡移动方向为______ (填“正反应方向”“逆反应方向”或“不移动”),判断依据为______
 ,其化学平衡常数K和温度T的关系如表:
,其化学平衡常数K和温度T的关系如表:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

(2)该反应为
(3)某温度下,各物质的平衡浓度符合下式:
 ,试判断此时的温度为
,试判断此时的温度为(4)若1200℃时,在某时刻平衡体系中
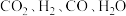 的浓度分别为
的浓度分别为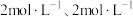 、
、 、
、 ,则此时上述反应的平衡移动方向为
,则此时上述反应的平衡移动方向为
您最近一年使用:0次
名校
解题方法
9 . 近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题。
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题。
(1)已知:

写出 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:________________________________ ;形成甲醇中的 键需要
键需要________ (填“吸收”或“释放”)能量。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是________ (填字母)。
a.高温、高压 b.低温、低压 c.高温、低压 d.低温、高压
(3)在 时,在某恒容密闭容器中进行由
时,在某恒容密闭容器中进行由 催化氢化合成
催化氢化合成 的反应。如图为不同投料比
的反应。如图为不同投料比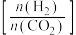 时某反应物
时某反应物 的平衡转化率的变化曲线,则反应物
的平衡转化率的变化曲线,则反应物 是
是________ (填“ ”或“
”或“ ”)。
”)。

(4)在 时,在
时,在 的恒容密闭容器中加入
的恒容密闭容器中加入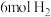 、
、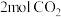 及催化剂,
及催化剂, 时反应达到平衡,测得
时反应达到平衡,测得 。
。
①前 内
内 的平均反应速率
的平均反应速率
________  。
。
②化学平衡常数
________________________ 。
③下列描述中能说明上述反应已达平衡的是________ (填字母)。
a.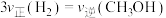
b.单位时间内生成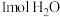 的同时生成
的同时生成
c.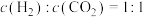
d.容器中气体的平均相对分子质量不随时间而变化
④催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下表四组实验数据。
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为________ (填实验编号)。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题。
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题。(1)已知:


写出
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式: 键需要
键需要(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温、高压 b.低温、低压 c.高温、低压 d.低温、高压
(3)在
 时,在某恒容密闭容器中进行由
时,在某恒容密闭容器中进行由 催化氢化合成
催化氢化合成 的反应。如图为不同投料比
的反应。如图为不同投料比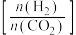 时某反应物
时某反应物 的平衡转化率的变化曲线,则反应物
的平衡转化率的变化曲线,则反应物 是
是 ”或“
”或“ ”)。
”)。
(4)在
 时,在
时,在 的恒容密闭容器中加入
的恒容密闭容器中加入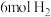 、
、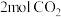 及催化剂,
及催化剂, 时反应达到平衡,测得
时反应达到平衡,测得 。
。①前
 内
内 的平均反应速率
的平均反应速率
 。
。②化学平衡常数

③下列描述中能说明上述反应已达平衡的是
a.
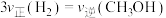
b.单位时间内生成
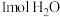 的同时生成
的同时生成
c.
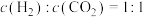
d.容器中气体的平均相对分子质量不随时间而变化
④催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下表四组实验数据。
实验编号 | 温度 | 催化剂 |
| 甲醇的选择性 |
| 543 |
| 12.3 | 42.3 |
| 543 |
| 11.9 | 72.7 |
| 553 |
| 15.3 | 39.1 |
| 553 |
| 12.0 | 70.6 |
 生产甲醇的最优条件为
生产甲醇的最优条件为
您最近一年使用:0次
2024-02-23更新
|
43次组卷
|
2卷引用:河北省百师联盟2023-2024学年高二上学期1月期末大联考化学试题
解题方法
10 . 电解二氧化锰具有高能量密度、长寿命、低自放电率等优点,被广泛应用于移动电源、电动汽车、无人机等领域。工业上利用碳酸锰矿(含碳酸亚铁及其它重金属化合物)通过一系列过程制备电解二氧化锰的原理如下:
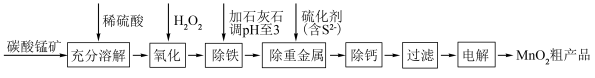
已知:在生产时对应温度下,有关物质的溶度积常数如下:
回答下列问题:
(1)为了加快碳酸锰矿的溶解,可采取的措施有___________ (答出一种即可)。
(2)氧化过程的目的是___________ 。
(3)从平衡移动的角度分析石灰石除铁的原理是___________ (结合方程式回答)。
(4)电解是在酸性环境下进行,生成二氧化锰的电极反应式为___________ 。
(5)电解时 的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中
的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中 的浓度,其原理为:
的浓度,其原理为: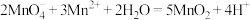
某同学进行了如下操作:取过滤后的溶液 ,稀释至
,稀释至 ,取
,取 稀释后的溶液于锥形瓶中,用浓度为
稀释后的溶液于锥形瓶中,用浓度为 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为
溶液体积平均值为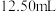 。
。
①滴定终点时的现象是___________
②经计算,此次实验测得的原过滤后溶液中 的浓度为
的浓度为___________ ;
③滴定终点后读数时发现滴定管尖嘴处有一个气泡,若其它环节无误,则此次实验测得的 浓度
浓度___________ (填“偏大”“偏小”或“不受影响”)。

已知:在生产时对应温度下,有关物质的溶度积常数如下:
| 物质 |  |  |
 |  | 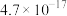 |
(1)为了加快碳酸锰矿的溶解,可采取的措施有
(2)氧化过程的目的是
(3)从平衡移动的角度分析石灰石除铁的原理是
(4)电解是在酸性环境下进行,生成二氧化锰的电极反应式为
(5)电解时
 的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中
的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中 的浓度,其原理为:
的浓度,其原理为: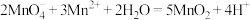
某同学进行了如下操作:取过滤后的溶液
 ,稀释至
,稀释至 ,取
,取 稀释后的溶液于锥形瓶中,用浓度为
稀释后的溶液于锥形瓶中,用浓度为 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为
溶液体积平均值为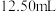 。
。①滴定终点时的现象是
②经计算,此次实验测得的原过滤后溶液中
 的浓度为
的浓度为③滴定终点后读数时发现滴定管尖嘴处有一个气泡,若其它环节无误,则此次实验测得的
 浓度
浓度
您最近一年使用:0次



 纳米棒
纳米棒




