解题方法
1 . 一个化学反应在给定条件(通常指温度、压强)下能否自发进行以及在什么条件下有可能按预期的方向发生,需寻求一种客观的判据,用它来判断一个化学反应能否正向自发进行。研究表明,可逆反应在适当条件下进行一段时间后一定会达到化学平衡状态。在研究了大量实验的基础上,人们发现可以用化学平衡常数来定量描述化学反应的限度。
(1)下列关于自发反应的叙述,正确的是___________。
(2)下列说法中正确的是___________。
(3)某温度下,可逆反应 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。
(4)在一定温度下,下列反应的化学平衡常数数值如下:
①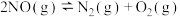
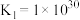
②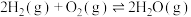
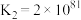
③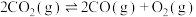
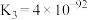
下列说法正确的是___________。
(5)在某密闭容器中把CO和 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。
(6)地下水中的氮污染主要是由 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: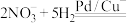

①氮肥 溶于水的过程中熵值
溶于水的过程中熵值___________ (填“增大”或“减小”),Pd/Cu双金属催化剂___________ (填“是”或“不是”)决定反应自发发生的决定因素。
②已知: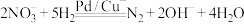 的
的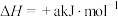 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应___________ (填“能”“不能”或“无法判断是否能”)自发进行。
(7)在一定体积的密闭容器中进行如下化学反应:
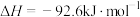 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:
①试判断
___________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
②T℃( )的某时刻下,
)的某时刻下, ,
,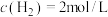 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态___________ (选填“是”或“否”),此时反应速率是
___________  (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是___________ 。
(1)下列关于自发反应的叙述,正确的是___________。
| A.自发反应的逆过程在相同条件下也必定是自发的 |
| B.铁在潮湿的空气中生锈属于非自发反应 |
| C.自发过程可以是物理过程,不一定是自发反应,而自发反应一定是自发过程 |
| D.自发反应与外界条件无关 |
A.若 , , ,化学反应在任何温度下都能自发进行 ,化学反应在任何温度下都能自发进行 |
B.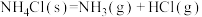 在室温下不能自发进行,则该反应的 在室温下不能自发进行,则该反应的 |
C. 在低温下能自发进行,则该反应的 在低温下能自发进行,则该反应的 |
| D.加入合适的催化剂能降低反应的活化能,从而改变反应的焓变 |
 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。| A.温度越高,K一定越大 |
B.如果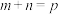 ,则 ,则 |
| C.若缩小反应器的容积,增大压强,则K增大 |
| D.K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
①
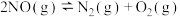
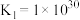
②
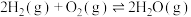
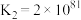
③
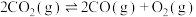
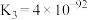
下列说法正确的是___________。
A.该温度下,反应①的平衡常数表达式为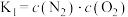 |
B.该温度下,反应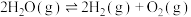 的平衡常数的数值约为 的平衡常数的数值约为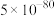 |
C.该温度下,反应①、反应②的逆反应、反应③产生 的倾向由大到小的顺序为 的倾向由大到小的顺序为 |
| D.以上说法都不正确 |
 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。| A.40% | B.50% | C.60% | D.83.3% |
 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: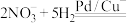

①氮肥
 溶于水的过程中熵值
溶于水的过程中熵值②已知:
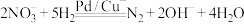 的
的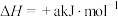 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应(7)在一定体积的密闭容器中进行如下化学反应:

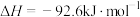 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:| T℃ | 25 | 125 | 225 |
| K | 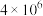 |  |  |

 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)②T℃(
 )的某时刻下,
)的某时刻下, ,
,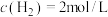 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态
 (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是
您最近一年使用:0次
2 . 究二氧化碳的回收对我国2060年实现碳中和具有现实意义:
(1)已知:①CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ•mol-1
CO2(g)+H2(g) △H=-41kJ•mol-1
②C(s)+2H2(g) CH4(g) △H=-73kJ•mol-1
CH4(g) △H=-73kJ•mol-1
③2CO(g) CO2(g)+C(s) △H=-171kJ•mol-1
CO2(g)+C(s) △H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:______ 。
(2)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) △H。
C2H5OH(g)+3H2O(g) △H。
①通过表格中的数值可以推断:其正反应在_____ (填“高温”、“低温”或“任何温度”)下能自发进行。
②CO2的平衡转化率与压强、温度及氢碳比m[m= ]的关系分别如图a和图b所示。
]的关系分别如图a和图b所示。
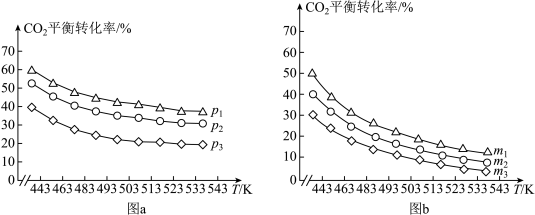
图a中压强从大到小的顺序为_____ ,图b中氢碳比m从大到小的顺序为_____ 。
(3)工业上也可以利用CO2和H2合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)某1L恒温恒容密闭容器中充入1molCO2和3molH2发生反应,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
CH3OH(g)+H2O(g)某1L恒温恒容密闭容器中充入1molCO2和3molH2发生反应,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
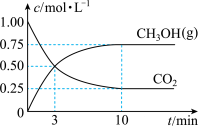
①0~3min内,H2的平均反应速率为_____ mol•L-1•min-1,该温度下的平衡常数为K=_____ (单位可忽略)。若达平衡时,保持温度不变,向容器中再充入CO2、H2、CH3OH和H2O各0.25mol,则此时v正_____ v逆(填“>”、“<”、或“=”)。
②下列说法能说明反应达到化学平衡状态的是_____ 。
A.H2的消耗速率与CH3OH的消耗速率之比为3∶1 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.c(CO2)和c(H2O)的浓度相等时
(4)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) △H1=-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为______ kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+ O2(g)=CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有
O2(g)=CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有______ 。
(1)已知:①CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41kJ•mol-1
CO2(g)+H2(g) △H=-41kJ•mol-1②C(s)+2H2(g)
 CH4(g) △H=-73kJ•mol-1
CH4(g) △H=-73kJ•mol-1③2CO(g)
 CO2(g)+C(s) △H=-171kJ•mol-1
CO2(g)+C(s) △H=-171kJ•mol-1写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(2)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g) △H。
C2H5OH(g)+3H2O(g) △H。| 温度/ | 400 | 500 |
| 平衡常数K | 9 | 5.3 |
②CO2的平衡转化率与压强、温度及氢碳比m[m=
 ]的关系分别如图a和图b所示。
]的关系分别如图a和图b所示。
图a中压强从大到小的顺序为
(3)工业上也可以利用CO2和H2合成甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)某1L恒温恒容密闭容器中充入1molCO2和3molH2发生反应,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
CH3OH(g)+H2O(g)某1L恒温恒容密闭容器中充入1molCO2和3molH2发生反应,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
①0~3min内,H2的平均反应速率为
②下列说法能说明反应达到化学平衡状态的是
A.H2的消耗速率与CH3OH的消耗速率之比为3∶1 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.c(CO2)和c(H2O)的浓度相等时
(4)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) △H1=-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+
 O2(g)=CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有
O2(g)=CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题。
I.已知2C3H6(g)+2NH3(g)+3O2(g) 2C3H3N(g)+6H2O(g)
2C3H3N(g)+6H2O(g)  =-1030kJ/mol。
=-1030kJ/mol。
(1)上述为丙烯(C3H6)合成丙烯腈(C3H3N)的反应,则该反应___________。
(2)该反应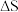
___________ 0(填>、<或=)。
(3)恒容时该反应生成丙烯腈的速率与时间的关系如图。
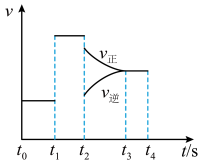
t1改变的条件为___________ ,t2改变的条件为___________ ;反应速率最大的时间段为___________ ,丙烯(C3H6)转化率最大的时间段为___________ 。
II.向1L密闭容器投入2molC3H6、2molNH3和3molO2反应5min,α(丙烯)与T的关系如图。
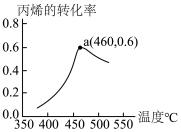
(4)460℃时平衡常数=___________ ,用O2表示反应速率v(O2)=___________ 。
(5)当温度低于460℃时,丙烯的转化率___________ (“是”或“不是”)所对应温度下的平衡转化率,理由是___________ 。
I.已知2C3H6(g)+2NH3(g)+3O2(g)
 2C3H3N(g)+6H2O(g)
2C3H3N(g)+6H2O(g)  =-1030kJ/mol。
=-1030kJ/mol。(1)上述为丙烯(C3H6)合成丙烯腈(C3H3N)的反应,则该反应___________。
| A.较高温度下自发进行 | B.较低温度下自发进行 |
| C.任何温度下都可自发进行 | D.任何温度下都不能自发进行 |
(2)该反应
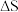
(3)恒容时该反应生成丙烯腈的速率与时间的关系如图。

t1改变的条件为
II.向1L密闭容器投入2molC3H6、2molNH3和3molO2反应5min,α(丙烯)与T的关系如图。

(4)460℃时平衡常数=
(5)当温度低于460℃时,丙烯的转化率
您最近一年使用:0次
4 . Ⅰ.双组元液体推进剂是一类重要的“火箭燃料”,其由燃烧剂和助燃剂组成;肼(N2H4)、偏二甲肼(C2H8N2)是常用的燃烧剂。长征二号是我国研制的第一代液体运载火箭,其推进剂配方为 和
和 。
。
(1) 和
和 点燃生成的三种产物均无毒无害,化学方程式为:
点燃生成的三种产物均无毒无害,化学方程式为:___________ 。
(2)含有 的燃料废水会造成污染,可采用氯化法处理;以下不适宜用作氯化试剂的是___________。
的燃料废水会造成污染,可采用氯化法处理;以下不适宜用作氯化试剂的是___________。
Ⅱ.在 恒容绝热容器中充入
恒容绝热容器中充入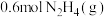 ,一定温度下发生反应:
,一定温度下发生反应:
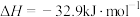 ,
, 的转化率随时间变化情况如图所示:
的转化率随时间变化情况如图所示:
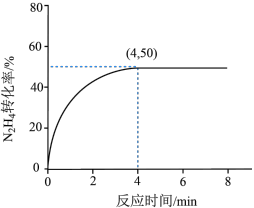
(3) 内,
内, 的反应速率为
的反应速率为___________ ,该温度下此反应的平衡常数为___________ (保留2位有效数字)。
(4)下列能够表明上述反应已达到平衡状态的有___________。
(5)写出一种提高 平衡转化率的方法:
平衡转化率的方法:___________ 。
Ⅲ肼不仅可以给火箭当粮食,还可以摇身一变成为氢气“储蓄罐”。是一种高选择性的肼分解制氢催化剂,催化反应机理如图所示,反应如下:

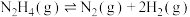
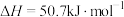
(6)根据上述信息,推测 ___________。
___________。
Ⅳ.肼类燃烧剂会造成污染,这种粮食正逐渐被淘汰。长征五号B是我国近地轨道运载能力最大的新一代运载火箭,其粮食采用全新配方——低温液氢液氧推进剂,让火箭飞得更稳健。已知一定条件下:
①
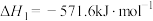
②
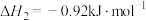
③
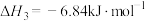
④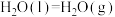
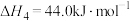
(7)请写出相同条件下液氢和液氧生成气态水的热化学方程式:___________ 。
(8)根据上述信息,以下说法正确的是___________。
 和
和 。
。(1)
 和
和 点燃生成的三种产物均无毒无害,化学方程式为:
点燃生成的三种产物均无毒无害,化学方程式为:(2)含有
 的燃料废水会造成污染,可采用氯化法处理;以下不适宜用作氯化试剂的是___________。
的燃料废水会造成污染,可采用氯化法处理;以下不适宜用作氯化试剂的是___________。A. | B. | C. | D. |
Ⅱ.在
 恒容绝热容器中充入
恒容绝热容器中充入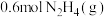 ,一定温度下发生反应:
,一定温度下发生反应:
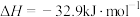 ,
, 的转化率随时间变化情况如图所示:
的转化率随时间变化情况如图所示:
(3)
 内,
内, 的反应速率为
的反应速率为(4)下列能够表明上述反应已达到平衡状态的有___________。
A.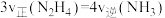 | B.气体密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 | D.平衡常数不再改变 |
(5)写出一种提高
 平衡转化率的方法:
平衡转化率的方法:Ⅲ肼不仅可以给火箭当粮食,还可以摇身一变成为氢气“储蓄罐”。是一种高选择性的肼分解制氢催化剂,催化反应机理如图所示,反应如下:

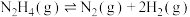
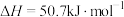
(6)根据上述信息,推测
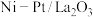 ___________。
___________。| A.能够有效降低制氢反应的反应热 | B.同时提高制氢正反应和逆反应的速率 |
| C.改变制氢反应的反应历程 | D.不参与化学反应,使用一段时间后无需补加 |
Ⅳ.肼类燃烧剂会造成污染,这种粮食正逐渐被淘汰。长征五号B是我国近地轨道运载能力最大的新一代运载火箭,其粮食采用全新配方——低温液氢液氧推进剂,让火箭飞得更稳健。已知一定条件下:
①

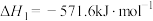
②

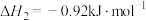
③

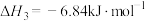
④
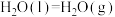
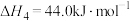
(7)请写出相同条件下液氢和液氧生成气态水的热化学方程式:
(8)根据上述信息,以下说法正确的是___________。
| A.变化④为熵增过程 |
| B.液氢液氧不点燃观察不到水生成,故该反应无法自发进行 |
C. 液态氢气的能量高于 液态氢气的能量高于 气态氢气的能量 气态氢气的能量 |
| D.液氢和液氧作为火箭推进剂符合绿色化学理念 |
您最近一年使用:0次
名校
解题方法
5 . 在密闭容器中充入一定量 ,发生反应:
,发生反应: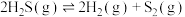
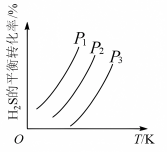
 ,如图为
,如图为 气体的平衡转化率与温度、压强的关系。
气体的平衡转化率与温度、压强的关系。
请完成下列填空:
(1)在一定条件下,往2L密闭容器中充入 进行反应,2min时达到平衡状态,此时
进行反应,2min时达到平衡状态,此时 剩余2mol,计算0~2min内
剩余2mol,计算0~2min内 的平均反应速率
的平均反应速率
__________  。图中压强
。图中压强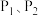 、
、 从大到小顺序为
从大到小顺序为____________________ ,原因是:________________________________________ 。又已知 可转化成羰基碱(COS):
可转化成羰基碱(COS):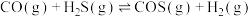

(2)上述反应的平衡常数表达式______________________________ 。
(3)在一恒容的密闭容器中,充入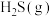 与
与 进行上述反应。下列事实能说明反应达到平衡状态的是
进行上述反应。下列事实能说明反应达到平衡状态的是__________ (选填编号)。
a.生成amolCOS,同时形成amolH-S键 b.消耗 的速率与生成COS速率之比为1:1
的速率与生成COS速率之比为1:1
c.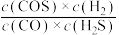 的值不再改变 d.混合气体的平均相对分子质量不再改变
的值不再改变 d.混合气体的平均相对分子质量不再改变
(4)若将标准状况下224mL的 气体通入200mL的
气体通入200mL的 溶液中正好完全反应,现象是
溶液中正好完全反应,现象是______________________________ ,写出反应的离子方程式:______________________________ ,若溶液体积没有发生改变,此时溶液的pH是__________ 。
 ,发生反应:
,发生反应: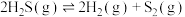
 ,如图为
,如图为 气体的平衡转化率与温度、压强的关系。
气体的平衡转化率与温度、压强的关系。
请完成下列填空:
(1)在一定条件下,往2L密闭容器中充入
 进行反应,2min时达到平衡状态,此时
进行反应,2min时达到平衡状态,此时 剩余2mol,计算0~2min内
剩余2mol,计算0~2min内 的平均反应速率
的平均反应速率
 。图中压强
。图中压强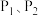 、
、 从大到小顺序为
从大到小顺序为 可转化成羰基碱(COS):
可转化成羰基碱(COS):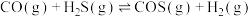

(2)上述反应的平衡常数表达式
(3)在一恒容的密闭容器中,充入
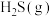 与
与 进行上述反应。下列事实能说明反应达到平衡状态的是
进行上述反应。下列事实能说明反应达到平衡状态的是a.生成amolCOS,同时形成amolH-S键 b.消耗
 的速率与生成COS速率之比为1:1
的速率与生成COS速率之比为1:1c.
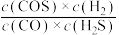 的值不再改变 d.混合气体的平均相对分子质量不再改变
的值不再改变 d.混合气体的平均相对分子质量不再改变(4)若将标准状况下224mL的
 气体通入200mL的
气体通入200mL的 溶液中正好完全反应,现象是
溶液中正好完全反应,现象是
您最近一年使用:0次
名校
6 .  通入
通入 溶液中,产生蓝色沉淀;若继续通入氨气至过量,沉淀消失得到深蓝色
溶液中,产生蓝色沉淀;若继续通入氨气至过量,沉淀消失得到深蓝色 溶液。发生如下反应:
溶液。发生如下反应:

(1)该反应平衡常数的表达式
___________ 。
(2) 时改变条件,一段时间后达到新平衡,此时反应K增大。在下图中画出该过程中
时改变条件,一段时间后达到新平衡,此时反应K增大。在下图中画出该过程中 的变化。
的变化。_________

(3)向上述铜氨溶液中加水稀释,出现蓝色沉淀,原因是:___________ 。
(4)在绝热密闭容器中,加入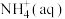 、
、 和
和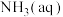 进行上述反应,
进行上述反应, 随时间的变化如下图所示,
随时间的变化如下图所示, 先增大后减小的原因:
先增大后减小的原因:___________ 。

 通入
通入 溶液中,产生蓝色沉淀;若继续通入氨气至过量,沉淀消失得到深蓝色
溶液中,产生蓝色沉淀;若继续通入氨气至过量,沉淀消失得到深蓝色 溶液。发生如下反应:
溶液。发生如下反应:

(1)该反应平衡常数的表达式

(2)
 时改变条件,一段时间后达到新平衡,此时反应K增大。在下图中画出该过程中
时改变条件,一段时间后达到新平衡,此时反应K增大。在下图中画出该过程中 的变化。
的变化。
(3)向上述铜氨溶液中加水稀释,出现蓝色沉淀,原因是:
(4)在绝热密闭容器中,加入
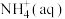 、
、 和
和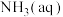 进行上述反应,
进行上述反应, 随时间的变化如下图所示,
随时间的变化如下图所示, 先增大后减小的原因:
先增大后减小的原因:
您最近一年使用:0次
名校
解题方法
7 . 氨的用途十分广泛,如氨是制造硝酸和氮肥的重要原科。工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。________  。
。
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是______ (填选项序号)。
①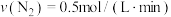 ②
②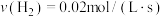
③ ④
④
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
(4)一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入 、
、 发生反应,
发生反应, 的浓度随时间变化情况如表所示:
的浓度随时间变化情况如表所示:
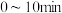 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为_______ ;平衡常数
______ (结果保留一位小数);若维持温度不变,向另一 恒容密闭容器中充入
恒容密闭容器中充入 、
、 和
和 各
各 时,该反应的
时,该反应的
_____ (填 “>”“<”或“=”) 。
。
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

 。
。(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是
①
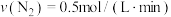 ②
②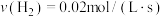
③
 ④
④
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
A. | B. |
C. | D. |
(4)一定温度下,向
 恒容密闭容器中充入
恒容密闭容器中充入 、
、 发生反应,
发生反应, 的浓度随时间变化情况如表所示:
的浓度随时间变化情况如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 |
浓度/ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 |
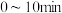 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为
 恒容密闭容器中充入
恒容密闭容器中充入 、
、 和
和 各
各 时,该反应的
时,该反应的
 。
。
您最近一年使用:0次
名校
解题方法
8 . 合成氨技术是现代农业的基础之一,通过应用合成氨制备的肥料,可以使植物更快生长并增加收成。全球一半以上的食品产量与合成氨肥料直接相关,为人类解决了世界粮食问题。
Ⅰ.工业合成氨的反应如下: 。某温度下,在容积为2L的密闭容器中充入
。某温度下,在容积为2L的密闭容器中充入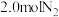 和
和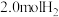 ,一段时间后反应达到平衡状态,实验数据如下:
,一段时间后反应达到平衡状态,实验数据如下:
(1)0~50s内的平均反应速率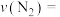
___________ 。
(2)合成氨反应的平衡常数表达式K=___________ ,计算该温度下的平衡常数K=___________ 。(结果保留两位小数)
(3)若在该温度下,将 、
、 和
和 置于2L密闭容器中,问此时该反应向
置于2L密闭容器中,问此时该反应向_______ 方向进行?(写出计算过程和结论)
(4)为加快反应速率和增大氨气产率,可以采取的措施___________。(选填编号)
(5)合成氨反应采用氢气、氮气循环操作的主要目的是___________(选填编号)
(6)下列生产流程:①原料气制备;②氨的合成;③原料气净化和压缩;④氨的分离。先后顺序___________(选填编号)
(7)工业合成氨反应所用催化剂为___________ ;氢气与氮气的比例为___________ ,氮气过量的原因是___________ 。
Ⅱ.工业合成氨的反应如下: 。某温度下,在容积为2L的密闭容器中充入
。某温度下,在容积为2L的密闭容器中充入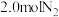 和
和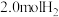 ,一段时间后反应达到平衡状态,实验数据如下:
,一段时间后反应达到平衡状态,实验数据如下:
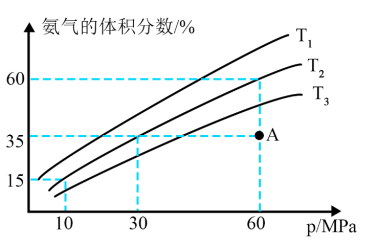
(8) 、
、 、
、 由小到大的顺序为
由小到大的顺序为___________ 。
(9)在 、60MPa条件下,平衡时
、60MPa条件下,平衡时 的转化率为
的转化率为___________ 。
(10) 温度下,A点的反应速率之间的关系:
温度下,A点的反应速率之间的关系:
___________  (填“>、=或<”)。
(填“>、=或<”)。
Ⅰ.工业合成氨的反应如下:
 。某温度下,在容积为2L的密闭容器中充入
。某温度下,在容积为2L的密闭容器中充入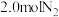 和
和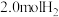 ,一段时间后反应达到平衡状态,实验数据如下:
,一段时间后反应达到平衡状态,实验数据如下:| t/s | 0 | 50 | 150 | 250 | 350 |
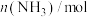 | 0 | 0.24 | 0.36 | 0.4 | 0.4 |
(1)0~50s内的平均反应速率
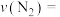
(2)合成氨反应的平衡常数表达式K=
(3)若在该温度下,将
 、
、 和
和 置于2L密闭容器中,问此时该反应向
置于2L密闭容器中,问此时该反应向(4)为加快反应速率和增大氨气产率,可以采取的措施___________。(选填编号)
| A.降低温度 | B.减小容器体积增大压强 |
| C.恒容时充入He气 | D.恒压时充入He气 |
(5)合成氨反应采用氢气、氮气循环操作的主要目的是___________(选填编号)
| A.加快反应速率 | B.提高氨气的平衡浓度 |
| C.降低氨气的沸点 | D.提高氮气和氢气利用率 |
(6)下列生产流程:①原料气制备;②氨的合成;③原料气净化和压缩;④氨的分离。先后顺序___________(选填编号)
| A.①②③④ | B.①③②④ | C.④③②① | D.②③④① |
(7)工业合成氨反应所用催化剂为
Ⅱ.工业合成氨的反应如下:
 。某温度下,在容积为2L的密闭容器中充入
。某温度下,在容积为2L的密闭容器中充入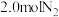 和
和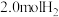 ,一段时间后反应达到平衡状态,实验数据如下:
,一段时间后反应达到平衡状态,实验数据如下:
(8)
 、
、 、
、 由小到大的顺序为
由小到大的顺序为(9)在
 、60MPa条件下,平衡时
、60MPa条件下,平衡时 的转化率为
的转化率为(10)
 温度下,A点的反应速率之间的关系:
温度下,A点的反应速率之间的关系:
 (填“>、=或<”)。
(填“>、=或<”)。
您最近一年使用:0次
名校
9 . 在某温度下,向恒温恒容密闭容器中充入等物质的量浓度的NO2和CO气体,在催化剂作用下发生反应4CO(g)+2NO2(g) N2(g)+4CO2(g) ΔH<0。相关数据如下:
N2(g)+4CO2(g) ΔH<0。相关数据如下:
(1)对于上述反应,下列说法不正确的是________。
(2)在15min时,CO的转化率为___________ 。此温度下,该反应的化学平衡常数K=_________________ (保留两位有效数字)。
(3)该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应化学平衡常数的是__________ (选“A”或“B”),理由是____________ 。

(4)在该温度下,向恒容容器甲中通入4molCO、2molNO2,向等大的恒容容器乙中通入2molN2和4molCO2,反应都达到平衡时_______。
 N2(g)+4CO2(g) ΔH<0。相关数据如下:
N2(g)+4CO2(g) ΔH<0。相关数据如下:| 0min | 5min | 10min | 15min | 20min | |
| c(NO2)/(mol·L-1) | 2.00 | 1.70 | 1.56 | 1.50 | 1.50 |
| c(N2)/(mol·L-1) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
| A.该反应在15min前未达到化学平衡状态 |
| B.平衡时向容器中充入CO,平衡正移,CO转化率下降 |
| C.平衡时CO与NO2的转化率不相等 |
| D.20min时混合气体平均摩尔质量大于10min时混合气体平均摩尔质量 |
(3)该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应化学平衡常数的是

(4)在该温度下,向恒容容器甲中通入4molCO、2molNO2,向等大的恒容容器乙中通入2molN2和4molCO2,反应都达到平衡时_______。
| A.两容器内c(N2)相等 | B.正反应速率:甲<乙 |
| C.乙中c(CO2)更大 | D.甲容器内的压强大于乙容器内的压强 |
您最近一年使用:0次
名校
解题方法
10 . 三元催化器是安装在汽车排气系统中最重要的机外净化装置。高温汽车尾气中的一氧化碳、碳氢化合物和氮氧化物在通过净化装置时活性增强,发生氧化还原反应变成无害气体而得以净化。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在T℃时,平衡常数K=9.0。
2NO(g) ΔH>0,已知该反应在T℃时,平衡常数K=9.0。
(1)将N2、O2混合充入恒温恒容密闭容器中,下列变化趋势不正确的是_______ 。
A. B.
B.  C.
C. 
(2)T℃时,某时刻测得容器内N2、O2、NO的浓度分别为0.20 mol/L、0.10mol/L 和0.50mol/L,此时反应v正(N2)_______ v逆(N2) (填“<”“>”或“=”)。
(3)向恒温恒容的密闭容器中充入N2和O2各1mol,达到平衡后再向其中充入N2和O2各1mol,重新达到平衡状态。与原平衡状态相比,N2的转化率_______ (填“变大”“变小”“不变”),化学平衡常数_______ (填“变大”“变小”“不变”)。
 2NO(g) ΔH>0,已知该反应在T℃时,平衡常数K=9.0。
2NO(g) ΔH>0,已知该反应在T℃时,平衡常数K=9.0。(1)将N2、O2混合充入恒温恒容密闭容器中,下列变化趋势不正确的是
A.
 B.
B.  C.
C. 
(2)T℃时,某时刻测得容器内N2、O2、NO的浓度分别为0.20 mol/L、0.10mol/L 和0.50mol/L,此时反应v正(N2)
(3)向恒温恒容的密闭容器中充入N2和O2各1mol,达到平衡后再向其中充入N2和O2各1mol,重新达到平衡状态。与原平衡状态相比,N2的转化率
您最近一年使用:0次



