名校
1 . Ⅰ. 甲醇是重要的化工原料,发展前景广阔。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g)⇌CO2(g) + H2(g)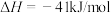 。相关数据如下:
。相关数据如下:
(1)甲容器中,反应在t1 min 内的平均速率v(H2)= ___________ mol/(L·min)。
(2)甲容器中,平衡时,反应放出的热量___________ kJ。
(3)T1时,反应的平衡常数K甲=___________ 。
(4)乙容器中,a=___________ mol。
II.已知:①N2(g)+O2(g) ⇌2NO(g) △H1=+180kJ mol-1
mol-1
②C(s)+O2(g)=CO2(g) △H2=-393kJ mol-1
mol-1
③2C(s)+O2(g)=2CO(g) △H3=-221kJ mol-1
mol-1
(5)若某反应的平衡常数表达式为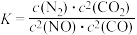 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___________ 。
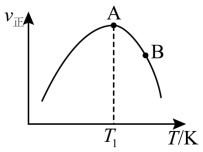
(6)欲研究在某催化剂作用下2CO(g)+2NO(g)⇌N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如下图所示,A、B两点对应温度下正反应速率变化的原因可能是___________ ,A、B两点对应温度下该反应的活化能Ea(A)___________ Ea(B)(填“>”或“<”)。 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数 =
=___________ 。
(8)用NH3可以消除NO污染:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(1),该反应速率v正=k正 c4(NH3)
c4(NH3) c6(NO),v逆=K逆
c6(NO),v逆=K逆 c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9
c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9 s-1,当平衡时NH3转化率为
s-1,当平衡时NH3转化率为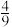 ,v逆=
,v逆=___________ mol L-1
L-1 s-1。
s-1。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g)⇌CO2(g) + H2(g)
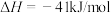 。相关数据如下:
。相关数据如下:| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t1 | t2 | ||
(2)甲容器中,平衡时,反应放出的热量
(3)T1时,反应的平衡常数K甲=
(4)乙容器中,a=
II.已知:①N2(g)+O2(g) ⇌2NO(g) △H1=+180kJ
 mol-1
mol-1②C(s)+O2(g)=CO2(g) △H2=-393kJ
 mol-1
mol-1③2C(s)+O2(g)=2CO(g) △H3=-221kJ
 mol-1
mol-1(5)若某反应的平衡常数表达式为
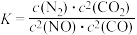 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(6)欲研究在某催化剂作用下2CO(g)+2NO(g)⇌N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如下图所示,A、B两点对应温度下正反应速率变化的原因可能是
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数 =
=(8)用NH3可以消除NO污染:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(1),该反应速率v正=k正
 c4(NH3)
c4(NH3) c6(NO),v逆=K逆
c6(NO),v逆=K逆 c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9
c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9 s-1,当平衡时NH3转化率为
s-1,当平衡时NH3转化率为 ,v逆=
,v逆= L-1
L-1 s-1。
s-1。
您最近一年使用:0次
解题方法
2 . 苯酚是重要的有机化工原料之一,工业上主要用于酚醛树脂、双酚、己内酰胺、水杨酸等的制备。回答下列问题:
(1)一定条件下,在CuCl2-FeCl3作催化剂的条件下,氧气直接氧化苯制备苯酚:2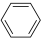 (g)
(g)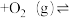 2
2 (g)△H<0,可分以下两步进行(其中b>0)
(g)△H<0,可分以下两步进行(其中b>0)
恒容密闭容器I:2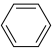 (g)
(g)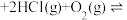 2
2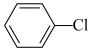 (g)
(g)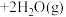 △H1=akJ·mol-1;
△H1=akJ·mol-1;
恒容密闭容器II: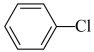 (g)
(g)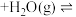
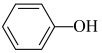 (g)
(g) △H2=bkJ·mol-1。
△H2=bkJ·mol-1。
①a___________ 0(填“大于”“小于”或“等于”,下同)。
②向容器I中加入10mol苯(g)、10molHCl(g)和一定量的O2(g),发生上述I中反应。苯的平衡转化率按不同投料比x[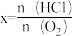 ]随温度的变化曲线如图所示。
]随温度的变化曲线如图所示。
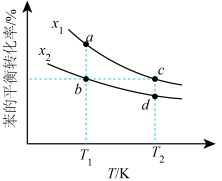
以下物理量大小关系有:图中所示投料比x1___________ x2;平衡常数Kb___________ Kc。T2温度下,加入物料后,x=2,测得初始压强为P0kPa,c点对应的HCl的平衡转化率为50%,则d点对应的平衡常数Kp=___________ 。(Kp是用气体平衡分压代替平衡浓度计算的平衡常数,气体平衡分压为平衡总压与其体积分数的积)
(2)改用乙酸铁催化苯直接羟基化制苯酚:在常压下,当反应时间为2h、乙酸用量为3.2mol时,改变反应温度,反应结果如表所示(转化率及收率均以苯酚的摩尔收率计)。
60℃时,苯酚选择性为___________ %(保留一位小数),温度高于50℃时,苯的转化率增大,而苯酚的选择性___________ (填“升高”“降低”或“不变”),乙酸铁催化苯直接羟基化合成苯酚的实验中反应温度的范围最好为___________ 。
(1)一定条件下,在CuCl2-FeCl3作催化剂的条件下,氧气直接氧化苯制备苯酚:2
 (g)
(g)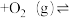 2
2 (g)△H<0,可分以下两步进行(其中b>0)
(g)△H<0,可分以下两步进行(其中b>0)恒容密闭容器I:2
 (g)
(g)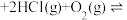 2
2 (g)
(g)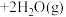 △H1=akJ·mol-1;
△H1=akJ·mol-1;恒容密闭容器II:
 (g)
(g)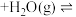
 (g)
(g) △H2=bkJ·mol-1。
△H2=bkJ·mol-1。①a
②向容器I中加入10mol苯(g)、10molHCl(g)和一定量的O2(g),发生上述I中反应。苯的平衡转化率按不同投料比x[
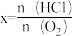 ]随温度的变化曲线如图所示。
]随温度的变化曲线如图所示。
以下物理量大小关系有:图中所示投料比x1
(2)改用乙酸铁催化苯直接羟基化制苯酚:在常压下,当反应时间为2h、乙酸用量为3.2mol时,改变反应温度,反应结果如表所示(转化率及收率均以苯酚的摩尔收率计)。
| 温度/℃ | 苯转化率/% | 苯酚收率/% | 苯酚选择性/% |
| 40 | 9.5 | 9.5 | 100 |
| 44.5 | 15.9 | 15.8 | 99.4 |
| 50 | 62.0 | 60.1 | 96.9 |
| 55.5 | 65.2 | 60.8 | 93.3 |
| 60 | 67.4 | 58 |
您最近一年使用:0次
3 . 给定温度下,在4个容积均为1.0L的恒容密闭容器中发生反应: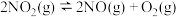 ,实验测得
,实验测得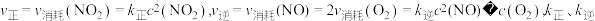 为速率常数,受温度影响。下列说法不正确的是
为速率常数,受温度影响。下列说法不正确的是
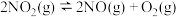 ,实验测得
,实验测得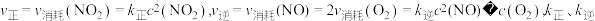 为速率常数,受温度影响。下列说法不正确的是
为速率常数,受温度影响。下列说法不正确的是| 容器 | 温度/ | 物质的起始浓度/ | 物质的平衡浓度/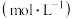 | ||
 |  | 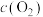 |  | ||
| I | 400 | 0 | 0.20 | 0.10 | 0.08 |
| II | 400 | 0.40 | 0 | 0 | 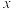 |
| III | 500 | 0.20 | 0 | 0 | 0.06 |
| IV | 500 | 0.05 | 0.05 | 0.30 | |
A.设 为该反应的化学平衡常数,则有 为该反应的化学平衡常数,则有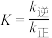 |
B.平衡时,容器I中NO的转化率 与容器Ⅲ中 与容器Ⅲ中 的转化率 的转化率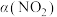 之和大于1 之和大于1 |
C.达到平衡时,容器II中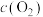 大于容器I中 大于容器I中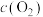 的两倍 的两倍 |
D.容器IV达到平衡前: |
您最近一年使用:0次
2024-02-21更新
|
47次组卷
|
2卷引用:江西省金溪县第一中学、广昌一中、南丰一中2023-2024学年高二上学期第一次月考化学试题
名校
4 . 一定温度下,向2.0 L的恒容密闭容器中充入1.6molCO、1.6molNO,发生反应2NO(g)+2CO(g) N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:
N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:
下列说法正确的是
 N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:
N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:| t/s | 0 | 5 | 10 | 15 | 20 |
| n(CO)/mol | 1.6 | 1.4 | 0.6 | 0.4 | 0.4 |
| A.反应在前5s的平均速率为v(N2)=0.02mol•L-1 |
| B.保持其他条件不变,降低温度,平衡时c(CO)=0.15mol•L-1,则反应的ΔH>0 |
| C.相同温度下,起始时向容器中充入1.6molN2和3.2molCO2,达到平衡时,则此反应的化学平衡常数为67.5 |
| D.保持其他条件不变,向容器中再充入1.6molCO,达到新平衡时,CO的转化率增大 |
您最近一年使用:0次
2024-01-18更新
|
206次组卷
|
2卷引用:江西省上饶市婺源县天佑中学2023-2024学年高二上学期12月考试化学试题
名校
5 . 一定温度下,在恒容真空密闭容器中充入足量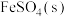 ,发生反应:
,发生反应: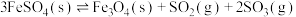 。平衡时
。平衡时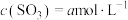 ,再充入
,再充入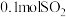 和
和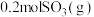 ,达到新平衡时
,达到新平衡时 。下列叙述正确的是
。下列叙述正确的是
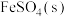 ,发生反应:
,发生反应: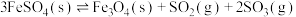 。平衡时
。平衡时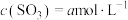 ,再充入
,再充入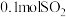 和
和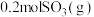 ,达到新平衡时
,达到新平衡时 。下列叙述正确的是
。下列叙述正确的是A.当 体积分数不随时间变化时达到平衡状态 体积分数不随时间变化时达到平衡状态 |
B.分离 瞬间,正反应速率增大,逆反应速率减小 瞬间,正反应速率增大,逆反应速率减小 |
C.两次平衡时浓度关系为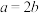 |
D.达到平衡后充入 ,平衡向左移动 ,平衡向左移动 |
您最近一年使用:0次
名校
解题方法
6 . 碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为_____ 。
②浓度均为0.1mol·L−1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4.则四种溶液中H+浓度由大到小的顺序为_____ 。
(2)常温时,C和CO的标准燃烧热分别为−394.0kJ·mol−1、−283.0kJ·mol−1,该条件下C转化为CO的热化学方程式为_____ 。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g) CH3OH(g) ΔH=QkJ·mol−1
CH3OH(g) ΔH=QkJ·mol−1
①该反应在不同温度下的化学平衡常数(K)如下表:
②一定温度下,将6molH2和2molCO充入体积为2L的密闭容器中,10min反应达到平衡状态,此时测得c(CO)=0.2mol·L−1,该温度下的平衡常数K=_____ ,0~10min内反应速率。
③在两个密闭容器中分别都充入20molH2和10molCO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20L,则B点对应容器的容积为_____ L。
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
| H2CO3 | H2C2O4 | |
| K1 | 4.2×10−7 | 5.4×10−2 |
| K2 | 5.6×10−11 | 5.4×10−5 |
②浓度均为0.1mol·L−1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4.则四种溶液中H+浓度由大到小的顺序为
(2)常温时,C和CO的标准燃烧热分别为−394.0kJ·mol−1、−283.0kJ·mol−1,该条件下C转化为CO的热化学方程式为
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g)
 CH3OH(g) ΔH=QkJ·mol−1
CH3OH(g) ΔH=QkJ·mol−1①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 300 | 350 |
| K/L2·mol−2 | 2.041 | 0.270 | 0.012 |
③在两个密闭容器中分别都充入20molH2和10molCO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20L,则B点对应容器的容积为
您最近一年使用:0次
名校
7 . TiN有着诱人的金黄色,熔点高、硬度大、化学稳定性好,可应用于高温结构材料和超导材料。利用气相沉积法制备氮化钛的反应为 ∆H=-346.2kJ/mol,回答下列问题:
∆H=-346.2kJ/mol,回答下列问题:
(1)将0.2mol 、2mol
、2mol 和2mol
和2mol 投入2L反应容器中,只改变温度,测得TiN的质量变化如下表所示:
投入2L反应容器中,只改变温度,测得TiN的质量变化如下表所示:
①250℃时,前2min内,用N2的浓度变化表示的平均反应速率v(N2)_____ 。
②平衡后,逆反应的速率:v(逆,250℃)_____ v(逆,300℃)(填“>”或“<”,下同)。
(2)将0.40mol ,0.30mol
,0.30mol 和1.20mol
和1.20mol 投入到某刚性反应器中,测得在反应过程中TiN的质量和反应体系的总压强p随着温度升高的变化曲线如图:
投入到某刚性反应器中,测得在反应过程中TiN的质量和反应体系的总压强p随着温度升高的变化曲线如图:

①下列说法正确的是_____ (填选项字母)。
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该化学平衡逆向移动
C.混合气体的平均相对分子质量:
②a、b、c三点对应温度下的平衡常数由大到小的顺序为_____ 。
③温度为T3K时,该反应达到平衡时,若以气体分压表示的该反应的平衡常数Kp=_____ MPa.
 ∆H=-346.2kJ/mol,回答下列问题:
∆H=-346.2kJ/mol,回答下列问题:(1)将0.2mol
 、2mol
、2mol 和2mol
和2mol 投入2L反应容器中,只改变温度,测得TiN的质量变化如下表所示:
投入2L反应容器中,只改变温度,测得TiN的质量变化如下表所示: | 0 | 1 | 2 | 3 | 4 | 10 | 12 |
| 250 | 0.00 | 0.70 | 1.24 | 1.74 | 2.22 | 4.96 | 4.96 |
| 300 | 0.00 | 1.18 | 2.24 | 3.10 | 3.10 | 3.10 | 3.10 |
②平衡后,逆反应的速率:v(逆,250℃)
(2)将0.40mol
 ,0.30mol
,0.30mol 和1.20mol
和1.20mol 投入到某刚性反应器中,测得在反应过程中TiN的质量和反应体系的总压强p随着温度升高的变化曲线如图:
投入到某刚性反应器中,测得在反应过程中TiN的质量和反应体系的总压强p随着温度升高的变化曲线如图:
①下列说法正确的是
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该化学平衡逆向移动
C.混合气体的平均相对分子质量:

②a、b、c三点对应温度下的平衡常数由大到小的顺序为
③温度为T3K时,该反应达到平衡时,若以气体分压表示的该反应的平衡常数Kp=
您最近一年使用:0次
名校
8 . 甲烷重整时涉及以下两个反应:
①CH4(g)+H2O(g) CO(g)+3H2(g) K1②CO(g)+H2O(g)
CO(g)+3H2(g) K1②CO(g)+H2O(g) CO2(g)+H2(g) K2
CO2(g)+H2(g) K2
它们的平衡常数随温度的变化如图所示,下列说法正确的是

①CH4(g)+H2O(g)
 CO(g)+3H2(g) K1②CO(g)+H2O(g)
CO(g)+3H2(g) K1②CO(g)+H2O(g) CO2(g)+H2(g) K2
CO2(g)+H2(g) K2它们的平衡常数随温度的变化如图所示,下列说法正确的是

| A.反应①、②都是放热反应 |
| B.两曲线交点表示此时①、②两反应速率相等 |
C.相同温度下,CH4(g)+2H2O(g) CO2(g)+4H2(g)的平衡常数为K1+K2 CO2(g)+4H2(g)的平衡常数为K1+K2 |
| D.相同条件下,增大反应①中水蒸气的浓度,CH4的转化率增大 |
您最近一年使用:0次
9 . I.某浓度碳酸钠溶液的pH随温度变化的关系如下图所示:
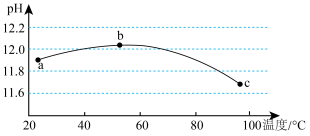
(1)Na2CO3溶液呈碱性的原因是___________ 。(用离子方程式表示)
(2)根据上图信息判断,下列说法中正确的是___________。
II.根据下列数据回答以下问题:
(3)向0.6mol∙L−1Na2CO3溶液通入HCl(g)至溶液中c( )=0.5mol∙L−1,忽略体积变化,此时溶液的pH=
)=0.5mol∙L−1,忽略体积变化,此时溶液的pH=___________ 。(保留2位小数)
(4)25℃时,某Na2SO3和NaHSO3的混合溶液恰好呈中性,则混合溶液中各离子浓度由大到小的顺序是___________ 。
(5)下列反应中可以发生的是___________。
(6)碳酸钙的溶度积常数:Ksp(CaCO3)=2.8×10−9,通过计算说明,向Ca(ClO)2溶液中通入少量CO2是得到Ca(HCO3)2溶液还是CaCO3沉淀___________ (CO2的水溶液可视为H2CO3溶液)。

(1)Na2CO3溶液呈碱性的原因是
(2)根据上图信息判断,下列说法中正确的是___________。
A.a点溶液中c( )最大 )最大 |
| B.b点水的电离程度最大 |
| C.c点溶液中c(OH—)约为10−2.3mol∙L−1 |
| D.b→c段pH降低的主要原因是温度升高,水的电离平衡正向移动 |
II.根据下列数据回答以下问题:
| 电解质 | H2CO3 | H2SO3 | ||
| 酸式电离常数 | Ka1=4.2×10−7 | Ka2=4.8×10−11 | Ka1=1.39×10−2 | Ka2=6.73×10−8 |
| 电解质 | HClO | CH3COOH | ||
| 酸式电离常数 | Ka=3.0×10−8 | Ka=1.75×10−5 | ||
(3)向0.6mol∙L−1Na2CO3溶液通入HCl(g)至溶液中c(
 )=0.5mol∙L−1,忽略体积变化,此时溶液的pH=
)=0.5mol∙L−1,忽略体积变化,此时溶液的pH=(4)25℃时,某Na2SO3和NaHSO3的混合溶液恰好呈中性,则混合溶液中各离子浓度由大到小的顺序是
(5)下列反应中可以发生的是___________。
A. +2CH3COOH=2CH3COO—+CO2↑+H2O +2CH3COOH=2CH3COO—+CO2↑+H2O |
B.2ClO—+CO2+H2O=2HClO+ |
C.2ClO—+SO2+H2O=2HClO+ |
D.HClO+ =ClO—+ =ClO—+ |
(6)碳酸钙的溶度积常数:Ksp(CaCO3)=2.8×10−9,通过计算说明,向Ca(ClO)2溶液中通入少量CO2是得到Ca(HCO3)2溶液还是CaCO3沉淀
您最近一年使用:0次
2023-12-23更新
|
176次组卷
|
2卷引用:江西省上饶市清源学校2023-2024学年高二上学期12月考试化学试题
名校
10 . 光化学烟雾中氮氧化合物对环境危害巨大,研究高效处理空气中的NO、NO2、N2O4等意义重大。请回答下列问题:
(1)

某反应的平衡常数表达式为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为___________ 。
(2)已知:反应 的速率方程为
的速率方程为 ,
,
 ,其中k正、k逆分别是正、逆反应的速率常数。T1℃,在2L恒容密闭容器中充入一定量NO2气体,发生上述反应,测得容器中不同时刻n(NO2)如表所示:
,其中k正、k逆分别是正、逆反应的速率常数。T1℃,在2L恒容密闭容器中充入一定量NO2气体,发生上述反应,测得容器中不同时刻n(NO2)如表所示:
①1~4min内该反应的平均反应速率v(O2)=___________ mol·L-1·min-1。
②T1℃下反应达到化学平衡时,
___________ 。
③若将容器的温度调为T2℃,该温度下k正=k逆,则T1___________ (填“<”、“>”或“=”)T2。
(3)将4molN2O4(g)通入2L恒容密闭容器中,只发生反应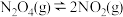 ,平衡体系中N2O4的体积分数(φ)随温度的变化如图所示。
,平衡体系中N2O4的体积分数(φ)随温度的变化如图所示。

①下列说法正确的是___________ (填标号)。
a.其他条件不变,温度升高,混合气体颜色变深
b.平衡后再通入4molN2O4(g),N2O4(g)的平衡转化率会减小
c.逆反应速率:A>B
②T2℃时,N2O4的平衡转化率为___________ 。
③若其他条件不变,将原容器改为恒容绝热容器,达到平衡时,与原平衡相比,NO2的体积分数___________ (填“增大”、“不变”或“减小”)。
(1)


某反应的平衡常数表达式为
 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)已知:反应
 的速率方程为
的速率方程为 ,
, ,其中k正、k逆分别是正、逆反应的速率常数。T1℃,在2L恒容密闭容器中充入一定量NO2气体,发生上述反应,测得容器中不同时刻n(NO2)如表所示:
,其中k正、k逆分别是正、逆反应的速率常数。T1℃,在2L恒容密闭容器中充入一定量NO2气体,发生上述反应,测得容器中不同时刻n(NO2)如表所示:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 2.00 | 1.60 | 1.32 | 1.14 | 1.00 | 1.00 |
②T1℃下反应达到化学平衡时,

③若将容器的温度调为T2℃,该温度下k正=k逆,则T1
(3)将4molN2O4(g)通入2L恒容密闭容器中,只发生反应
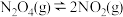 ,平衡体系中N2O4的体积分数(φ)随温度的变化如图所示。
,平衡体系中N2O4的体积分数(φ)随温度的变化如图所示。
①下列说法正确的是
a.其他条件不变,温度升高,混合气体颜色变深
b.平衡后再通入4molN2O4(g),N2O4(g)的平衡转化率会减小
c.逆反应速率:A>B
②T2℃时,N2O4的平衡转化率为
③若其他条件不变,将原容器改为恒容绝热容器,达到平衡时,与原平衡相比,NO2的体积分数
您最近一年使用:0次
2023-12-23更新
|
147次组卷
|
2卷引用:江西省上饶市清源学校2023-2024学年高二上学期12月考试化学试题



