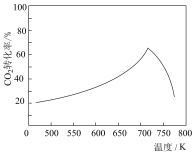
(2)合成氨的反应,T1℃时在容积为2L的恒容密闭容器中通入2molN2和5molH2发生反应。5min时反应达到平衡状态,达平衡时N2(g)的转化率为50%,求:
①0~5min内该反应的平均速率v(H2)=
②相同条件下,改变反应物的起始通入量,某时刻测得N2、H2、NH3的物质的量分别为2mol、4mol、2mol,则此时反应达到平衡状态 ),v正
),v正
a.升高温度 b.将平衡体系中的NH3(g)分离出来
c.减小容器的体积增大体系压强 d.加入合适的催化剂
(3)泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式
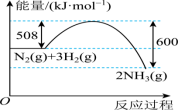
(1)工业上常用NH3和CO2合成尿素[CO(NH2)2],利用该反应可以在一定程度上减缓温室效应。该反应可分两步进行,其能量变化和反应历程如图所示

②合成尿素总反应自发进行的条件是
(2)一定温度下,将NH3和CO2按2:1的物质的量之比充入一容积恒为10L的密闭容器中发生总反应。15min时达到平衡,各物质的浓度变化曲线如图所示。

 min﹣1。
min﹣1。②下列叙述中能说明该反应达到平衡状态的是
A.体系压强不再变化
B.NH3和CO2的浓度之比为2:1
C.气体平均摩尔质量不再变化
D.NH3的消耗速率和CO2的消耗速率之比为2:1
③25min时再向容器中充入2mol的NH3、1molCO2和2molH2O,则此时平衡
(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。中国科学家在以H2为还原剂清除NO的研究方面取得了显著成果,其化学方程式为2NO(g)+2H2(g)⇌N2(g)+2H2O(g) ΔH<0。当固定比例的NO(g)和H2(g)的混合气体,以相同流速分别通过填充有两种催化剂的反应器,测得NO的转化率与温度的关系如图所示。
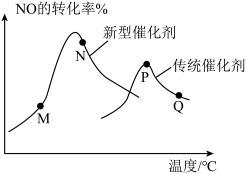
②M、N、P、Q四点中一定未达到平衡状态的是
Ⅰ.实验室按如下实验流程提取海带中的碘。


(3)海带灰中含有的其他可溶性无机盐,是在
Ⅱ.测定反应
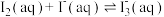 的平衡常数K
的平衡常数K常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol
 L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
| 碘量瓶 (实验Ⅰ) | 碘量瓶 (实验Ⅱ) | |
| 药品 | 0.5 g研细的碘,100 mL c2 mol L-1 KI L-1 KI | 0.5 g研细的碘,100 mL H2O |
| I2和I3-的总浓度 | c3 mol L-1 L-1 | c4 mol L-1 L-1 |
 的原因是
的原因是(5)实验I中,c(
 )=
)=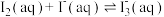 的平衡常数K=
的平衡常数K=(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将
(1)下列事实中,能证明氢硫酸的酸性比亚硫酸的酸性弱的是___________(填标号)。
| A.氢硫酸能还原亚硫酸生成硫单质和水 |
| B.0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1 |
| C.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| D.氢硫酸的导电能力低于亚硫酸 |

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为
制得等量H2所需能量较少的是
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①向反应器中再分别充入下列气体,能使H2S转化率增大的是
A.H2S B.CO2 C.COS D.N2
②求610 K时,该反应的平衡常数K=
 2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
2NH3(g),NH3的物质的量浓度随时间的变化如图所示。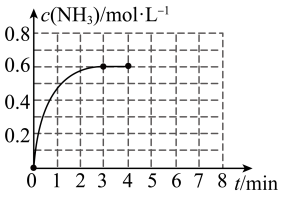
(1)①前3min内平均反应速率:v(H2)=
②平衡时,N2的转化率为
③在此温度下,上述反应平衡常数K=
Ⅱ.工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
| 化学反应 | 平衡常数符号 | 平衡常数值 | ||
| 500℃ | 700℃ | 800℃ | ||
| ①2H2(g)+CO(g)=CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)=CO(g)+H2O(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H3 | K3 | |||
(2)根据反应①与②可推导出K3=
(3)下列图像符合反应③的是_______。
A.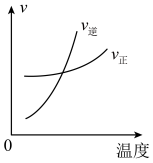 | B.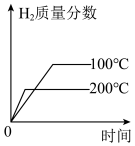 |
C.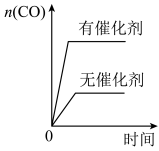 | D.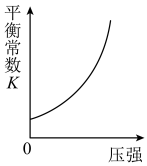 |
 的应用和治理是当今社会的热点问题。CO工业上可用于高炉炼铁,发生如下反应:
的应用和治理是当今社会的热点问题。CO工业上可用于高炉炼铁,发生如下反应: ,已知该反应在不同温度下的平衡常数如下表:
,已知该反应在不同温度下的平衡常数如下表:| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
 的转化,可采取的措施是
的转化,可采取的措施是a.及时吸收或移出
 b.增大反应体系的压强
b.增大反应体系的压强c.用更高效的催化剂 d.粉碎矿石,增大接触面积
(2)一定条件下,在容积一定的容器中,铁和
 发生反应:
发生反应: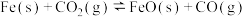
 ,该反应的平衡常数表达式
,该反应的平衡常数表达式
 增大的是
增大的是a.升高温度 b.增大压强 c.充入和定量CO d.再加入一些铁粉
Ⅱ.合成尿素的反应为:

 。一定条件下,在
。一定条件下,在 的恒容密闭容器中,充入
的恒容密闭容器中,充入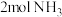 和
和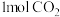 ,反应经
,反应经 后达到平衡,测得容器中
后达到平衡,测得容器中 的浓度为
的浓度为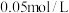 。完成下列填空:
。完成下列填空:(3)
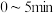 内,
内, 平均反应速率=
平均反应速率=
(4)下列描述中能说明上述反应已达平衡的是
a.
 b.气体的平均相对分子质量不随时间而变化
b.气体的平均相对分子质量不随时间而变化c.
 和
和 的比例保持不变 d.气体的压强不再发生变化
的比例保持不变 d.气体的压强不再发生变化
7 . “节能减排”和“低碳经济”的一项重要课题就是如何将 转化为可利用的资源。
转化为可利用的资源。
Ⅰ.目前工业上有一种方法是用 来生产燃料甲醇。
来生产燃料甲醇。
已知: 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol 、
、 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol
反应①:
 kJ⋅mol
kJ⋅mol
反应②:
 kJ⋅mol
kJ⋅mol
反应③:

(1)


(2)恒温条件下,在某恒容密闭容器中;按照
 投料发生反应③,测得
投料发生反应③,测得 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。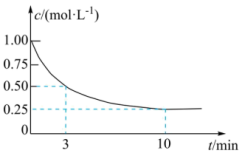
①从反应开始到3 min, 的平均反应速率
的平均反应速率
 ⋅min
⋅min ;试在图中绘制出
;试在图中绘制出 的浓度随时间变化的图像
的浓度随时间变化的图像
②该反应的平衡常数
(3)恒温条件下,在某恒压密闭容器中仅发生反应①,当反应达到平衡后,
Ⅰ.降低温度,CO的平衡转化率
Ⅱ.向平衡体系中通入惰性气体,平衡
①CO(g)+2H2(g)
 CH3OH(g) ΔH1<0 K1
CH3OH(g) ΔH1<0 K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2<0 K2
CH3OCH3(g)+H2O(g) ΔH2<0 K2③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3<0 K3
CO2(g)+H2(g) ΔH3<0 K3(1)则反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)达到平衡状态的
CH3OCH3(g)+CO2(g)达到平衡状态的A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生反应:
2CH3OH(g)
 CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:
CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②反应达平衡时,容器内的压强为P0.该反应在200 ℃时的平衡常数Kp=
③200℃时,向该容器中投入三种成分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol·L-1) | 0.54 | 0.68 | 0.68 |
I.CH4(g)
 C(s)+2H2(g)
C(s)+2H2(g)  H1 K1
H1 K1Ⅱ.CO2(g)+C(s)
 2CO(g)
2CO(g)  H2 K2
H2 K2回答下列问题:
(1)CH4、CO2催化重整生成CO、H2的热化学方程式为
 H1、
H1、 H2表示),该反应的平衡常数K=
H2表示),该反应的平衡常数K=(2)在恒温恒压下,向甲、乙两个密闭容器中均通入10molCH4和10molCO2进行催化重整,并分别加入两种不同催化剂i和ii,测得相同时间内CO的平衡百分含量随温度的变化关系如图1所示。
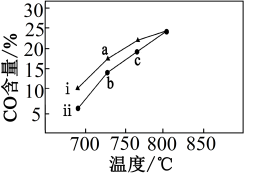

②能够说明CH4﹣CO2催化重整生成CO、H2达到化学平衡状态的是
A.容器内气体密度保持不变
B.化学平衡常数保持不变
C.CO2的体积分数保持不变
D.相同时间内,断裂4molC﹣H的同时生成2molH﹣H键
(3)实验室在模拟CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)制取甲醇的过程中,将气体体积比为1:1的CO2和H2混合气体按相同流速通过反应器,CO2的转化率[α(CO2)]随温度和压强的变化关系如图2所示(已知:该反应的催化剂活性受温度影响变化不大。):
CH3OH(g)+H2O(g)制取甲醇的过程中,将气体体积比为1:1的CO2和H2混合气体按相同流速通过反应器,CO2的转化率[α(CO2)]随温度和压强的变化关系如图2所示(已知:该反应的催化剂活性受温度影响变化不大。):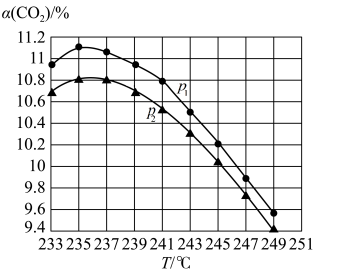
②p1
③分析236℃后曲线变化的原因:
10 . 2023年9月23日,杭州亚运会主火炬塔使用了燃烧高效、排放清洁、可再生、运输便捷的甲醇燃料,这是人类历史上第一次废碳再生利用,有利于推进“碳达峰”和“碳中和”。工业上用 来生产燃料甲醇的反应为
来生产燃料甲醇的反应为
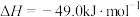 ,现将
,现将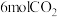 和
和 充入
充入 的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图中实线所示:
的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图中实线所示:
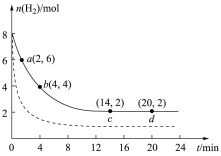
回答下列问题:
(1)该反应在
(2)下列说法不能表明该反应已经达到平衡状态的是_______(填选项字母)。
| A.压强保持不变 |
| B.混合气体的平均相对分子质量不变 |
C.混合气体中 的百分含量保持不变 的百分含量保持不变 |
D. |
(3)
 点正反应速率
点正反应速率 点逆反应速率,前
点逆反应速率,前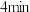 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为(4)平衡时
 的转化率为
的转化率为
 。
。(5)仅改变某一实验条件再进行实验,测得
 的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是
的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是(6)如果要加快反应速率并且提高
 平衡转化率,可以采取的措施有
平衡转化率,可以采取的措施有(7)一定条件下,单位时间内不同温度下测定的
 转化率如图所示。温度高于
转化率如图所示。温度高于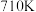 时,随温度的升高
时,随温度的升高 转化率降低的原因可能是
转化率降低的原因可能是