1 . 接触法制硫酸工艺中,其主反应在450℃左右并有催化剂存在下进行: 。
。
(1)该反应的平衡常数表达式K=_______ ,该反应450℃时的平衡常数_______ 500℃时的平衡常数(填“>”或“<”或“=”)。
(2)下列描述能说明上述反应(反应容器体积不变)已达平衡的是_______ 。
a.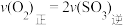
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入 SO2和
SO2和 O2,半分钟后达到平衡,测得容器中含0.18molSO3,则v(O2)=
O2,半分钟后达到平衡,测得容器中含0.18molSO3,则v(O2)=_______ mol/(L∙min):如果要提高SO2转化率,可以采取哪些措施?请写出两种方法_______ 、_______ 。
 。
。(1)该反应的平衡常数表达式K=
(2)下列描述能说明上述反应(反应容器体积不变)已达平衡的是
a.
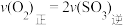
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入
 SO2和
SO2和 O2,半分钟后达到平衡,测得容器中含0.18molSO3,则v(O2)=
O2,半分钟后达到平衡,测得容器中含0.18molSO3,则v(O2)=
您最近一年使用:0次
名校
解题方法
2 . І.甲醇是重要的化工原料,利用合成气(CO、H2、CO2)在催化剂的作用合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90.77kJ/mol
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
(1)反应③的ΔH3=___________
(2)若反应①在恒容密闭容器中进行,能判断反应已达化学平衡状态的是___________(填字母)。
(3)在一定温度和催化剂存在下,向2L密闭容器中充入5molCO2和5molH2发生反应①5min时达到平衡,测得CO2还剩4mol。
①该时间内用氢气表示的反应速率v(H2)为___________ 。
②达平衡时反应①的平衡常数K为___________ (填计算结果)。
Ⅱ.用滴定法可以测定食醋中醋酸的含量,用酸式滴定管取10.00mL这种市售食醋,置于已知烧杯中称得其质量为12.50g,再稀释至100mL,滴定时每次取20.00mL于锥形瓶中,选用的标准溶液是0.1125mol/LNaOH溶液滴定至终点,平均每次消耗NaOH溶液20.00mL。
(4)该实验中的指示剂应选择___________ ,判断滴定终点的方法为___________ 。
(5)该食醋中CH3COOH的质量分数为___________ (结果保留三位有效数字)。
(6)滴定过程中下列操作会导致测定的CH3COOH的质量分数偏小的是(其它操作均正确)___________
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90.77kJ/mol
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
(1)反应③的ΔH3=
(2)若反应①在恒容密闭容器中进行,能判断反应已达化学平衡状态的是___________(填字母)。
| A.CO2百分含量保持不变 | B.容器中H2浓度与CO2浓度之比为3∶1 |
| C.容器中混合气体的密度保持不变 | D.CO2的生成速率与CH3OH的生成速率相等 |
(3)在一定温度和催化剂存在下,向2L密闭容器中充入5molCO2和5molH2发生反应①5min时达到平衡,测得CO2还剩4mol。
①该时间内用氢气表示的反应速率v(H2)为
②达平衡时反应①的平衡常数K为
Ⅱ.用滴定法可以测定食醋中醋酸的含量,用酸式滴定管取10.00mL这种市售食醋,置于已知烧杯中称得其质量为12.50g,再稀释至100mL,滴定时每次取20.00mL于锥形瓶中,选用的标准溶液是0.1125mol/LNaOH溶液滴定至终点,平均每次消耗NaOH溶液20.00mL。
(4)该实验中的指示剂应选择
(5)该食醋中CH3COOH的质量分数为
(6)滴定过程中下列操作会导致测定的CH3COOH的质量分数偏小的是(其它操作均正确)___________
| A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次 |
| B.滴定开始前碱式滴定管尖嘴部分无气泡,在滴定终点读数时发现气泡 |
| C.达到滴定终点时,俯视溶液凹液面最低点读数 |
| D.滴定过程中,部分NaOH溶液滴到锥形瓶外 |
您最近一年使用:0次
名校
3 . 一碳化学是以分子中只含一个碳原子的化合物为原料生产化工产品的方法。合成气( 和
和 的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:
的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:
I:
II: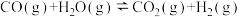
III:
(1)当反应I达到平衡后,下列措施可提高正反应速率的是_______(填标号)。
(2)若在恒温恒容容器中仅发生反应II,则下列能说明反应达到平衡状态的是_______。
(3)向容积为 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应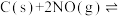
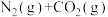 ,
, 和
和 的物质的量变化如下表所示。
的物质的量变化如下表所示。
①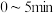 内,以
内,以 表示的该反应速率
表示的该反应速率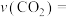
___________ ,最终达平衡时 的转化率
的转化率
___________ ,该温度 ℃下的平衡常数
℃下的平衡常数
___________ 。
②保持温度 ℃不变,向该
℃不变,向该 密闭容器中加入该四种反应混合物各
密闭容器中加入该四种反应混合物各 ,该时刻,正、逆反应速率的大小关系为:
,该时刻,正、逆反应速率的大小关系为: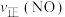
___________ 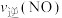 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)已知4CO(g) +2NO2(g) 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行。
 和
和 的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:
的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:I:

II:
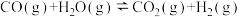
III:

(1)当反应I达到平衡后,下列措施可提高正反应速率的是_______(填标号)。
| A.加入焦炭 | B.通入CO | C.升高温度 | D.分离出氢气 |
| A.容器内气体的压强不变 |
| B.容器内气体的总质量不变 |
| C.容器内气体的平均相对分子质量不变 |
D.单位时间内,每有2 mol 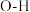 键断裂,同时有1 mol 键断裂,同时有1 mol  键断裂 键断裂 |
 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应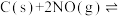
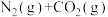 ,
, 和
和 的物质的量变化如下表所示。
的物质的量变化如下表所示。| 条件 | 保持温度为 /℃ /℃ | ||||||
| 时间 | 0 | 5min | 10min | 15min | 20min | 25min | 30min |
 物质的量 物质的量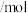 | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
 物质的量 物质的量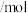 | 0 | 0.3 | 0.50 | 0.65 | 0.75 | 0.80 | 0.80 |
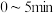 内,以
内,以 表示的该反应速率
表示的该反应速率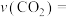
 的转化率
的转化率
 ℃下的平衡常数
℃下的平衡常数
②保持温度
 ℃不变,向该
℃不变,向该 密闭容器中加入该四种反应混合物各
密闭容器中加入该四种反应混合物各 ,该时刻,正、逆反应速率的大小关系为:
,该时刻,正、逆反应速率的大小关系为: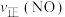
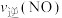 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)已知4CO(g) +2NO2(g)
 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
您最近一年使用:0次
2023-12-14更新
|
172次组卷
|
3卷引用:广西百色市德保高中2023-2024学年高二上学期11月期中考试化学试题
4 . 丙烯是一种重要的化工原料。可在一固定容积的密闭容器中由丙烷催化脱氢制备。
(1)已知: ①C3H8(g)=C3H6(g)+H2(g) _______。
_______。
②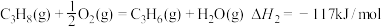
③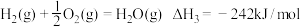
反应①的
___________ 。
(2)欲提高①反应中 的平衡转化率,可采取的措施有___________(填标号)。
的平衡转化率,可采取的措施有___________(填标号)。
(3)能表明该反应①达到平衡状态的是___________(填字母)。
(4)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为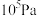 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为___________ 。该反应的平衡常数
___________ Pa.(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。写出该反应的化学平衡常数表达式:K=___________ ;保持恒温恒容,将反应的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡___________ (填“正向”逆向”或“不”)移动,平衡常数K___________ (填“变大”变小”或“不变”)。
(1)已知: ①C3H8(g)=C3H6(g)+H2(g)
 _______。
_______。②
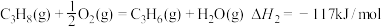
③
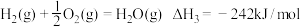
反应①的

(2)欲提高①反应中
 的平衡转化率,可采取的措施有___________(填标号)。
的平衡转化率,可采取的措施有___________(填标号)。A.增大 的浓度 的浓度 | B.提高温度 | C.恒容下通入惰性气体 | D.使用高效催化剂 |
| A.C3H8的转化率等于H2的产率 | B.混合气体的平均相对分子质量不变 |
C.v(C3H8)与 的比值不变 的比值不变 | D.混合气体的密度不变 |
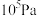 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为
(5)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。写出该反应的化学平衡常数表达式:K=
您最近一年使用:0次
名校
解题方法
5 . 碘及其化合物在人类活动中占有重要地位。回答下列问题:
(1)将 、KI和洗洁精混合后,短时间内产生大量的泡沫。其总反应为
、KI和洗洁精混合后,短时间内产生大量的泡沫。其总反应为 ,能量曲线如下图所示。
,能量曲线如下图所示。

反应过程分为两步:
第一步:
 慢反应
慢反应
第二步:
 快反应
快反应
①
___________ 0(填“>”、“<”或“=”);
②在上图中画出有KI参与,经两步反应生成产物的能量历程图_________ 。
③从热力学角度分析,总反应在___________ 条件下可以自发进行(填“低温”“高温”或“任何温度”)
(2)已知:25℃下,存在以下平衡(不考虑碘与水以及其它反应),
(i)
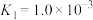
(ii)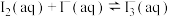

(iii)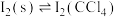
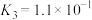
烧杯甲:将 加入20mL水中(含
加入20mL水中(含 沉淀);
沉淀);
烧杯乙:将 加入20mLKI溶液(含
加入20mLKI溶液(含 沉淀)。
沉淀)。
①甲中存在平衡(i),乙中存在平衡(i)和(ii),下列说法错误的是___________ 。
A.烧杯乙中剩余的 沉淀质量比甲的
沉淀质量比甲的 沉淀质量小
沉淀质量小
B.室温下,甲中加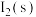 ,溶液中
,溶液中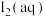 浓度增大
浓度增大
C.乙中通入少量 ,
,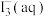 浓度降低
浓度降低
D.通入 ,反应(ii)的平衡常数小于640
,反应(ii)的平衡常数小于640
②为了探究水溶液中含碘微粒的存在形式,进行实验:恒温25℃向10mL KI溶液中加入10mL一定浓度的
KI溶液中加入10mL一定浓度的 溶液,(混合后的体积变化可忽略)。反应后碘元素的相关微粒浓度如表:
溶液,(混合后的体积变化可忽略)。反应后碘元素的相关微粒浓度如表:
其中
___________ (用含c的代数式表示),若___________ (用含a、b、c的代数式表示),说明平衡体系中不含 沉淀。
沉淀。
③向烧杯甲中加入一定量 进行萃取,平衡后无沉淀,上层与下层溶液的碘元素浓度比为
进行萃取,平衡后无沉淀,上层与下层溶液的碘元素浓度比为___________ 。
(3) 可用于电解法制备食盐中的
可用于电解法制备食盐中的 ,装置如图所示。写出电解时阴极反应式
,装置如图所示。写出电解时阴极反应式___________ 。

(1)将
 、KI和洗洁精混合后,短时间内产生大量的泡沫。其总反应为
、KI和洗洁精混合后,短时间内产生大量的泡沫。其总反应为 ,能量曲线如下图所示。
,能量曲线如下图所示。
反应过程分为两步:
第一步:

 慢反应
慢反应第二步:

 快反应
快反应①

②在上图中画出有KI参与,经两步反应生成产物的能量历程图
③从热力学角度分析,总反应在
(2)已知:25℃下,存在以下平衡(不考虑碘与水以及其它反应),
(i)

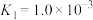
(ii)
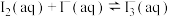

(iii)
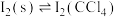
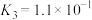
烧杯甲:将
 加入20mL水中(含
加入20mL水中(含 沉淀);
沉淀);烧杯乙:将
 加入20mLKI溶液(含
加入20mLKI溶液(含 沉淀)。
沉淀)。①甲中存在平衡(i),乙中存在平衡(i)和(ii),下列说法错误的是
A.烧杯乙中剩余的
 沉淀质量比甲的
沉淀质量比甲的 沉淀质量小
沉淀质量小B.室温下,甲中加
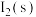 ,溶液中
,溶液中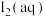 浓度增大
浓度增大C.乙中通入少量
 ,
,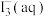 浓度降低
浓度降低D.通入
 ,反应(ii)的平衡常数小于640
,反应(ii)的平衡常数小于640②为了探究水溶液中含碘微粒的存在形式,进行实验:恒温25℃向10mL
 KI溶液中加入10mL一定浓度的
KI溶液中加入10mL一定浓度的 溶液,(混合后的体积变化可忽略)。反应后碘元素的相关微粒浓度如表:
溶液,(混合后的体积变化可忽略)。反应后碘元素的相关微粒浓度如表:| 微粒 |  |  |  |
浓度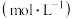 | a | b | c |

 沉淀。
沉淀。③向烧杯甲中加入一定量
 进行萃取,平衡后无沉淀,上层与下层溶液的碘元素浓度比为
进行萃取,平衡后无沉淀,上层与下层溶液的碘元素浓度比为(3)
 可用于电解法制备食盐中的
可用于电解法制备食盐中的 ,装置如图所示。写出电解时阴极反应式
,装置如图所示。写出电解时阴极反应式
您最近一年使用:0次
解题方法
6 . 氮和氮的化合物与人类关系密切。已知:
i.
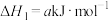
ii.
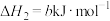
iii.

(1)

___________  (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(2)T℃时,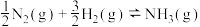
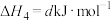 。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为___________ ;d=___________ 。
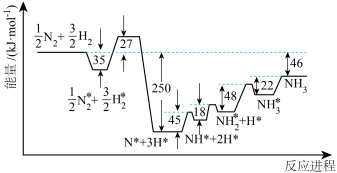
(3)某小组往一恒温恒压含有铁触媒的容器中充入1
 和3
和3
 ,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
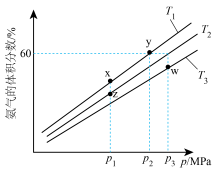
①图中温度 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,图中x、y、z、w四点中,化学反应速率最快的是___________ 点。
②y点时, 的平衡转化率为
的平衡转化率为___________ ;在温度 时,该反应的平衡常数
时,该反应的平衡常数
___________  (
( 为以分压表示的平衡常数,分压=总压×物质的量分数,用含
为以分压表示的平衡常数,分压=总压×物质的量分数,用含 的式子表示)。
的式子表示)。
③若在恒容条件下发生该反应,下列说法正确的是___________ (填标号)。
A.温度升高, 将增大
将增大
B.当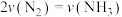 时,反应达到了平衡
时,反应达到了平衡
C.当 的体积分数不再改变时,反应达到了平衡
的体积分数不再改变时,反应达到了平衡
D.断裂1
 键的同时断裂6
键的同时断裂6
 键,说明反应达到了平衡
键,说明反应达到了平衡
(4)氨的催化氧化过程中同时发生的反应主要如下:
反应I.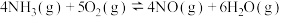
反应II.
测得相同时间内 、
、 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。
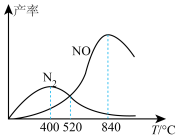
①反应II为___________ (填“放热”或“吸热”)反应。
②随着温度升高, 的产率先增大后减小的原因为
的产率先增大后减小的原因为___________ 。
i.

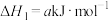
ii.

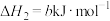
iii.


(1)


 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。(2)T℃时,
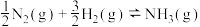
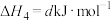 。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
(3)某小组往一恒温恒压含有铁触媒的容器中充入1

 和3
和3
 ,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
①图中温度
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②y点时,
 的平衡转化率为
的平衡转化率为 时,该反应的平衡常数
时,该反应的平衡常数
 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数,用含
为以分压表示的平衡常数,分压=总压×物质的量分数,用含 的式子表示)。
的式子表示)。③若在恒容条件下发生该反应,下列说法正确的是
A.温度升高,
 将增大
将增大B.当
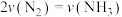 时,反应达到了平衡
时,反应达到了平衡C.当
 的体积分数不再改变时,反应达到了平衡
的体积分数不再改变时,反应达到了平衡D.断裂1

 键的同时断裂6
键的同时断裂6
 键,说明反应达到了平衡
键,说明反应达到了平衡(4)氨的催化氧化过程中同时发生的反应主要如下:
反应I.
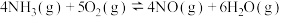
反应II.

测得相同时间内
 、
、 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。
①反应II为
②随着温度升高,
 的产率先增大后减小的原因为
的产率先增大后减小的原因为
您最近一年使用:0次
2023-11-13更新
|
214次组卷
|
4卷引用:广西贵港市部分学校2023-2024学年高二上学期期中联考化学试题
解题方法
7 . Ⅰ.探究实验。
(1)某化学兴趣小组设计实验探究 对
对 与
与 反应速率的影响:取等量
反应速率的影响:取等量 和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mL
和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mL  所需时间。
所需时间。
已知酸性条件下: 。
。
①表中
___________ mL。
②实验测得 ,则可得出的实验结论是
,则可得出的实验结论是___________ 。
(2)一定温度下,某密闭容器中发生反应 ,
,
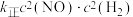 ,
,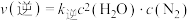 (
( 、
、 为速率常数)。该温度下该反应的平衡常数为
为速率常数)。该温度下该反应的平衡常数为___________ (用 、
、 表示)。
表示)。
Ⅱ.常温下,几种物质的溶度积常数如下表:
(3)某酸性 溶液中含少量的
溶液中含少量的 ,为制得纯净
,为制得纯净 溶液,宜加入
溶液,宜加入___________ 调至溶液pH=4,使 转化为
转化为 沉淀,此时溶液中
沉淀,此时溶液中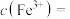
___________ 。
(4)过滤后,将所得滤液经过蒸发浓缩、冷却结晶,可得到 晶体。由
晶体。由 晶体得到纯的无水
晶体得到纯的无水 ,需要进行的操作是
,需要进行的操作是___________ 。
Ⅲ.加热饱和溶液,测得该溶液的pH变化如表所示:
(5)甲同学认为,该溶液pH升高的原因是 的水解程度增大,故碱性增强。而乙同学认为,该溶液pH升高的原因是
的水解程度增大,故碱性增强。而乙同学认为,该溶液pH升高的原因是 受热分解生成了
受热分解生成了 ,并推断
,并推断 的水解程度
的水解程度___________ (填“大于”或“小于”) 的。
的。
(6)丙同学认为甲、乙的判断都不充分。丙同学认为:将加热煮沸后的溶液冷却到10℃,若溶液的pH>8.3,则___________ (填“甲”或“乙”)同学判断正确。
(1)某化学兴趣小组设计实验探究
 对
对 与
与 反应速率的影响:取等量
反应速率的影响:取等量 和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mL
和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mL  所需时间。
所需时间。| 实验编号 | 1 | 2 | 3 | 4 |
10% 的体积/mL 的体积/mL | 10.0 | 10.0 | 10.0 |  |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | 1.5 |
| 水的体积/mL | 15.0 | 14.5 |  | 13.5 |
| 所需时间t/s |  |  |  |  |
 。
。①表中

②实验测得
 ,则可得出的实验结论是
,则可得出的实验结论是(2)一定温度下,某密闭容器中发生反应
 ,
,
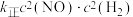 ,
,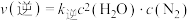 (
( 、
、 为速率常数)。该温度下该反应的平衡常数为
为速率常数)。该温度下该反应的平衡常数为 、
、 表示)。
表示)。Ⅱ.常温下,几种物质的溶度积常数如下表:
| 物质 |  |  | CuCl | CuI |
 | 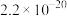 |  |  |  |
 溶液中含少量的
溶液中含少量的 ,为制得纯净
,为制得纯净 溶液,宜加入
溶液,宜加入 转化为
转化为 沉淀,此时溶液中
沉淀,此时溶液中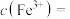
(4)过滤后,将所得滤液经过蒸发浓缩、冷却结晶,可得到
 晶体。由
晶体。由 晶体得到纯的无水
晶体得到纯的无水 ,需要进行的操作是
,需要进行的操作是Ⅲ.加热饱和溶液,测得该溶液的pH变化如表所示:
| 温度(℃) | 10 | 20 | 30 | 加热点沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
 的水解程度增大,故碱性增强。而乙同学认为,该溶液pH升高的原因是
的水解程度增大,故碱性增强。而乙同学认为,该溶液pH升高的原因是 受热分解生成了
受热分解生成了 ,并推断
,并推断 的水解程度
的水解程度 的。
的。(6)丙同学认为甲、乙的判断都不充分。丙同学认为:将加热煮沸后的溶液冷却到10℃,若溶液的pH>8.3,则
您最近一年使用:0次
8 . CO2和CH4是两种主要的温室气体,以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)工业上CH4-H2O催化重整是目前大规模制取合成气(CO和H2的混合气)的重要方法,其原理为:
反应I:
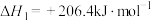
反应Ⅱ: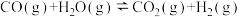
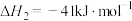
CH4(g)和H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为___________ 。
(2)将1molCH4(g)和1molH2O(g)加入恒温恒压的密闭容器中(温度298K,压强100kPa),发生反应I,不考虑反应Ⅱ的发生,该反应中,正反应速率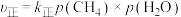 ,p为分压(分压=总压×物质的量分数),若该条件下
,p为分压(分压=总压×物质的量分数),若该条件下 ,当CH4分解20%时,
,当CH4分解20%时,
________ 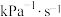 。
。
(3)将CO2和CH4在一定条件下反应可制得合成气,在1L恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为 ,一定条件下发生反应:
,一定条件下发生反应: ,测得CH4的平衡转化率与温度及压强的关系如图所示:
,测得CH4的平衡转化率与温度及压强的关系如图所示:

①该反应为___________ (填“放热”或“吸热”)反应;压强P1和P2的大小关系为___________ 。
②对于气相反应,用某组分 的平衡压强
的平衡压强 代替物质的量浓度
代替物质的量浓度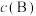 也可表示平衡常数(记作
也可表示平衡常数(记作 ),如果
),如果 ,计算X点的平衡常数
,计算X点的平衡常数
___________ MPa2(用平衡分压代替平衡浓度计算)。
③下列能说明该反应已达平衡状态的是___________ (填字母)。
A.单位时间内有4molC-H键断裂,同时有4molH-H键生成
B.混合气体的密度不随时间变化
C.混合气体的平均相对分子质量不随时间变化
D.体系中 保持不变
保持不变
(4)科学家研究出如图所示装置,可以将温室气体CO2转化为燃料气体CO。该装置工作时,H+移动的方向为___________ (填“a→b”或“b→a”),b电极的电极反应式为___________ 。

(1)工业上CH4-H2O催化重整是目前大规模制取合成气(CO和H2的混合气)的重要方法,其原理为:
反应I:

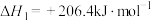
反应Ⅱ:
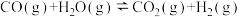
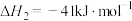
CH4(g)和H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(2)将1molCH4(g)和1molH2O(g)加入恒温恒压的密闭容器中(温度298K,压强100kPa),发生反应I,不考虑反应Ⅱ的发生,该反应中,正反应速率
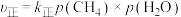 ,p为分压(分压=总压×物质的量分数),若该条件下
,p为分压(分压=总压×物质的量分数),若该条件下 ,当CH4分解20%时,
,当CH4分解20%时,
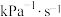 。
。(3)将CO2和CH4在一定条件下反应可制得合成气,在1L恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为
 ,一定条件下发生反应:
,一定条件下发生反应: ,测得CH4的平衡转化率与温度及压强的关系如图所示:
,测得CH4的平衡转化率与温度及压强的关系如图所示:
①该反应为
②对于气相反应,用某组分
 的平衡压强
的平衡压强 代替物质的量浓度
代替物质的量浓度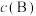 也可表示平衡常数(记作
也可表示平衡常数(记作 ),如果
),如果 ,计算X点的平衡常数
,计算X点的平衡常数
③下列能说明该反应已达平衡状态的是
A.单位时间内有4molC-H键断裂,同时有4molH-H键生成
B.混合气体的密度不随时间变化
C.混合气体的平均相对分子质量不随时间变化
D.体系中
 保持不变
保持不变(4)科学家研究出如图所示装置,可以将温室气体CO2转化为燃料气体CO。该装置工作时,H+移动的方向为

您最近一年使用:0次
9 . 将0.20molNO和0.20molCO混合气体充入容积为1.0L的恒容密闭容器中,分别在T1和T2温度下发生反应: 。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
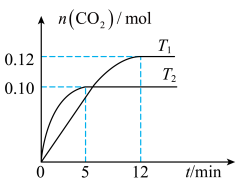
 。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
A. 的 的 |
| B.在温度T2下,若向该容器中加入0.40molNO和0.40molCO,反应达到平衡后CO的转化率小于50% |
C.温度T1时,前12minN2的平均反应速率 |
| D.温度T2时,若起始向容器中通入0.10molNO、0.30molCO、0.10molN2和0.10molCO2,反应向正方向进行 |
您最近一年使用:0次
名校
解题方法
10 . 三氧化钼(MoO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为MoS3)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s) Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1
②S2(g)+2O2(g) 2SO2(g) △H2
2SO2(g) △H2
③2Mo(s)+3O2(g) 2MoO3(s) △H3
2MoO3(s) △H3
则2MoS2+7O2(g) 2MoO3(s)+4SO2(g)的△H=
2MoO3(s)+4SO2(g)的△H=_______ (用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应MoS2(s) Mo(s)+S2(g)。
Mo(s)+S2(g)。
①下列说法正确的是_______ (填序号)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4mol•L-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度_______ (填“>”“<”或“=”)1.4mol•L-1。
(3)在2L恒容密闭容器中充入1.0molS2(g)和1.5molO2(g),若仅发生反应;S2(g)+2O2(g) 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为
2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为_______ mol•L-1•min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2+7O2(g) 2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。

①比较p1、p2、p3的大小:_______ 。
②若在p2为7.0kPa下,初始通入7.0molO2,则A点平衡常数Kp=________ 。(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(1)已知:①MoS2(s)
 Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1②S2(g)+2O2(g)
 2SO2(g) △H2
2SO2(g) △H2③2Mo(s)+3O2(g)
 2MoO3(s) △H3
2MoO3(s) △H3则2MoS2+7O2(g)
 2MoO3(s)+4SO2(g)的△H=
2MoO3(s)+4SO2(g)的△H=(2)若在恒温恒容条件下,仅发生反应MoS2(s)
 Mo(s)+S2(g)。
Mo(s)+S2(g)。①下列说法正确的是
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4mol•L-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度
(3)在2L恒容密闭容器中充入1.0molS2(g)和1.5molO2(g),若仅发生反应;S2(g)+2O2(g)
 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为
2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2+7O2(g)
 2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
①比较p1、p2、p3的大小:
②若在p2为7.0kPa下,初始通入7.0molO2,则A点平衡常数Kp=
您最近一年使用:0次



