名校
解题方法
1 .  在化工生产中有重要作用.天然气法合成
在化工生产中有重要作用.天然气法合成 相关反应如下:
相关反应如下:
反应I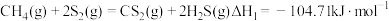
反应Ⅱ
(1) 、
、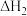 随温度变化不大。温度不同时,反应体系中
随温度变化不大。温度不同时,反应体系中 不同。合成
不同。合成 总反应
总反应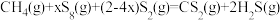 的
的 随温度T变化如图。
随温度T变化如图。
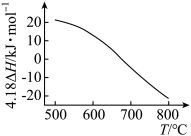
①

________  。
。
②为提高 平衡转化率,控制温度范围在
平衡转化率,控制温度范围在________ (填标号),理由是________ 。
A.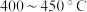 B.
B.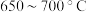 C.
C.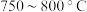 D.
D. 以上
以上
(2)合成 总反应中硫蒸气达到饱和时,反应时间t与
总反应中硫蒸气达到饱和时,反应时间t与 初始浓度
初始浓度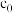 和
和 转化率
转化率 满足关系
满足关系 ,式中k为速率常数。
,式中k为速率常数。
① 、
、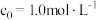 时,测得
时,测得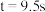 、
、 ,则
,则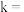
________ 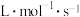 。
。
② 时,计划在
时,计划在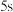 内转化率达
内转化率达 ,应控制初始浓度
,应控制初始浓度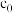 大于
大于________  。
。
(3)利用工业废气 替代硫磺矿生产
替代硫磺矿生产 的反应为
的反应为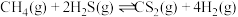 。反应物投料比采用
。反应物投料比采用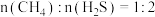 ,维持体系压强为
,维持体系压强为 ,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
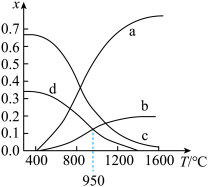
①图中表示 的曲线是
的曲线是________ (填“a”“b”“c”或“d”)。
② 时,该反应的
时,该反应的
________ (以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
③相比以硫磺矿为原料,使用 的优点是
的优点是________ ,缺点是________ 。
 在化工生产中有重要作用.天然气法合成
在化工生产中有重要作用.天然气法合成 相关反应如下:
相关反应如下:反应I
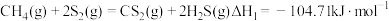
反应Ⅱ

(1)
 、
、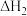 随温度变化不大。温度不同时,反应体系中
随温度变化不大。温度不同时,反应体系中 不同。合成
不同。合成 总反应
总反应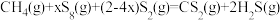 的
的 随温度T变化如图。
随温度T变化如图。
①


 。
。②为提高
 平衡转化率,控制温度范围在
平衡转化率,控制温度范围在A.
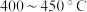 B.
B.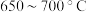 C.
C.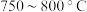 D.
D. 以上
以上(2)合成
 总反应中硫蒸气达到饱和时,反应时间t与
总反应中硫蒸气达到饱和时,反应时间t与 初始浓度
初始浓度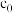 和
和 转化率
转化率 满足关系
满足关系 ,式中k为速率常数。
,式中k为速率常数。①
 、
、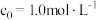 时,测得
时,测得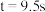 、
、 ,则
,则
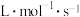 。
。②
 时,计划在
时,计划在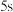 内转化率达
内转化率达 ,应控制初始浓度
,应控制初始浓度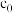 大于
大于 。
。(3)利用工业废气
 替代硫磺矿生产
替代硫磺矿生产 的反应为
的反应为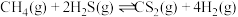 。反应物投料比采用
。反应物投料比采用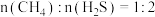 ,维持体系压强为
,维持体系压强为 ,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
①图中表示
 的曲线是
的曲线是②
 时,该反应的
时,该反应的
 总压
总压 物质的量分数)。
物质的量分数)。③相比以硫磺矿为原料,使用
 的优点是
的优点是
您最近半年使用:0次
2023-03-08更新
|
882次组卷
|
3卷引用:福建省厦门市2023届高三毕业班3月第二次质量检测化学试题
名校
解题方法
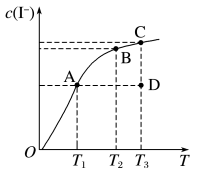
2 .  在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:
 。某
。某 、KI混合溶液中,
、KI混合溶液中, 的物质的量浓度
的物质的量浓度 与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
 在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:
 。某
。某 、KI混合溶液中,
、KI混合溶液中, 的物质的量浓度
的物质的量浓度 与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
A.该反应 |
B.若在 、 、 温度下,反应的平衡常数分别为 温度下,反应的平衡常数分别为 、 、 ,则 ,则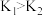 |
C.若反应进行到状态D时,一定有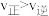 |
D.状态A与状态B相比,状态A的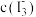 大 大 |
您最近半年使用:0次
2022-11-27更新
|
263次组卷
|
9卷引用:【全国百强校】福建省厦门市双十中学2018-2019学年高二下学期第一次月考化学试题
【全国百强校】福建省厦门市双十中学2018-2019学年高二下学期第一次月考化学试题【市级联考】山东省烟台市2019届高三上学期期末考试化学试题黑龙江省牡丹江市东宁市第一中学2020-2021学年高二上学期第一次月考化学试题河北省衡水市第十四中学2020-2021学年高二上学期三调考试(校内)化学试题黑龙江省实验中学2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市第二十四中学2022-2023学年高二10月月考化学试题四川省成都市树德中学2022-2023学年高二上学期11月阶段性测试化学试题吉林省延边第二中学2022-2023学年高二上学期期末考试化学试题新疆阿克苏市实验中学2022-2023学年高二上学期期末考试化学试题
名校
3 . 给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡: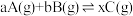 ,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量。T表示温度,P表示压强)。在图中,Y轴是指
,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量。T表示温度,P表示压强)。在图中,Y轴是指
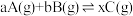 ,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量。T表示温度,P表示压强)。在图中,Y轴是指
,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量。T表示温度,P表示压强)。在图中,Y轴是指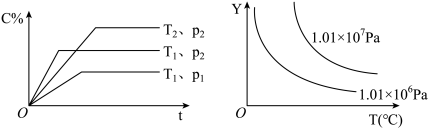
| A.反应物A的百分含量 | B.平衡混合气的总物质的量 | C.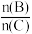 比值 比值 | D.反应物B的平衡转化率 |
您最近半年使用:0次
2022-09-13更新
|
673次组卷
|
4卷引用:福建省厦门第一中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
4 . 在I、II、III三个体积相等的恒容密闭容器中分别充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。在一定条件下能发生如下反应:CO(g)+2H2(g)⇌CH3OH(g),在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,下列说法正确的是
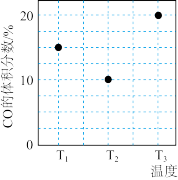

| A.反应CO(g)+2H2(g)═CH3OH(g)的△H>0 |
| B.若三个容器内的反应都达到化学平衡时,温度为T3时CO转化率最大 |
| C.I、II、III三个容器中一定达到化学平衡状态的是II和III |
| D.若再向容器III中充入0.1molCO、0.2molH2和0.4molCH3OH,则平衡时CH3OH的体积分数>40% |
您最近半年使用:0次
2021-12-15更新
|
249次组卷
|
2卷引用:福建省厦门第一中学2021-2022学年高二上学期12月月化学试题
名校
5 . 关于下列各图的叙述,正确的是
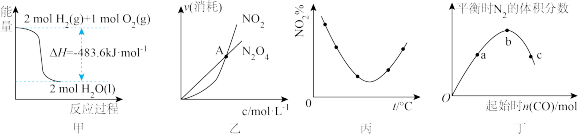
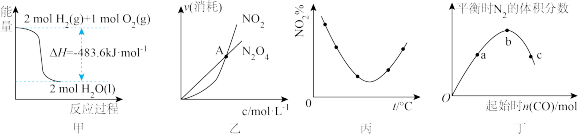
| A.甲表示H2与O2发生反应过程中的能量变化,则H2的摩尔燃烧焓为483.6 kJ·mol-1 |
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C.丙表示等量NO2在恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g)相同时间后测得NO2体积分数的曲线。则该反应的正反应ΔH<0 N2O4(g)相同时间后测得NO2体积分数的曲线。则该反应的正反应ΔH<0 |
D.丁表示反应4CO(g)+2NO2(g) N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c |
您最近半年使用:0次
名校
6 . 对于可逆反应2AB3(g)⇌A2(g) + 3B2(g) ΔH>0,各图像正确的是
A.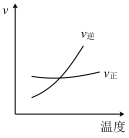 | B.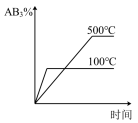 |
C.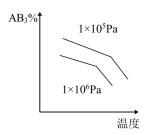 | D.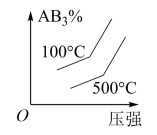 |
您最近半年使用:0次
2021-01-13更新
|
148次组卷
|
3卷引用:福建省厦门市湖滨中学2020-2021学年高二上学期期中考试化学(等级考)试题
福建省厦门市湖滨中学2020-2021学年高二上学期期中考试化学(等级考)试题黑龙江省哈尔滨市三中2021-2022学年高二上学期第一学段考试化学(理科)试题(已下线)专题2 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
7 . 一定温度下,向一容积为5L的恒容密闭容器中充入0.4 molSO2和0.2mol O2发生反应: 2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ/mol. 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) △H=-196 kJ/mol. 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是__________ (填字母)。
a. SO2、O2、SO3三者的浓度之比为2:1:2 b.发容器内气体的压强不再变化
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①有利于提高SO2的平衡转化率的措施有:______
a.使用催化剂 b.降低温度 c.及时分离出SO3
②其他条件不变时,减小压强(拉升容器使容积为原来的两倍),平衡将向逆反应方向移动,请利用K、Q 的关系说明理由:_________________ 。
(3)①SO2的平衡转化率为______________ 。
②此温度下该反应的平衡常数K=_____________ 。
(4)如图所示平衡时SO3的体积分数随压强和温度变化的曲线,则:
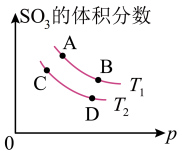
①温度关系:T1______ T2(填“>”“<”“=”,下同)
②平衡常数文关系:KA_____ KB,KA______ KD。
 2SO3(g) △H=-196 kJ/mol. 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) △H=-196 kJ/mol. 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(1)判断该反应达到平衡状态的标志是
a. SO2、O2、SO3三者的浓度之比为2:1:2 b.发容器内气体的压强不再变化
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①有利于提高SO2的平衡转化率的措施有:
a.使用催化剂 b.降低温度 c.及时分离出SO3
②其他条件不变时,减小压强(拉升容器使容积为原来的两倍),平衡将向逆反应方向移动,请利用K、Q 的关系说明理由:
(3)①SO2的平衡转化率为
②此温度下该反应的平衡常数K=
(4)如图所示平衡时SO3的体积分数随压强和温度变化的曲线,则:

①温度关系:T1
②平衡常数文关系:KA
您最近半年使用:0次
2020-11-13更新
|
243次组卷
|
2卷引用:福建省厦门市湖滨中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
8 . 对于mA(s)+nB(g)⇌eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
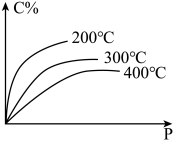

| A.化学方程式中n<e+f |
| B.达到平衡后,若升温,平衡逆向移动 |
| C.达到平衡后,加入催化剂,则C%增大 |
| D.达到平衡后,增加A的量,平衡正向移动 |
您最近半年使用:0次
2020-02-17更新
|
283次组卷
|
14卷引用:【全国百强校】福建省厦门市双十中学2018-2019学年高二下学期第一次月考化学试题
【全国百强校】福建省厦门市双十中学2018-2019学年高二下学期第一次月考化学试题(已下线)2010年福建省福州八中高二第二学期期末考试化学试题2015-2016学年河南省信阳高中高二上学期第一次月考化学试卷2015-2016学年辽宁省实验中学分校高一下学期6月月考化学试卷安徽省合肥市第九中学2018-2019学年高二上学期期中考试化学试题福建省霞浦第一中学2018-2019学年高二下学期第一次月考化学试题安徽省郎溪中学2018-2019学年高二下学期第一次月考化学试题2020届高三化学知识点强化训练—化学平衡的移动及影响因素广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题湖南省临澧县第一中学2020-2021学年高二上学期期中考试化学试题(选考)重庆市渝西中学2020-2021学年高二上学期第一次月考化学试题湖南省临澧县第一中学2020-2021学年高二下学期阶段性考试(二)化学试题上海市上海交通大学附属中学2022-2023学年高二上学期期中考试化学试题上海市延安中学2023-2024学年高二上学期期中考试(等级考)化学试题
名校
9 . 一定条件下合成乙烯: 。已知温度对
。已知温度对 的平衡转化率和催化剂催化效率的影响如下图。下列说法正确的是
的平衡转化率和催化剂催化效率的影响如下图。下列说法正确的是

 。已知温度对
。已知温度对 的平衡转化率和催化剂催化效率的影响如下图。下列说法正确的是
的平衡转化率和催化剂催化效率的影响如下图。下列说法正确的是
A.M点的正反应速率 大于N点的逆反应速率v逆 大于N点的逆反应速率v逆 |
B.若投料比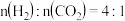 ,则图中M点乙烯的体积分数为 ,则图中M点乙烯的体积分数为 |
C.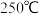 ,催化剂对 ,催化剂对 平衡转化率的影响最大 平衡转化率的影响最大 |
D.当温度高于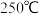 ,升高温度,平衡逆向移动导致催化剂的催化效率降低 ,升高温度,平衡逆向移动导致催化剂的催化效率降低 |
您最近半年使用:0次
2020-02-06更新
|
533次组卷
|
18卷引用:福建省厦门市2018届高三上学期期末质检化学试题
福建省厦门市2018届高三上学期期末质检化学试题辽宁省大石桥2018届高三上学期期末质检化学试题陕西省西安中学2019-2020学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——化学反应速率综合专练四川省攀枝花市第十五中学2019-2020学年高二上学期第二次月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时4 化学平衡图象甘肃省兰州市第一中学2020-2021学年高二上学期期中考试化学(理)试题黑龙江省哈尔滨工业大学附属中学2020-2021学年度高二下学期期末考试化学试题吉林省白城市第一中学2021-2022学年高二上学期9月阶段考试化学试题山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题浙江省宁波市咸祥中学2021-2022学年高二上学期期中考试化学试题安徽省宣城中学2021-2022学年高二下学期开学考试化学试题(已下线)第七章 化学反应速率与化学平衡 第45练 实际工业生产中图像问题分类突破江苏省徐州市2022-2023学年高二下学期4月期中考试化学试题湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题内蒙古赤峰二中2023-2024学年高二上学期10月月考化学试题河南省焦作市第十一中学2023-2024学年高二上学期9月份月考 化学试卷
11-12高二上·吉林长春·阶段练习
名校
10 . 密闭容器中有如下反应:L(s)+aG(g)  bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )

 bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
| A.正反应为放热反应 |
| B.G的转化率随温度升高而减小 |
| C.化学方程式中的计量数a>b |
| D.增大压强,容器内气体质量不变 |
您最近半年使用:0次
2019-09-02更新
|
727次组卷
|
11卷引用:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
(已下线)2012届福建省厦门外国语学校高三上学期10月份月考化学试卷(已下线)2011-2012年吉林省长春外国语学校高二上学期第一次月考化学试卷(已下线)2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年福建省福州文博中学高二下学期期中考试化学试卷(已下线)2012-2013学年安徽省舒城晓天中学高二上学期第一次月考化学试卷2016届湖北省襄阳市保康县第一中学高三上学期期中测试化学试卷黑龙江省大庆铁人中学2019-2020学年高二上学期入学考试化学试题天津市静海区大邱庄中学等四校2019-2020学年高二10联考化学试题河南省三门峡市第一高级中学2020-2021学年高二上学期9月月考化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题广东省广州市第十七中学2022-2023学年高二上学期期中考试化学试题



