1 . 已知25 ℃时,测得浓度为0.1 mol·L-1的碱BOH的溶液中,c(OH-)=1×10-3 mol·L-1。
(1)写出BOH的电离方程式___________ 。
(2)BOH的电离平衡常数K=___________ 。
(3)某温度t ℃时,BOH的电离平衡常数为1×10-7,结合(2)的计算可知t ℃___________ (填“>”“<”或“=”)25 ℃。若该碱的起始浓度也为0.1 mol·L-1,则溶液中c(B+)=___________ mol·L-1。
(1)写出BOH的电离方程式
(2)BOH的电离平衡常数K=
(3)某温度t ℃时,BOH的电离平衡常数为1×10-7,结合(2)的计算可知t ℃
您最近一年使用:0次
2 . 完成下列问题。
(1)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1,若忽略水的电离及H2CO3的第二级电离,则H2CO3
 +H+的平衡常数K1=
+H+的平衡常数K1=___________ 。(已知:10-5.60=2.5×10-6)
(2)用K2CO3溶液吸收H2S,其原理为 +H2S=HS-+
+H2S=HS-+ 。该反应的平衡常数K=
。该反应的平衡常数K=_______ 。(已知H2CO3的 =4.2×10-7,
=4.2×10-7, =5.6×10-11;H2S的
=5.6×10-11;H2S的 =5.6×10-8,
=5.6×10-8, =1.2×10-15)
=1.2×10-15)
(1)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1,若忽略水的电离及H2CO3的第二级电离,则H2CO3

 +H+的平衡常数K1=
+H+的平衡常数K1=(2)用K2CO3溶液吸收H2S,其原理为
 +H2S=HS-+
+H2S=HS-+ 。该反应的平衡常数K=
。该反应的平衡常数K= =4.2×10-7,
=4.2×10-7, =5.6×10-11;H2S的
=5.6×10-11;H2S的 =5.6×10-8,
=5.6×10-8, =1.2×10-15)
=1.2×10-15)
您最近一年使用:0次
3 . 25 ℃时,0.10 mol·L-1HA溶液中有1%的HA电离,则HA的电离平衡常数Ka为___________ 。
您最近一年使用:0次
4 . 在一定温度下,对冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答下列问题:
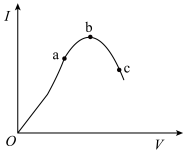
(1)a、b、c三点对应的溶液中,c(H+)由小到大的顺序为___________ 。
(2)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是___________ 。
(3)若使c点对应的溶液中的c(CH3COO-)增大,则下列措施中,可行的是___________ (填字母,下同)。
A.加热 B.加入NaOH稀溶液 C.加入K2CO3固体
D.加水 E.加入CH3COONa固体 F.加入锌粒
(4)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是___________。

(1)a、b、c三点对应的溶液中,c(H+)由小到大的顺序为
(2)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是
(3)若使c点对应的溶液中的c(CH3COO-)增大,则下列措施中,可行的是
A.加热 B.加入NaOH稀溶液 C.加入K2CO3固体
D.加水 E.加入CH3COONa固体 F.加入锌粒
(4)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是___________。
| A.c(H+) | B.n(H+) | C.CH3COOH分子数 | D. |
您最近一年使用:0次
2023-08-14更新
|
975次组卷
|
2卷引用:作业(十二) 弱电解质的电离平衡
22-23高二·全国·课时练习
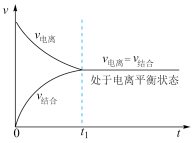
5 . 一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率与离子重新结合成弱电解质分子的速率_______ ,溶液中各分子和离子的浓度都不再发生变化时,电离过程就达到了平衡状态,如下图所示。

您最近一年使用:0次
22-23高二·全国·课时练习
6 . 已知H2CO3、H2S的电离常数如表,判断下列反应能否发生,若能,写出离子方程式。
(1)往Na2S溶液中加入少量NaHCO3溶液:_______ 。
(2)往Na2CO3溶液中加入少量NaHS溶液:_______ 。
(3)往Na2S溶液中通入少量CO2:_______ 。
(4)往Na2S溶液中通入过量CO2:_______ 。
(5)往Na2CO3溶液中通入少量H2S:_______ 。
(6)往Na2CO3溶液中通入过量H2S:_______ 。
| H2CO3 | H2S |
| K1=4.3×10-7,K2=5.6×10-11 | K1=9.1×10-8,K2=1.1×10-12 |
(2)往Na2CO3溶液中加入少量NaHS溶液:
(3)往Na2S溶液中通入少量CO2:
(4)往Na2S溶液中通入过量CO2:
(5)往Na2CO3溶液中通入少量H2S:
(6)往Na2CO3溶液中通入过量H2S:
您最近一年使用:0次
22-23高二·全国·课时练习
7 . 电离平衡常数的影响因素
(1)内因:弱电解质本身的性质。
(2)外因:电离平衡常数只跟温度有关,温度_______ ,电离平衡常数_______ 。
(1)内因:弱电解质本身的性质。
(2)外因:电离平衡常数只跟温度有关,温度
您最近一年使用:0次
22-23高二·全国·课时练习
8 . 电离平衡常数意义
电离平衡常数表示弱电解质的电离能力。一定温度下,K值_______ ,弱电解质的电离程度_______ ,酸性(或碱性)_______ 。
电离平衡常数表示弱电解质的电离能力。一定温度下,K值
您最近一年使用:0次
22-23高二·全国·课时练习
9 . 电离平衡的影响因素
(1)温度:弱电解质的电离一般是吸热过程,升高温度,电离平衡_______ ,电离程度_______
(2)浓度:
①稀释电解质溶液,电离平衡_______ ,电离程度_______ 。
②加入同一电解质,电离平衡_______ ,电离程度_______ 。
(3)外加电解质:
①同离子效应:加入与弱电解质具有相同离子的电解质,电离平衡_______ ,电离程度_______ 。
②化学反应:加入能与弱电解质电离出的离子发生反应的离子时,电离平衡_______ ,电离程度_______ 。
(1)温度:弱电解质的电离一般是吸热过程,升高温度,电离平衡
(2)浓度:
①稀释电解质溶液,电离平衡
②加入同一电解质,电离平衡
(3)外加电解质:
①同离子效应:加入与弱电解质具有相同离子的电解质,电离平衡
②化学反应:加入能与弱电解质电离出的离子发生反应的离子时,电离平衡
您最近一年使用:0次
22-23高二上·全国·课时练习
解题方法
10 . A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是________ ,E是________ ;
(2)用水稀释0.1 mol·L-1B溶液时,溶液中随着水量的增加而减小的是________ (填写序号)。
a. b.
b. c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是________ (填写序号)。
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
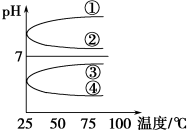
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中___ 曲线(填写序号)。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为____________________ 。
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是
(2)用水稀释0.1 mol·L-1B溶液时,溶液中随着水量的增加而减小的是
a.
 b.
b. c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中

(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
您最近一年使用:0次



