名校
1 . 下列图示与对应的叙述相符的是
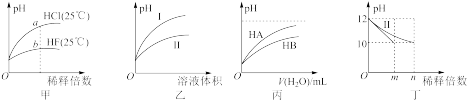

| A.由图甲可知,a点Kw的数值比b点Kw的数值大 |
| B.图乙表示用水稀释pH相同的盐酸和醋酸,I表示醋酸,II表示盐酸 |
| C.图丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度时NaA溶液的pH小于同浓度的NaB溶液的pH |
| D.图丁表示分别稀释10mLpH均为12的NaOH溶液和氨水时pH的变化,曲线I表示氨水,n>100 |
您最近一年使用:0次
2021-09-16更新
|
559次组卷
|
8卷引用:3.3.1 盐类水解的原理-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
(已下线)3.3.1 盐类水解的原理-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)河北正定中学2020-2021学年高二上学期第一次半月考化学试题(已下线)必考点07 盐类的水解-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)黑龙江省双鸭山市第一中学2021-2022学年高二上学期期中考试化学试题山东省淄博市高青县第一中学2021-2022学年高二上学期期中考试化学试题江西省吉安市遂川中学2021-2022学年高二上学期第三次月考(B)化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期5月月考化学试题
名校
解题方法
2 . 常温下,Ka(HCOOH)=1.8×10-4,Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5,下列说法正确的是
| A.浓度均为0.1mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者 |
| B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 |
| C.0.2mol·L-1HCOOH与0.1mol·L-1NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(H+)+c(HCOOH) |
| D.0.2mol·L-1CH3COONa与0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
您最近一年使用:0次
名校
3 . 下列叙述正确的是
| A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 |
| C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
D.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 减小 |
您最近一年使用:0次
名校
4 . 下列因素能影响水的电离平衡,且能使水的电离平衡向右移动的是
| A.CH3COOH | B. | C.升高温度 | D.NaHSO4 |
您最近一年使用:0次
2021-09-15更新
|
398次组卷
|
4卷引用:3.2.1 水的电离 溶液的酸碱性(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.2.1 水的电离 溶液的酸碱性(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)3.2.1 水的电离和溶液的酸碱性-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)河北饶阳中学2021-2022学年高二上学期第一阶段考试化学试题河北正定中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
5 . 室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
| A.向0.10mol·L-1CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
B.向0.10mol·L-1NH4HCO3溶液中通CO2:c( )=c( )=c( )+c( )+c( ) ) |
C.向0.10mol·L-1NaHSO3溶液中通NH3:c(Na+)>c( )>c( )>c( ) ) |
D.向0.10mol·L-1Na2SO3溶液中通SO2:c(Na+)=2[c( )+c( )+c( )+c(H2SO3)] )+c(H2SO3)] |
您最近一年使用:0次
2021-09-15更新
|
1496次组卷
|
4卷引用:3.3.4 溶液中粒子浓度的关系(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.3.4 溶液中粒子浓度的关系(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河北正定中学2020-2021学年高二上学期第二次月考化学试题(已下线)专题20 用守恒思想破解溶液中粒子浓度大小的比较-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)湖南省湘潭凤凰中学2022-2023学年高二上学期10月月考化学试题
名校
6 . H2S水溶液中存在电离平衡H2S⇌H++HS-和HS-⇌H++S2-。对H2S溶液进行如下操作,有关描述正确的是
| A.加水,平衡向右移动,溶液中氢离子浓度增大 |
| B.滴加NaOH溶液,平衡向左移动,溶液pH值增大 |
| C.滴加新制氯水,平衡向左移动,溶液pH值减小 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 |
您最近一年使用:0次
2021-09-15更新
|
649次组卷
|
6卷引用:3.1.2 弱电解质的电离平衡-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
(已下线)3.1.2 弱电解质的电离平衡-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)河北正定中学2020-2021学年高二上学期第二次月考化学试题(已下线)必考点05 电离平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)必考点04 弱电解质的电离-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版) 吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题湖南省宁远县第一中学2022-2023学年高二上学期第一次适应性考试化学试题
名校
7 . 下列关于常温下,体积均为10mL,pH均为4的HCl溶液a和CH3COOH溶液b的有关说法不正确的是
| A.对水的电离的抑制程度相同 |
| B.稀释至相同pH后,Va<Vb |
| C.溶液体积均扩大为原来的105倍,则pHa≈ pHb≈ 7 |
| D.两溶液分别与足量Zn反应,HCl溶液中放出的H2又快又多 |
您最近一年使用:0次
2021-09-15更新
|
1817次组卷
|
14卷引用:3.2.2 溶液的pH(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.2.2 溶液的pH(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)3.2.2 酸碱中和滴定和pH的计算-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)河北省大名县第一中学2021-2022学年高二上学期10月半月考化学试题黑龙江省齐齐哈尔市第八中学2021-2022学年高二上学期期中考试化学试题(已下线)水溶液中的离子反应与平衡——课时3水的电离与溶液的酸碱性河北正定中学2020-2021学年高二上学期第三次月考化学试题江西省抚州市2021-2022学年高二上学期期末学生学业质量监测化学试题(已下线)第17讲 溶液的酸碱性与pH的计算-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题新疆阿克苏市实验中学2022-2023学年高二上学期第二次月考(12月)化学试题 四川省内江市第六中学2022-2023学年高二下学期第一次月考化学试题安徽省滁州市实验中学等2校2022-2023学年高二上学期1月期末考试化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期1月期末化学试题
名校
8 . 下列关于常温下的电解质溶液的说法正确的是
| A.除了水的电离平衡外,盐酸中不存在其他电离平衡 |
| B.向0.1 mol·L-1 CH3COOH溶液加水稀释时会引起溶液中c(OH-)减小 |
C.碳酸的电离方程式为:H2CO3⇌2H+ +CO |
| D.电离平衡右移,弱电解质的电离程度一定增大 |
您最近一年使用:0次
2021-09-15更新
|
562次组卷
|
4卷引用:3.2.1 水的电离 溶液的酸碱性(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.2.1 水的电离 溶液的酸碱性(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)3.2.1 水的电离和溶液的酸碱性-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)必考点06 水的电离和溶液pH-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)河北正定中学2020-2021学年高二上学期第三次月考化学试题
名校
9 . 某浓度的二元弱酸H2B溶液在不同pH下,测得Pc(M)变化如图所示,(已知: Pc(M)=-1gc(M),M代指H2B或HB-或B2-),下列说法正确的是


| A.曲线II表示Pc(HB-)与pH关系 |
| B.pH=5时,c(HB- )<c(B2- )<c(H2B) |
C.由图像数据可以计算出 的值 的值 |
| D.在pH增大的过程中,c(H2B)、c(HB-)、 c(B2-)三者浓度和先减小后增大 |
您最近一年使用:0次
2021-09-13更新
|
2459次组卷
|
9卷引用:章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)
(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)四川省巴中市2022届高三零诊理科综合化学试题河北饶阳中学2021-2022学年高二上学期第一阶段考试化学试题(已下线)2021年高考全国乙卷化学试题变式题(已下线)备战2022年高考化学精准检测卷【全国卷】03江西省吉安市安福二中、吉安县三中、井大附中三校2021-2022学年高二上学期12月联考化学试题辽宁省大连市第八中学2021-2022学年高二上学期10月月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第51讲 反应过程溶液粒子浓度变化的图像分析(已下线)微专题 水溶液中函数图像的分析
10 . 请回答下列问题:
Ⅰ.已知水的电离平衡曲线如图示,试回答下列问题:

(1)在100℃时,Kw表达式为___________ ,在此温度下,Kw为___________ 。
(2)在室温下,将pH=12的Ba(OH)2溶液与pH=2的稀盐酸混合,欲使混合溶液pH=3,忽略两溶液混合时的体积变化,则Ba(OH)2与盐酸的体积比为___________ 。
(3)室温时将pH为4的硫酸溶液稀释10000倍,稀释后溶液中,c(SO )和c(H+)之比约为
)和c(H+)之比约为___________ 。
Ⅱ.今有①CH3COOH②HCl③H2SO4三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式___________ 。
(5)当它们pH相同时,其物质的量浓度由大到小的顺序为___________ (填序号)。
(6)当它们的物质的量浓度相同时,其溶液中水电离出的c(OH-)由大到小的顺序为___________ (填序号)。
(7)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___________ (填序号)。
Ⅰ.已知水的电离平衡曲线如图示,试回答下列问题:

(1)在100℃时,Kw表达式为
(2)在室温下,将pH=12的Ba(OH)2溶液与pH=2的稀盐酸混合,欲使混合溶液pH=3,忽略两溶液混合时的体积变化,则Ba(OH)2与盐酸的体积比为
(3)室温时将pH为4的硫酸溶液稀释10000倍,稀释后溶液中,c(SO
 )和c(H+)之比约为
)和c(H+)之比约为Ⅱ.今有①CH3COOH②HCl③H2SO4三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式
(5)当它们pH相同时,其物质的量浓度由大到小的顺序为
(6)当它们的物质的量浓度相同时,其溶液中水电离出的c(OH-)由大到小的顺序为
(7)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为
您最近一年使用:0次



