名校
解题方法
1 . 某小组同学以AgCl和AgI为例探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
实验Ⅰ:
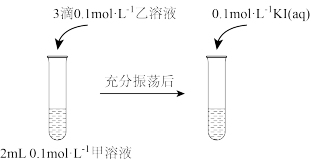
实验Ⅱ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数: )。
)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
请回答下列问题:
(1)实验Ⅰ证明了AgCl转化为AgI,甲溶液可以是_______ (填标号)。
a. 溶液 b.NaCl溶液 c.KI溶液
溶液 b.NaCl溶液 c.KI溶液
(2)实验Ⅰ沉淀转化反应的离子方程式是_______ 。AgCl和AgI共存的悬浊液中,
_______ (保留一位小数)。[已知: ,
,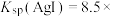
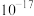 ]
]
(3)实验Ⅱ的步骤ⅰ中,B中石墨上的电极反应是_______ 。
(4)结合信息解释实验Ⅱ中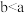 的原因:
的原因:_______ 。
(5)实验Ⅱ的现象能说明AgI转化为AgCl,理由是_______ 。
| 物质 | AgI | AgCl |
| 溶解度/g(20℃) |  | 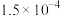 |

实验Ⅱ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:
 )。
)。| 装置 | 步骤 | 电压表读数 |
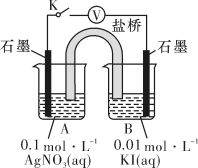 | ⅰ.按图连接装置并加入试剂,闭合K | a |
ⅱ.向B中滴入 (aq),至沉淀完全 (aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| ⅳ.重复ⅰ,再向B中加入与ⅲ等量的NaCl(s) | a |
请回答下列问题:
(1)实验Ⅰ证明了AgCl转化为AgI,甲溶液可以是
a.
 溶液 b.NaCl溶液 c.KI溶液
溶液 b.NaCl溶液 c.KI溶液(2)实验Ⅰ沉淀转化反应的离子方程式是

 ,
,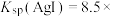
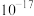 ]
](3)实验Ⅱ的步骤ⅰ中,B中石墨上的电极反应是
(4)结合信息解释实验Ⅱ中
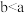 的原因:
的原因:(5)实验Ⅱ的现象能说明AgI转化为AgCl,理由是
您最近一年使用:0次
2 . 下列实验操作、对应的现象及结论均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | 酸性:苯酚>碳酸 |
| B |  溶液中加入少量 溶液中加入少量 溶液,有砖红色沉淀( 溶液,有砖红色沉淀( )生成 )生成 | 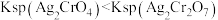 |
| C | 将镁片和铝片用导线连接后插入NaOH溶液中,镁片表面产生气泡 | 该装置构成了原电池,铝片做负极 |
| D | 向某溶液中加入稀NaOH溶液,用湿润的红色石蕊试纸检验,无明显现象 | 溶液中一定无 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 一种从钛白酸性废水(主要含 、
、 ,还含微量
,还含微量 )中富集钪并制备钪的工艺流程如图。
)中富集钪并制备钪的工艺流程如图。
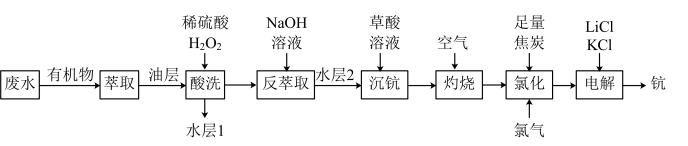
已知:i.钪元素主要化合价为+3价。
ii. 衰变:放出电子的衰变过程,
衰变:放出电子的衰变过程,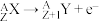 。
。
ii.分配比D是指在溶剂萃取过程中,当萃取体系达到平衡后,被萃物在有机相的总浓度和在水相的总浓度之比。
iv. 为砖红色固体;
为砖红色固体;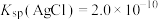 ,
, 。
。
(1)钪的一种核素可作示踪原子用于对恶性肿瘤放射治疗,该种核素的中子数为25,该核素的符号为_________ 。该核素可发生 衰变和
衰变和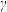 衰变,请书写出
衰变,请书写出 衰变方程式
衰变方程式_________ 。
(2)当pH=5时 易发生水解,此时用环烷酸(HA)萃取,原理为:
易发生水解,此时用环烷酸(HA)萃取,原理为: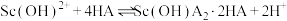 ,平衡常数
,平衡常数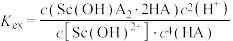 。当分配比D>10时,钪的萃取回收率高,不需要二次萃取。已知平衡常数
。当分配比D>10时,钪的萃取回收率高,不需要二次萃取。已知平衡常数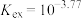 ,当第一次萃取后萃余液的pH=5,
,当第一次萃取后萃余液的pH=5,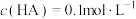 ,请计算是否还需要二次萃取?
,请计算是否还需要二次萃取?_________ (请书写出计算过程)。
(3)流程中从“萃取”到“反萃取"过程的目的是_________ 。
(4)请书写出“氯化”工艺的化学方程式_________ 。
(5)流程中不采用“灼烧”后,而采用“氯化”后电解的原因是_________ 。
(6)现取制得的 粗产品(只含难溶
粗产品(只含难溶 杂质)溶于水,配成溶液,采用
杂质)溶于水,配成溶液,采用 为指示剂,用
为指示剂,用 标准溶液滴定,描述达到滴定终点时现象
标准溶液滴定,描述达到滴定终点时现象_________ ,溶液中 沉淀完全[此时
沉淀完全[此时 为
为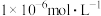 ],则此时溶液中
],则此时溶液中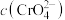 的浓度为
的浓度为_________  。
。
 、
、 ,还含微量
,还含微量 )中富集钪并制备钪的工艺流程如图。
)中富集钪并制备钪的工艺流程如图。
已知:i.钪元素主要化合价为+3价。
ii.
 衰变:放出电子的衰变过程,
衰变:放出电子的衰变过程,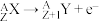 。
。ii.分配比D是指在溶剂萃取过程中,当萃取体系达到平衡后,被萃物在有机相的总浓度和在水相的总浓度之比。
iv.
 为砖红色固体;
为砖红色固体;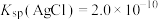 ,
, 。
。(1)钪的一种核素可作示踪原子用于对恶性肿瘤放射治疗,该种核素的中子数为25,该核素的符号为
 衰变和
衰变和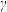 衰变,请书写出
衰变,请书写出 衰变方程式
衰变方程式(2)当pH=5时
 易发生水解,此时用环烷酸(HA)萃取,原理为:
易发生水解,此时用环烷酸(HA)萃取,原理为: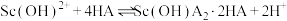 ,平衡常数
,平衡常数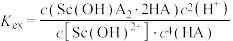 。当分配比D>10时,钪的萃取回收率高,不需要二次萃取。已知平衡常数
。当分配比D>10时,钪的萃取回收率高,不需要二次萃取。已知平衡常数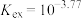 ,当第一次萃取后萃余液的pH=5,
,当第一次萃取后萃余液的pH=5,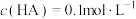 ,请计算是否还需要二次萃取?
,请计算是否还需要二次萃取?(3)流程中从“萃取”到“反萃取"过程的目的是
(4)请书写出“氯化”工艺的化学方程式
(5)流程中不采用“灼烧”后,而采用“氯化”后电解的原因是
(6)现取制得的
 粗产品(只含难溶
粗产品(只含难溶 杂质)溶于水,配成溶液,采用
杂质)溶于水,配成溶液,采用 为指示剂,用
为指示剂,用 标准溶液滴定,描述达到滴定终点时现象
标准溶液滴定,描述达到滴定终点时现象 沉淀完全[此时
沉淀完全[此时 为
为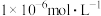 ],则此时溶液中
],则此时溶液中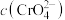 的浓度为
的浓度为 。
。
您最近一年使用:0次
2022-11-12更新
|
412次组卷
|
2卷引用:湖南省长沙市宁乡市第一高级中学2022-2023学年高三上学期11月质量检测化学试题
解题方法
4 . 软锰矿是一种常见的锰矿物,主要成分是MnO2,常含有铁、铝元素形成的杂质。工业上,用软锰矿制取高锰酸钾的流程如下(部分条件和产物省略):
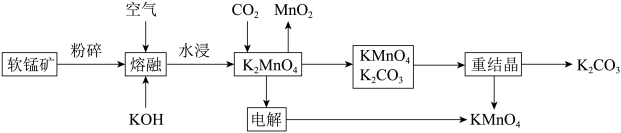
请回答下列问题:
(1)Mn的价层电子排布式为_______ ;杂质中的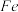 元素在元素周期表中的位置为
元素在元素周期表中的位置为_______ 。
(2)CO2与K2MnO4反应的离子方程式为_______ 。
(3)KMnO4与K2CO3能用重结晶(冷却结晶)的方法分离的原理是_______ 。
(4)“电解”过程中使用的是惰性电极,则:
①阴极附近溶液的pH将_______ (填“增大”“减小”或“不变”)。
②工业上可用石墨为电极电解硫酸锰和硫酸的混合溶液制备MnO2,其阳极的电极反应式为_______ 。
(5)可用过氧化氢溶液滴定的方法测定高锰酸钾样品纯度。当达到滴定终点时,溶液中产生的现象为_______ 。
(6)常温下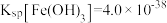 ,
, 。常温下,若某溶液中,
。常温下,若某溶液中, ,
, ,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=
,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=_______ mol/L。

请回答下列问题:
(1)Mn的价层电子排布式为
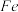 元素在元素周期表中的位置为
元素在元素周期表中的位置为(2)CO2与K2MnO4反应的离子方程式为
(3)KMnO4与K2CO3能用重结晶(冷却结晶)的方法分离的原理是
(4)“电解”过程中使用的是惰性电极,则:
①阴极附近溶液的pH将
②工业上可用石墨为电极电解硫酸锰和硫酸的混合溶液制备MnO2,其阳极的电极反应式为
(5)可用过氧化氢溶液滴定的方法测定高锰酸钾样品纯度。当达到滴定终点时,溶液中产生的现象为
(6)常温下
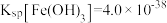 ,
, 。常温下,若某溶液中,
。常温下,若某溶液中, ,
, ,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=
,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=
您最近一年使用:0次
名校
解题方法
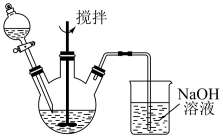
5 . 为了探究 溶液与
溶液与 溶液的反应产物,某化学兴趣小组利用如图装置进行如下实验:
溶液的反应产物,某化学兴趣小组利用如图装置进行如下实验:
Ⅰ.向盛有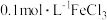 溶液的三颈瓶中,滴加一定量
溶液的三颈瓶中,滴加一定量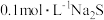 溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有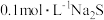 溶液的三颈瓶中,滴加少量
溶液的三颈瓶中,滴加少量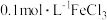 溶液,搅拌,产生沉淀B。
溶液,搅拌,产生沉淀B。
已知:① 为黑色固体,且不溶于水和盐酸。
为黑色固体,且不溶于水和盐酸。
②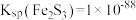 ,
, ,
,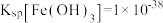 ,
, 。
。
③硫不溶于水,微溶于酒精,易溶于二硫化碳。
回答下列问题:
(1)装置中NaOH溶液的作用是___________ 。
小组同学猜测,沉淀A、B可能为S、硫化物或它们的混合物。他们设计如下实验进行探究:
实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:
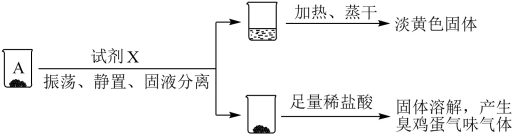
(2)试剂X是___________ 。由此推断A的成分是___________ (填化学式)。
实验二、探究B的成分
取沉淀B于小烧杯中,进行如下实验:

(3)向试管a中加入试剂Y,观察到明显现象,证明溶液中存在 。试剂Y是NaOH溶液,明显现象是
。试剂Y是NaOH溶液,明显现象是___________ 。由此推断B的成分是___________ (填化学式)。
(4)请分析Ⅱ中实验未得到 的原因是
的原因是___________ 。
 溶液与
溶液与 溶液的反应产物,某化学兴趣小组利用如图装置进行如下实验:
溶液的反应产物,某化学兴趣小组利用如图装置进行如下实验:Ⅰ.向盛有
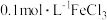 溶液的三颈瓶中,滴加一定量
溶液的三颈瓶中,滴加一定量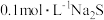 溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有
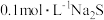 溶液的三颈瓶中,滴加少量
溶液的三颈瓶中,滴加少量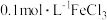 溶液,搅拌,产生沉淀B。
溶液,搅拌,产生沉淀B。已知:①
 为黑色固体,且不溶于水和盐酸。
为黑色固体,且不溶于水和盐酸。②
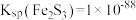 ,
, ,
,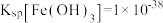 ,
, 。
。③硫不溶于水,微溶于酒精,易溶于二硫化碳。
回答下列问题:
(1)装置中NaOH溶液的作用是
小组同学猜测,沉淀A、B可能为S、硫化物或它们的混合物。他们设计如下实验进行探究:
实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:

(2)试剂X是
实验二、探究B的成分
取沉淀B于小烧杯中,进行如下实验:

(3)向试管a中加入试剂Y,观察到明显现象,证明溶液中存在
 。试剂Y是NaOH溶液,明显现象是
。试剂Y是NaOH溶液,明显现象是(4)请分析Ⅱ中实验未得到
 的原因是
的原因是
您最近一年使用:0次
2021-11-20更新
|
475次组卷
|
9卷引用:湖南省长沙市雅礼中学2021-2022学年高三上学期月考卷(三)化学试题
湖南省长沙市雅礼中学2021-2022学年高三上学期月考卷(三)化学试题山东省潍坊市2020届高三上学期期末考试化学试题(已下线)考点21 物质制备型综合实验-2020年高考化学命题预测与模拟试题分类精编山东省东营第一中学2020届高三上学期期末考试化学试题广东省省名校联盟2021届高三下学期开学考试(新高考)化学试题(已下线)小题26 探究性实验——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)2021年高考化学押题预测卷(福建卷)(03)(含考试版、答题卡、参考答案、全解全析)(已下线)第十单元 化学实验基础(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)江西省丰城中学2021-2022学年上学期高三创新实验班第四次月考化学试题
名校
解题方法
6 . 从印刷电路板的腐蚀废液(主要含CuCl2、FeCl3、FeCl2等)中回收FeCl3、制备CuSO4·5H2O的流程如下。_______ 。
(2)粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
①相对于Cu2+,粗液中 浓度过小,原因是
浓度过小,原因是_______ (用离子方程式表示),不能得到硝酸铜晶体。
②粗液中 浓度较大,但由于
浓度较大,但由于_______ ,不能得到硝酸铜晶体。
(3)测量粗品 中铁(含
中铁(含 、
、 )的含量,评定纯度等级。
)的含量,评定纯度等级。
Ⅰ.用水溶解一定质量粗品,加入稀 和
和 溶液,加热。
溶液,加热。
Ⅱ.待溶液冷却后,加入试剂X至溶液 。过滤、洗涤,得到红褐色沉淀。
。过滤、洗涤,得到红褐色沉淀。
Ⅲ.用稀 溶解红褐色沉淀,滴入
溶解红褐色沉淀,滴入 溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
已知: 完全沉淀的pH为6.7,
完全沉淀的pH为6.7, 完全沉淀的pH为2.8
完全沉淀的pH为2.8
①Ⅰ中将 氧化为
氧化为 的离子方程式是
的离子方程式是_______ 。
②试剂X是_______ 。
(4)电解:在不同电压、不同pH(pH<7)条件下电解 溶液,研究
溶液,研究 溶液的再生条件。
溶液的再生条件。
( ,
, )
)
①iii中产生 的原因有
的原因有 、
、_______ 。
② 溶液再生的合适条件是
溶液再生的合适条件是_______ (填实验序号)。
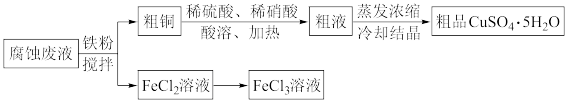
(2)粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
①相对于Cu2+,粗液中
 浓度过小,原因是
浓度过小,原因是②粗液中
 浓度较大,但由于
浓度较大,但由于(3)测量粗品
 中铁(含
中铁(含 、
、 )的含量,评定纯度等级。
)的含量,评定纯度等级。Ⅰ.用水溶解一定质量粗品,加入稀
 和
和 溶液,加热。
溶液,加热。Ⅱ.待溶液冷却后,加入试剂X至溶液
 。过滤、洗涤,得到红褐色沉淀。
。过滤、洗涤,得到红褐色沉淀。Ⅲ.用稀
 溶解红褐色沉淀,滴入
溶解红褐色沉淀,滴入 溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。已知:
 完全沉淀的pH为6.7,
完全沉淀的pH为6.7, 完全沉淀的pH为2.8
完全沉淀的pH为2.8①Ⅰ中将
 氧化为
氧化为 的离子方程式是
的离子方程式是②试剂X是
(4)电解:在不同电压、不同pH(pH<7)条件下电解
 溶液,研究
溶液,研究 溶液的再生条件。
溶液的再生条件。| 序号 | 电压 |  | 阴极现象 | 阳极产物 |
| i |  | a | 无气泡,少量金属析出 | 无 ,有 ,有 |
| ii |  | b | 较多气泡,极少量金属析出 | 无 ,有 ,有 |
| iii |  | a | 少量气泡,少量金属析出, | 有 ,有 ,有 |
 ,
, )
)①iii中产生
 的原因有
的原因有 、
、②
 溶液再生的合适条件是
溶液再生的合适条件是
您最近一年使用:0次
2022-04-01更新
|
523次组卷
|
5卷引用:湖南省邵阳市新宁县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省邵阳市新宁县第一中学2021-2022学年高三下学期期中考试化学试题北京市朝阳区2022届高三一模化学试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)福建省福州高级中学2023-2024学年高三第二次阶段考试化学试题北京市广渠门中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
7 . 稀土元素钪(Sc)广泛应用于航空航天、超导、激光、核能等领域,从钛白水解工业废酸(含Sc3+、TiO2+、Mn2+、H+、SO 等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
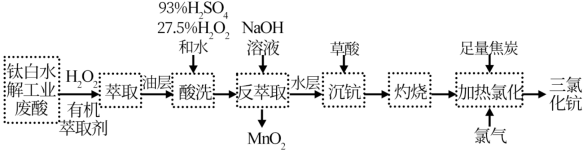
已知:Ag2CrO4为砖红色固体;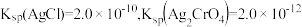 。
。
请回答下列问题:
(1)在钛白水解工业废酸中,加入 是为了使
是为了使 转化为难萃取的
转化为难萃取的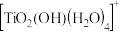 。
。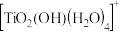 中Ti的化合价为+4,其中-1 价氧和-2 价氧的物质的量之比
中Ti的化合价为+4,其中-1 价氧和-2 价氧的物质的量之比___________ 。
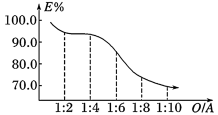
(2)钪的萃取率(E%)与 O/A 值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择最合适的 O/A 值为___________ 。
(3)温度对钪、钛的萃取率影响情况见下表,合适的萃取温度为10~15℃,其理由是___________ 。
(4)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式___________ 。
(5)实验室模拟流程中 “灼烧”得到 Sc2O3,用来盛放被灼烧物的仪器为___________ ,写出由Sc2O3制备三氯化钪反应的化学方程式___________ 。
(6)取 ScCl3粗产品(含难溶 Sc2O3杂质)溶于水,配成溶液,采用K2CrO4为指示剂,用 AgNO3标准溶液滴定,当溶液中出现的现象为___________ 时,说明已经达到滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,此时溶液中 的浓度等于
的浓度等于___________ mol·L-1。
 等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
已知:Ag2CrO4为砖红色固体;
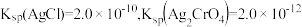 。
。请回答下列问题:
(1)在钛白水解工业废酸中,加入
 是为了使
是为了使 转化为难萃取的
转化为难萃取的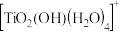 。
。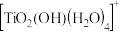 中Ti的化合价为+4,其中-1 价氧和-2 价氧的物质的量之比
中Ti的化合价为+4,其中-1 价氧和-2 价氧的物质的量之比(2)钪的萃取率(E%)与 O/A 值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择最合适的 O/A 值为

(3)温度对钪、钛的萃取率影响情况见下表,合适的萃取温度为10~15℃,其理由是
| T/℃ | 5 | 10 | 15 | 25 | 30 |
| 钪的萃取率/% | 91.3 | 96 | 97.1 | 97.3 | 98.0 |
| 钛的萃取率/% | 0.94 | 0.95 | 2.10 | 3.01 | 4.20 |
(5)实验室模拟流程中 “灼烧”得到 Sc2O3,用来盛放被灼烧物的仪器为
(6)取 ScCl3粗产品(含难溶 Sc2O3杂质)溶于水,配成溶液,采用K2CrO4为指示剂,用 AgNO3标准溶液滴定,当溶液中出现的现象为
 的浓度等于
的浓度等于
您最近一年使用:0次
2021-03-04更新
|
542次组卷
|
4卷引用:湖南省郴州市桂阳县第一中学 2021-2022 学年高三下学期期中考试试题
湖南省郴州市桂阳县第一中学 2021-2022 学年高三下学期期中考试试题广东省梅州市2021届高三一模化学试卷广东省梅州市2021届高三下学期3月总复习质检化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)
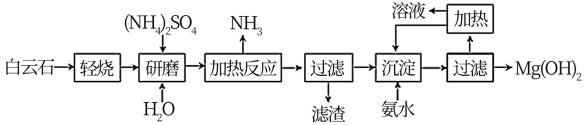
8 . Mg(OH)2是优良的阻燃剂、吸附剂,可以白云石(化学式表示为MgCO3∙CaCO3)为原料来制备。工艺流程如图所示:
回答下列问题:
(1)已知“轻烧”过程中只有碳酸镁发生分解,写出“加热反应”时主要发生反应的化学方程式:____ 。
(2)该工艺中可以循环使用的物质是_____ (填化学式)。
(3)Mg(OH)2可作阻燃材料的原因为_____
(4)“沉淀”时发生反应的离子方程式为_____ 。已知:常温下Ksp[Mg(OH)2]=1.8×10-11,若加入氨水调节溶液的pH=10,通过计算说明溶液中Mg2+是否沉淀完全(离子浓度小于10-5mol·L-1认为沉淀完全):
(5)Mg(OH)2纯度测定。为测定产品纯度,称取试样0.2500g于锥形瓶中,加入适量稀盐酸,待试样完全溶解后加入10mLpH=10的氨一氯化铁缓冲溶液,溶液变浑浊,再滴加3~4滴铬黑T指示剂(BET),用0.2000mol·L-1的EDTA标准溶液滴定至终点,重复上述操作两次,平均消耗EDTA标准溶液20.00mL。[原理:EDTA(无色)+Mg—BET紫红色)=BET(蓝色)+Mg-EDTA(无色)]
①滴定终点的现象为_____ 。
②产品中Mg(OH)2的质量分数为_____ (保留四位有效数字)。

回答下列问题:
(1)已知“轻烧”过程中只有碳酸镁发生分解,写出“加热反应”时主要发生反应的化学方程式:
(2)该工艺中可以循环使用的物质是
(3)Mg(OH)2可作阻燃材料的原因为
(4)“沉淀”时发生反应的离子方程式为
(5)Mg(OH)2纯度测定。为测定产品纯度,称取试样0.2500g于锥形瓶中,加入适量稀盐酸,待试样完全溶解后加入10mLpH=10的氨一氯化铁缓冲溶液,溶液变浑浊,再滴加3~4滴铬黑T指示剂(BET),用0.2000mol·L-1的EDTA标准溶液滴定至终点,重复上述操作两次,平均消耗EDTA标准溶液20.00mL。[原理:EDTA(无色)+Mg—BET紫红色)=BET(蓝色)+Mg-EDTA(无色)]
①滴定终点的现象为
②产品中Mg(OH)2的质量分数为
您最近一年使用:0次
2021-07-30更新
|
449次组卷
|
5卷引用:湖南省武冈市第二中学2022届高三下学期期中考试化学试题
名校
解题方法
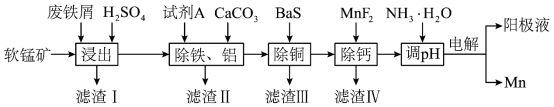
9 . 以废铁屑、低品位软锰矿[主要成分有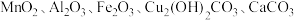 、
、 等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
已知:I.部分金属阳离子以氢氧化物沉淀时的 如表:
如表:
Ⅱ.几种化合物的溶解性或溶度积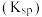 如表:
如表:
(1)基态 的价层电子排布式为
的价层电子排布式为__________ 。
(2)为去除废铁屑表面的油污可采用的方法为__________ ;“浸出”后浸出液中的 价金属阳离子有
价金属阳离子有 、
、__________ 。
(3)锰的浸出率结果如图所示。

由图可知,影响锰浸出率的因素有__________ 。
(4)“除铁、铝”过程中,浸出液需要先用试剂 处理,然后加入
处理,然后加入 ,反应后溶液的
,反应后溶液的 。试剂
。试剂 的作用是
的作用是__________ 。
(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于 时视为完全沉淀)时,溶液中
时视为完全沉淀)时,溶液中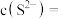
__________  。
。
(6)用惰性电极电解中性 溶液可以制得金属
溶液可以制得金属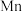 。装置如图所示。
。装置如图所示。
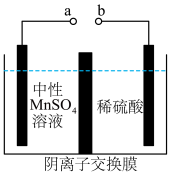
若生成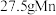 ,右室溶液中最终
,右室溶液中最终 的变化为
的变化为__________ (填“增加”或“减少”) 。
。
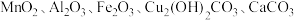 、
、 等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
已知:I.部分金属阳离子以氢氧化物沉淀时的
 如表:
如表:| 金属阳离子 |  |  |  |  |  |
开始沉淀的 | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
沉淀完全的 | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
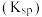 如表:
如表:| 化合物 |  |  |  |  |  |
溶解性或溶度积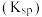 | 溶于水 | 溶于水 | 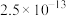 |  |  |
(1)基态
 的价层电子排布式为
的价层电子排布式为(2)为去除废铁屑表面的油污可采用的方法为
 价金属阳离子有
价金属阳离子有 、
、(3)锰的浸出率结果如图所示。

由图可知,影响锰浸出率的因素有
(4)“除铁、铝”过程中,浸出液需要先用试剂
 处理,然后加入
处理,然后加入 ,反应后溶液的
,反应后溶液的 。试剂
。试剂 的作用是
的作用是(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于
 时视为完全沉淀)时,溶液中
时视为完全沉淀)时,溶液中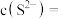
 。
。(6)用惰性电极电解中性
 溶液可以制得金属
溶液可以制得金属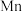 。装置如图所示。
。装置如图所示。
若生成
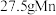 ,右室溶液中最终
,右室溶液中最终 的变化为
的变化为 。
。
您最近一年使用:0次
解题方法
10 . 亚硝酰氯(NOCl)为红褐色液体或黄色气体,其熔点为-64.5℃,沸点为-5.5℃,具有刺鼻恶臭味,遇水剧烈水解,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温、常压下合成。其制备装置如图所示。

(1)①用图甲中装置制备纯净干燥的原料气,试写出该装置制备氯气的离子方程式:_______ 。
②其中导管A的作用是_______ 。
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示)。
②装置Ⅶ装无水CaCl2的仪器名称是_______ 。
③装置Ⅳ、Ⅴ的相同作用是(写两点)________ 、________ 。
(3)实验开始时,先通入氯气,再通入NO,原因是________ 。
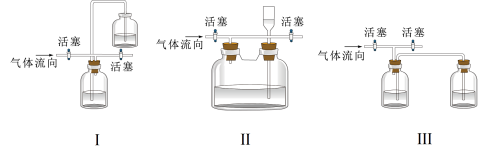
(4)有同学认为多余的氯气可以通过下列装置暂时储存然后再利用,下列可以用作氯气的储气装置的是________ (填序号)。
(5)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取8.600g样品溶于NaOH配制成500.00mL溶液,用移液管取25.00mL溶液,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.020mol/LAgNO3溶液进行滴定,消耗AgNO3溶液25.00mL。
已知:AgCl为白色沉淀溶解度1.34×10-6mol/L,Ksp(AgCl)=1.8×10-10;Ag2CrO4为砖红色沉淀溶解度6.5×10-5mol/L,Ksp(Ag2CrO4)=1.2×10-12。
①滴定终点的现象是________ 。
②样品的纯度为________ %(保留1位小数)。

(1)①用图甲中装置制备纯净干燥的原料气,试写出该装置制备氯气的离子方程式:
②其中导管A的作用是
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→
②装置Ⅶ装无水CaCl2的仪器名称是
③装置Ⅳ、Ⅴ的相同作用是(写两点)
(3)实验开始时,先通入氯气,再通入NO,原因是
(4)有同学认为多余的氯气可以通过下列装置暂时储存然后再利用,下列可以用作氯气的储气装置的是

(5)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取8.600g样品溶于NaOH配制成500.00mL溶液,用移液管取25.00mL溶液,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.020mol/LAgNO3溶液进行滴定,消耗AgNO3溶液25.00mL。
已知:AgCl为白色沉淀溶解度1.34×10-6mol/L,Ksp(AgCl)=1.8×10-10;Ag2CrO4为砖红色沉淀溶解度6.5×10-5mol/L,Ksp(Ag2CrO4)=1.2×10-12。
①滴定终点的现象是
②样品的纯度为
您最近一年使用:0次



