1 . 严谨的实验设计能有效规避实验风险,能重复实验并得到相同的结果。由粗盐制备试剂级的NaCl的相关实验步骤和装置如下:
【粗盐的提纯】
第I步:称取20.0g粗盐(含MgCl2、CaCl2、Na2SO4杂质),用80mL水溶解,加入1.0mol/L BaCl2至观察不到明显沉淀为止,用倾析法分离,保留滤液。
第II步:向滤液中先后加入过量2.0mol/L NaOH、1.0mol/L Na2CO3,过滤,再用3.0mol/L HCl调节pH至1~2。
第III步,加热浓缩至溶液刚刚出现微晶膜。
(1)第I步加入BaCl2时,证明SO 已经除净的实验方法是
已经除净的实验方法是___________ 。
(2)第II步加入Na2CO3可以除去的离子为___________ 。
(3)第III步加热浓缩时所用到的硅酸盐材质的仪器有酒精灯、___________ ;已知:Ksp(BaCO3)=5.0×10-9、Ksp(BaSO4)=1.1×10-10;如果省略第I步“倾析法分离”,所得氯化钠溶液的纯度将___________ (填“升高”、“降低”或“不受影响”)。
【试剂级的NaCl的制备】
第IV步,将第III步浓缩溶液转移至下图装置C中继续实验。
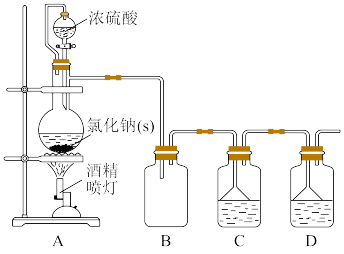
(4)装置A中发生的化学反应方程式为___________ ,控制该反应速率可采取的措施___________ (任答一点即可)。
(5)装置B中的广口瓶和装置C、D中的漏斗,其共同作用是___________ ,装置C的溶液中能观察到的实验现象是___________ 。装置D中盛放的试剂为___________ (填“NaOH溶液”、“NaHSO3溶液”或“浓H2SO4”)。
【粗盐的提纯】
第I步:称取20.0g粗盐(含MgCl2、CaCl2、Na2SO4杂质),用80mL水溶解,加入1.0mol/L BaCl2至观察不到明显沉淀为止,用倾析法分离,保留滤液。
第II步:向滤液中先后加入过量2.0mol/L NaOH、1.0mol/L Na2CO3,过滤,再用3.0mol/L HCl调节pH至1~2。
第III步,加热浓缩至溶液刚刚出现微晶膜。
(1)第I步加入BaCl2时,证明SO
 已经除净的实验方法是
已经除净的实验方法是(2)第II步加入Na2CO3可以除去的离子为
(3)第III步加热浓缩时所用到的硅酸盐材质的仪器有酒精灯、
【试剂级的NaCl的制备】
第IV步,将第III步浓缩溶液转移至下图装置C中继续实验。

(4)装置A中发生的化学反应方程式为
(5)装置B中的广口瓶和装置C、D中的漏斗,其共同作用是
您最近一年使用:0次
2022-03-25更新
|
506次组卷
|
5卷引用:湖南省武冈市第二中学2022届高三下学期期中考试化学试题
2 . 化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
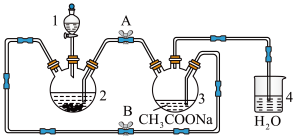
请回答下列问题:
(1)仪器1的名称是___________ ;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是___________ (填序号);目的是___________ 。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门___________ (填“A”或“B”,下同),打开阀门___________ 。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是___________ 。
(5)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的___________ ,再加入碱液,调节pH至少为___________ 才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31,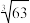 =4,lg2≈0.3】
=4,lg2≈0.3】
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)

请回答下列问题:
(1)仪器1的名称是
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是
(5)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的
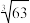 =4,lg2≈0.3】
=4,lg2≈0.3】
您最近一年使用:0次
名校
解题方法
3 . MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如图。
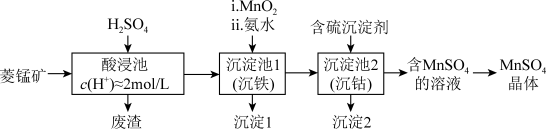
资料:金属离子沉淀的pH
(1)酸浸后所得溶液的金属阳离子包括Mn2+、Co2+、____________ 。
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加MnO2时发生反应的离子方程式:_____________ 。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是_______ 。
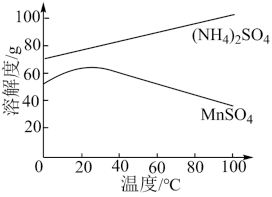
(4)图为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为_________ ,洗涤干燥。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗 (NH4)2Fe(SO4)2溶液的体积为c mL,MnO4-重新变成Mn2+。
①补全步骤ⅱ中反应的离子方程式:__________ 。
2Mn2++ S2O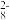 +_____ = MnO
+_____ = MnO + +__+
+ +__+
②废渣中锰元素的质量分数为________ 。
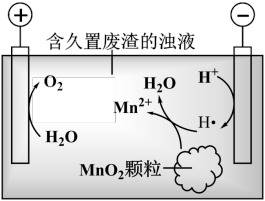
(6)废渣长期露置于空气,其中的锰元素逐渐转化为MnO2。研究者用下图装置提取MnO2中的锰元素。图中“H·”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的 先增大后减小,减小的原因可能是
先增大后减小,减小的原因可能是__________ (写出两条)。


资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加MnO2时发生反应的离子方程式:
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是
(4)图为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为

(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗 (NH4)2Fe(SO4)2溶液的体积为c mL,MnO4-重新变成Mn2+。
①补全步骤ⅱ中反应的离子方程式:
2Mn2++ S2O
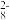 +_____ = MnO
+_____ = MnO + +__+
+ +__+ ②废渣中锰元素的质量分数为
(6)废渣长期露置于空气,其中的锰元素逐渐转化为MnO2。研究者用下图装置提取MnO2中的锰元素。图中“H·”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的
 先增大后减小,减小的原因可能是
先增大后减小,减小的原因可能是
您最近一年使用:0次
2021-05-20更新
|
880次组卷
|
11卷引用:湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题
湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题北京市海淀区2021届高三一模化学试题福建省厦门英才学校2021届高三4模考试化学试题河北省武邑中学2021届高考七模化学试题(已下线)微专题18 金属及其化合物制备流程(Mn)-备战2022年高考化学考点微专题北京市第一七一中学2021-2022学年高二上学期12月月考化学试题陕西省西安市长安区2021-2022学年高三上学期期末质量检测化学试题北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题北京市第一六六中学2023-2024学年高三上学期期中考试化学试题北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷北京市第八中学2023-2024学年高三上学期12月月考化学试题
4 . 钛酸钡(BaTiO3)是电子陶瓷材料的基础原料,用于磁扩大器,电脑装置和计算机元件的制造,工业上生产钛酸钡的一种工艺流程如下:

已知:草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
(1)用盐酸酸浸时,当温度高于40℃时,浸出率急剧降低的主要原因是___________ ,常温下,若酸浸浸出液中c(Ba2+)=0.1 mol·L-1,则c(CO )在浸出液中的最大值为
)在浸出液中的最大值为___________ mol·L-1(已知常温下,BaCO3的溶度积Ksp=2.58×10-9)
(2)常温下,TiCl4为液体且极易水解,配制一定浓度的TiCl4溶液的方法是___________ 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为___________ 。
(4)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。设计实验方案验证草酸氧化钛钡晶体是否洗涤干净?___________ 。
(5)高温煅烧草酸氧化钛钡晶体[BaTiO(C2O4)2·4H2O]得到BaTiO3的同时,生成高温气体产物有CO、___________ 。和___________ 。
(6)工业上还可利用固相合成法来制备BaTiO3,原理是将等物质的量的BaCO3和TiO2在1500℃下反应24h制备 BaTiO3,该反应的化学方程式为___________ 。

已知:草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
(1)用盐酸酸浸时,当温度高于40℃时,浸出率急剧降低的主要原因是
 )在浸出液中的最大值为
)在浸出液中的最大值为(2)常温下,TiCl4为液体且极易水解,配制一定浓度的TiCl4溶液的方法是
(3)加入H2C2O4溶液时,发生反应的化学方程式为
(4)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。设计实验方案验证草酸氧化钛钡晶体是否洗涤干净?
(5)高温煅烧草酸氧化钛钡晶体[BaTiO(C2O4)2·4H2O]得到BaTiO3的同时,生成高温气体产物有CO、
(6)工业上还可利用固相合成法来制备BaTiO3,原理是将等物质的量的BaCO3和TiO2在1500℃下反应24h制备 BaTiO3,该反应的化学方程式为
您最近一年使用:0次
5 .  是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿
是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿 主要成分
主要成分 ,还有
,还有 、
、 、
、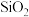 等
等 作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程既脱除燃煤尾气中的 ,又制得
,又制得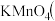 反应条件已经省略
反应条件已经省略 。
。

已知: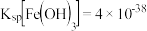 ,
,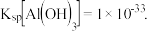 回答下列问题:
回答下列问题:
 滤渣A的成分是
滤渣A的成分是 写化学式
写化学式 
______ 。
 析出沉淀B时,首先析出的物质是
析出沉淀B时,首先析出的物质是 写化学式
写化学式 
______ 。
 步骤2中加入
步骤2中加入 的作用为
的作用为______ 。
 滤液C中加入
滤液C中加入 时发生反应的离子方程式是
时发生反应的离子方程式是______ 。
 完成步骤4中反应的化学方程式
完成步骤4中反应的化学方程式______ 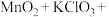
______ 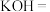
______ 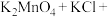
______
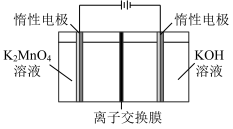
 电解制备
电解制备 的装置如图所示。电解液中最好选择
的装置如图所示。电解液中最好选择______ 离子交换膜 填“阳”或“阴”
填“阳”或“阴” 。电解时,阳极的电极反应式为
。电解时,阳极的电极反应式为______ 。
 是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿
是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿 主要成分
主要成分 ,还有
,还有 、
、 、
、 等
等 作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程既脱除燃煤尾气中的 ,又制得
,又制得 反应条件已经省略
反应条件已经省略 。
。
已知:
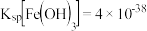 ,
,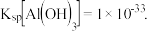 回答下列问题:
回答下列问题: 滤渣A的成分是
滤渣A的成分是 写化学式
写化学式 
 析出沉淀B时,首先析出的物质是
析出沉淀B时,首先析出的物质是 写化学式
写化学式 
 步骤2中加入
步骤2中加入 的作用为
的作用为 滤液C中加入
滤液C中加入 时发生反应的离子方程式是
时发生反应的离子方程式是 完成步骤4中反应的化学方程式
完成步骤4中反应的化学方程式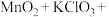
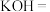
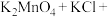

 电解制备
电解制备 的装置如图所示。电解液中最好选择
的装置如图所示。电解液中最好选择 填“阳”或“阴”
填“阳”或“阴” 。电解时,阳极的电极反应式为
。电解时,阳极的电极反应式为
您最近一年使用:0次
2019-03-28更新
|
648次组卷
|
3卷引用:【市级联考】湖南省长沙市长望刘宁四区县2019届高三模拟考试(3月)理综化学试题
名校
解题方法
6 . 金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。
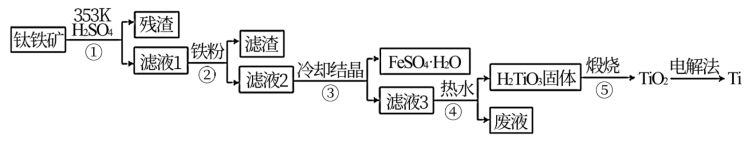
(1)步骤②、③、④中,均需进行的操作是_____________ (填操作名称)。
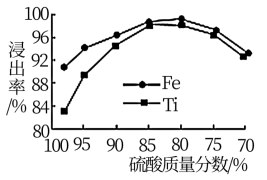
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________ ,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______ (填范围)。.
(3)请结合离子方程式解释步骤④中加热水的原因:__________ 。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______ (填“阳极”或“阴极”)生成,____ (填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:

①绿矾溶液中离子浓度由大到小的顺序为__________ 。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____ (填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}

(1)步骤②、③、④中,均需进行的操作是
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为

(3)请结合离子方程式解释步骤④中加热水的原因:
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:

①绿矾溶液中离子浓度由大到小的顺序为
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中
您最近一年使用:0次
2020-03-25更新
|
511次组卷
|
5卷引用:湖南省2020年3月线上联考理科综合化学试题
名校
解题方法
7 . 碳酸镧咀嚼片是一种不含钙和铝的磷酸盐结合剂,常用于治疗慢性肾衰患者的高磷血症。实验室模拟用LaCl3为原料来制备碳酸镧。为避免生成碱式碳酸镧[La(OH)CO3],整个反应在较低的pH条件下进行。
(1)某化学兴趣小组利用下列装置在实验室中用碳酸氢铵制备碳酸镧。

①在实验室用装置甲还可以制取下列中的气体:________ (填字母代号)。
A.O2 B.Cl2 C.H2 D.NO E.SO2 F.C2H2 G.C2H4
②仪器X的作用是__________ 。
③实验中应先开K2再开K1,原因是_________ 。
④为保证碳酸镧的纯度,实验过程中需要注意的问题有_______ (答一条即可)。
(2)碳酸钠或碳酸氢钠与氯化镧反应均可生成碳酸镧。
①为了高磷血症患者的安全,通常选用碳酸氢钠溶液,优点是________ (答一条即可)。
②NaHCO3与LaCl3反应过程中会发生两个平行反应,其离子方程式为A.____ 和B.H++ =CO2↑+H2O。
=CO2↑+H2O。
③T℃时,碳酸镧的溶解度为1.0×10-7mol/L, 的电离平衡常数为6.0×10-11。请计算反应A的平衡常数K=
的电离平衡常数为6.0×10-11。请计算反应A的平衡常数K=______ 。
(1)某化学兴趣小组利用下列装置在实验室中用碳酸氢铵制备碳酸镧。

①在实验室用装置甲还可以制取下列中的气体:
A.O2 B.Cl2 C.H2 D.NO E.SO2 F.C2H2 G.C2H4
②仪器X的作用是
③实验中应先开K2再开K1,原因是
④为保证碳酸镧的纯度,实验过程中需要注意的问题有
(2)碳酸钠或碳酸氢钠与氯化镧反应均可生成碳酸镧。
①为了高磷血症患者的安全,通常选用碳酸氢钠溶液,优点是
②NaHCO3与LaCl3反应过程中会发生两个平行反应,其离子方程式为A.
 =CO2↑+H2O。
=CO2↑+H2O。③T℃时,碳酸镧的溶解度为1.0×10-7mol/L,
 的电离平衡常数为6.0×10-11。请计算反应A的平衡常数K=
的电离平衡常数为6.0×10-11。请计算反应A的平衡常数K=
您最近一年使用:0次
8 . 中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式__________________________________________________________________ 。
(2)在400℃时,向1L的恒容反应器中充入1mol CH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K=__________________ 。按化学平衡移动原理,在图中画出该反应的平衡转化率与温度及压强(p1>p2)的关系曲线。_________
(3)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。
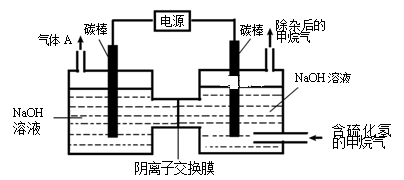
通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。则装置中右端碳棒为_____ 极,左端碳棒上的电级反应为________________ ,右池中的c(NaOH):c(Na2S)___________ (填“增大”、“ 基本不变”或“减小)。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10−7,Ka2=7.0×10−15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为__________________________________________________________________ 。
(5)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.0020 mol·L−1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=_________________________________________ 。[已知:Ksp(MnS)=1.4×10−15]
| 物质 | 燃烧热(kJ/mol) |
| 氢气 | 285.8 |
| 甲烷 | 890.3 |
| 乙烯 | 1411.5 |

(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式
(2)在400℃时,向1L的恒容反应器中充入1mol CH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K=

(3)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。

通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。则装置中右端碳棒为
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10−7,Ka2=7.0×10−15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为
(5)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.0020 mol·L−1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
名校
解题方法
9 . 工业上用低品铜矿(主要含CuS、FeO等)制备氯化亚铜(CuCl)的一种工艺流程如图:
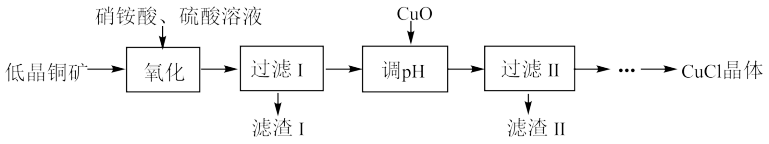
已知:①CuCl微溶于水,不溶于乙醇,露置于潮湿的空气中易被氧化。②氧化时,NH4NO3中N元素主要被还原为最低价态,少部分被还原为NO。
(1)“氧化”阶段的温度需控制在65℃,其适宜的加热方式为_________ ,该步骤中FeO被NH4NO3氧化,写出主要反应的离子方程式: ________ 。
(2)在实验室进行实验时,“氧化"阶段反应可在如图所示装置中进行。
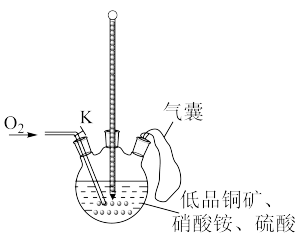
①实验开始时,温度计显示反应液温度低于室温,主要原因是______ 。
②通入氧气的目的是____________ 。
(3)利用惰性电极电解CuCl2溶液也可制取CuCl,阴极电极反应式为________ 。
(4)已知常温下CuCl在水溶液中Ksp=1.2×10-6,工艺流程最后一步析出CuCl晶体后的溶液中,如果c(Cl-)=4.0 mol·L-1,则c(Cu+)=_____ 。
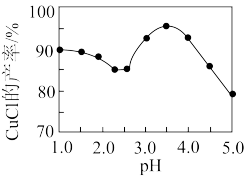
(5)已知pH对CuCl沉淀率的影响如图所示,请设计从“过滤II”所得的滤液中获取CuCl的实验方案;______________ (实验中必须使用的试剂有:NaCl溶液、Na2SO3溶液、NaOH溶液、95%乙醇)。

已知:①CuCl微溶于水,不溶于乙醇,露置于潮湿的空气中易被氧化。②氧化时,NH4NO3中N元素主要被还原为最低价态,少部分被还原为NO。
(1)“氧化”阶段的温度需控制在65℃,其适宜的加热方式为
(2)在实验室进行实验时,“氧化"阶段反应可在如图所示装置中进行。

①实验开始时,温度计显示反应液温度低于室温,主要原因是
②通入氧气的目的是
(3)利用惰性电极电解CuCl2溶液也可制取CuCl,阴极电极反应式为
(4)已知常温下CuCl在水溶液中Ksp=1.2×10-6,工艺流程最后一步析出CuCl晶体后的溶液中,如果c(Cl-)=4.0 mol·L-1,则c(Cu+)=
(5)已知pH对CuCl沉淀率的影响如图所示,请设计从“过滤II”所得的滤液中获取CuCl的实验方案;

您最近一年使用:0次
解题方法
10 . 纳米CaCO3作为工业上重要的无机填充材料,广泛应用于橡胶、塑料、涂料、油墨和造纸等行业。某化学兴趣小组在实验室中利用下列装置模拟工业制备纳米CaCO3.
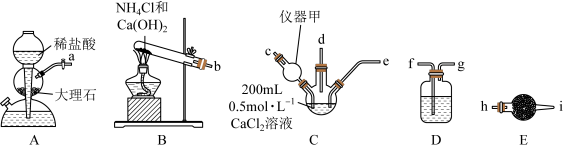
请回答下列问题:
(1)仪器甲的名称是________ ,在该实验中,其作用是_____ 。
(2)将上述接口连接顺序补充完整:a ;b
;b ;d
;d 。
。__________
(3)装置D中选择的试剂是_______ (填序号,下同),装置E中选择的试剂是_______
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③无水CaCl2固体 ④碱石灰
(4)装置C中发生反应的离子方程式为__________
(5)随着气体的通入,三颈烧瓶中产生白色沉淀且逐渐增多,但一段时间后,白色沉淀逐渐减少,其可能的原因为_______ (结合化学用语解释)。
(6)当生成5g沉淀时,理论上消耗两种气体(标准状况下)的总体积可能为_________
(7)已知:常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO3)=1.4×10-7。向浓度为1.0mol/L的Na2SO3溶液中加入纳米CaCO3,若使CaCO3向CaSO3转化,则该混合液中c(SO )/c(CO
)/c(CO )的值(x)的取值范围为
)的值(x)的取值范围为__________ 。
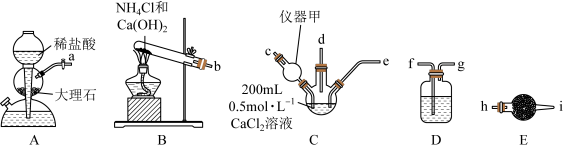
请回答下列问题:
(1)仪器甲的名称是
(2)将上述接口连接顺序补充完整:a
 ;b
;b ;d
;d 。
。(3)装置D中选择的试剂是
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③无水CaCl2固体 ④碱石灰
(4)装置C中发生反应的离子方程式为
(5)随着气体的通入,三颈烧瓶中产生白色沉淀且逐渐增多,但一段时间后,白色沉淀逐渐减少,其可能的原因为
(6)当生成5g沉淀时,理论上消耗两种气体(标准状况下)的总体积可能为
(7)已知:常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO3)=1.4×10-7。向浓度为1.0mol/L的Na2SO3溶液中加入纳米CaCO3,若使CaCO3向CaSO3转化,则该混合液中c(SO
 )/c(CO
)/c(CO )的值(x)的取值范围为
)的值(x)的取值范围为
您最近一年使用:0次



