名校
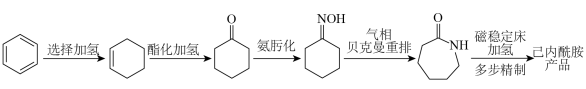
1 . 2023年12月具有完全知识产权、全球首套己内酰胺的绿色生产线正式在中国石化岳阳巴陵石化子公司投产。其生产流程如下:
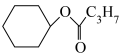
(1)已知:①
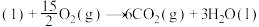
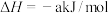
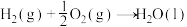

 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
___________ 。(填写计算式)
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):___________ 。
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下: 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
(4)有关该反应过程,说法不正确的是___________(填标号)。
(5)已知环己烯与羧酸发生加成反应的机理如下:
8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
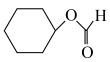
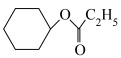
从表格中得出,环己烯与不同羧酸加成,其中与HCOOH反应的产率最高,最有可能的原因是___________ (从分子结构的角度解释)。而环己烯与环戊烯相比,在同样的催化剂条件下,相同温度下,环戊烯加成的产率更高的原因可能是___________ 。
(6)已知在标准状况下,AgCl的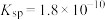 ,
, 的
的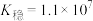 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为___________ mol/L(已知: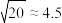 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
(1)已知:①

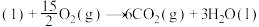
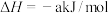
②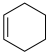
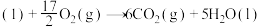
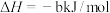
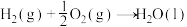

则:
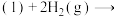

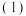

①
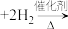
 、
、
②
 。
。
 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下:
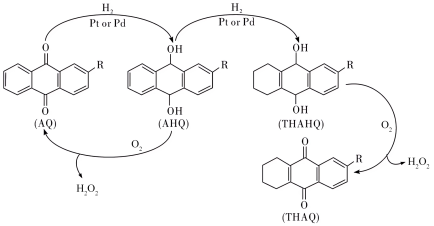
 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。(4)有关该反应过程,说法不正确的是___________(填标号)。
A.从AQ到AHQ的反应中,发生变化的碳原子的杂化类型由 到 到 |
B.由THAHQ制备 的反应方程式为 的反应方程式为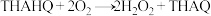 |
C.在AHQ的氧化过程中,生成的 和有机物AQ、AHQ的分离方法为蒸馏 和有机物AQ、AHQ的分离方法为蒸馏 |
| D.我国采用的浆态蒽醌氢化法,使用更高效的Pd基细颗粒催化剂,有利于提高催化的效率 |
(5)已知环己烯与羧酸发生加成反应的机理如下:

8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
| 序号 | 羧酸 | 环烯烃 | 温度/℃ | 产物 | 产率/% |
| 1 | HCOOH |
| 95 |
| 90 |
| 2 |  |
| 110 |
| 82 |
| 3 |  |
| 120 |
| 62 |
| 4 | 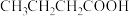 |
| 130 |
| 51 |
| 5 | HCOOH |
| 95 |
| 93 |
(6)已知在标准状况下,AgCl的
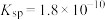 ,
, 的
的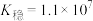 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为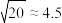 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
您最近一年使用:0次
解题方法
2 . GaN是研制高温大功率电子器件和高频微波器件的重要材料。以废旧太阳能电池(主要成分为 )为原料制备GaN的流程如图。请根据所学知识回答问题。
)为原料制备GaN的流程如图。请根据所学知识回答问题。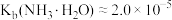 ,
, 。
。
(1) 在315℃开始凝华成有光泽的针状结晶,试推测该结晶的晶体类型:
在315℃开始凝华成有光泽的针状结晶,试推测该结晶的晶体类型:___________ 。
(2)“酸浸氧化”时,温度不宜超过50℃,原因为___________ 。
(3)加氨水调pH的目的是除铜,该步骤中分两步进行,第一步:
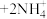 ,第二步是生成的
,第二步是生成的 溶解于氨水。
溶解于氨水。
①根据所给信息,计算第一步反应的平衡常数
___________ 。
②写出 溶解于氨水的离子方程式:
溶解于氨水的离子方程式:___________ 。
(4)“回流过滤”中, (一种液态化合物,遇水易发生水解)与
(一种液态化合物,遇水易发生水解)与 反应的化学方程式为
反应的化学方程式为___________ ;该工序分离 和
和 利用的原理是
利用的原理是___________ 。
(5) 气体在270℃左右以二聚物存在,请写出该二聚物的结构:
气体在270℃左右以二聚物存在,请写出该二聚物的结构:___________ 。
(6)“高温气相沉积”需要将蓝宝石基板(温度高达1000℃)放在沉积炉内,然后以很低的流速将氮化镓气体从上面吹入炉内。研究发现平放基板时氮化镓分子无法稳定沉积到基板上,而将基板按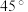 倾角斜放,却获得了非常均匀的氮化镓结晶,试分析其原因:
倾角斜放,却获得了非常均匀的氮化镓结晶,试分析其原因:___________ 。
 )为原料制备GaN的流程如图。请根据所学知识回答问题。
)为原料制备GaN的流程如图。请根据所学知识回答问题。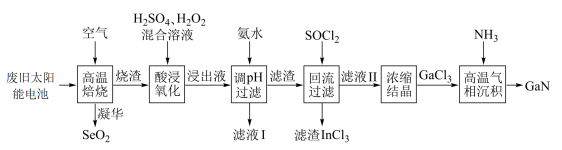
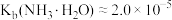 ,
, 。
。(1)
 在315℃开始凝华成有光泽的针状结晶,试推测该结晶的晶体类型:
在315℃开始凝华成有光泽的针状结晶,试推测该结晶的晶体类型:(2)“酸浸氧化”时,温度不宜超过50℃,原因为
(3)加氨水调pH的目的是除铜,该步骤中分两步进行,第一步:

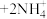 ,第二步是生成的
,第二步是生成的 溶解于氨水。
溶解于氨水。①根据所给信息,计算第一步反应的平衡常数

②写出
 溶解于氨水的离子方程式:
溶解于氨水的离子方程式:(4)“回流过滤”中,
 (一种液态化合物,遇水易发生水解)与
(一种液态化合物,遇水易发生水解)与 反应的化学方程式为
反应的化学方程式为 和
和 利用的原理是
利用的原理是(5)
 气体在270℃左右以二聚物存在,请写出该二聚物的结构:
气体在270℃左右以二聚物存在,请写出该二聚物的结构:(6)“高温气相沉积”需要将蓝宝石基板(温度高达1000℃)放在沉积炉内,然后以很低的流速将氮化镓气体从上面吹入炉内。研究发现平放基板时氮化镓分子无法稳定沉积到基板上,而将基板按
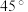 倾角斜放,却获得了非常均匀的氮化镓结晶,试分析其原因:
倾角斜放,却获得了非常均匀的氮化镓结晶,试分析其原因:
您最近一年使用:0次
名校
解题方法
3 . 铁、镍及其化合物在工业上有广泛的应用。
Ⅰ.从某矿渣[成分为 (铁酸镍)、
(铁酸镍)、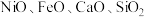 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:
(1)用95℃热水浸泡的目的是________________ ;
(2)矿渣中部分 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是________ ;
(3)向“浸取液”中加入 以除去溶液中
以除去溶液中 (浓度为
(浓度为 ),除钙率为
),除钙率为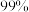 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是________  ;
;
(4)从 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是________ ,过滤,洗涤,干燥;
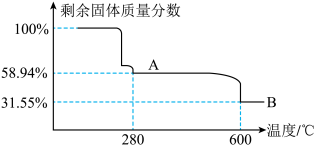
(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是________ ;
(6)基态镍离子 的核外最外层电子排布式是
的核外最外层电子排布式是________ ;
(7) 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为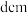 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是________  (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是________  (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
Ⅰ.从某矿渣[成分为
 (铁酸镍)、
(铁酸镍)、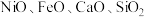 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: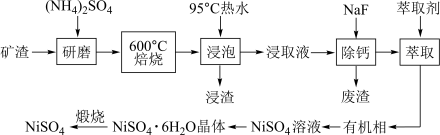
 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:(1)用95℃热水浸泡的目的是
(2)矿渣中部分
 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是(3)向“浸取液”中加入
 以除去溶液中
以除去溶液中 (浓度为
(浓度为 ),除钙率为
),除钙率为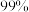 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是 ;
;(4)从
 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是
(6)基态镍离子
 的核外最外层电子排布式是
的核外最外层电子排布式是(7)
 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为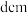 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是 (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是 (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2024-03-22更新
|
342次组卷
|
2卷引用:湖南省邵阳市2024届高三二模化学试题
4 . 五氧化二钒( )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
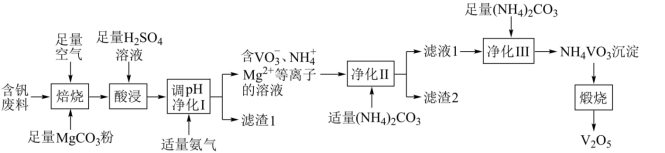
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②25℃时,难溶电解质的溶度积常数如表所示:
请回答下列问题:
(1)写出基态V原子的价层电子排布式:___________ 。
(2)“焙烧”的目的之一是将 转化成
转化成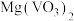 ,请写出转化的化学方程式:
,请写出转化的化学方程式:___________ 。
(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是___________ (写一条即可)。
(4)25℃,“调pH净化Ⅰ”时需将 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度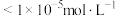 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为___________ 。
(5)“净化Ⅱ”的目的是除 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是___________ 。
(6)“滤液1”中加入 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:___________ 。
(7)煅烧 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是___________ 。
(8)为测定该产品的纯度,某同学准确称取 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成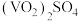 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为___________ 。(计算结果保留两位小数)
 )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  | 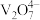 |
| 难溶电解质 |  |  |  |  |  |  |
 | 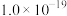 | 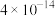 |  |  | 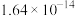 |  |
(1)写出基态V原子的价层电子排布式:
(2)“焙烧”的目的之一是将
 转化成
转化成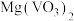 ,请写出转化的化学方程式:
,请写出转化的化学方程式:(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是
(4)25℃,“调pH净化Ⅰ”时需将
 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度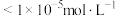 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为(5)“净化Ⅱ”的目的是除
 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是(6)“滤液1”中加入
 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:(7)煅烧
 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是(8)为测定该产品的纯度,某同学准确称取
 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成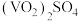 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为
您最近一年使用:0次
名校
5 . 马日夫盐[Mn(H2PO4)2•2H2O]常用于机械设备的磷化处理,可起到防锈效果。以水锰矿[主要成分为MnO(OH),还含有少量的Fe2O3、SiO2及微量的CaO、Al2O3]为原料制备马日夫盐的一种工艺流程如图所示。
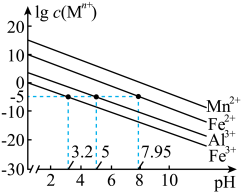
已知:①25℃时,金属离子在水溶液中的平衡浓度的对数与溶液的pH的关系如图所示。此实验条件下Mn2+开始沉淀的pH=7.54。
②当溶液中剩余的某金属离子浓度≤1×10-5mol/L时,通常认为该金属离子已沉淀完全。
回答下列问题:
(1)“溶浸”过程中主要成分发生反应的化学方程式为_______ ,为提高SO2的吸收率,可采取的措施是_______ (写出两条即可)。
(2)“滤渣2”的主要成分为_______ (写化学式)。“氧化、除杂”步骤中不宜使用H2O2替代MnO2,原因是_______ 。加入氨水的目的是调节pH,应控制pH的范围是________ 之间。
(3)加入NaF可以使Ca2+转化为CaF,沉淀除去,要使Ca2+完全沉淀,该步骤中应控制溶液中F-浓度不小于______ mol/L。[已知:Ksp(CaF2)=3.6×10-12]。
(4)“沉锰”步骤中Mn2+转化为MnCO3沉淀,反应的离子方程式为_______ 。
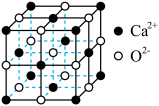
(5)CaO晶胞的结构如图所示,CaO晶体中Ca2+的配位数为______ ,距离最近的Ca2+和O2-的核间距为apm,则CaO晶体的密度为_______ g/cm3(列出计算式,阿伏加德罗常数的值为NA)。

已知:①25℃时,金属离子在水溶液中的平衡浓度的对数与溶液的pH的关系如图所示。此实验条件下Mn2+开始沉淀的pH=7.54。

②当溶液中剩余的某金属离子浓度≤1×10-5mol/L时,通常认为该金属离子已沉淀完全。
回答下列问题:
(1)“溶浸”过程中主要成分发生反应的化学方程式为
(2)“滤渣2”的主要成分为
(3)加入NaF可以使Ca2+转化为CaF,沉淀除去,要使Ca2+完全沉淀,该步骤中应控制溶液中F-浓度不小于
(4)“沉锰”步骤中Mn2+转化为MnCO3沉淀,反应的离子方程式为
(5)CaO晶胞的结构如图所示,CaO晶体中Ca2+的配位数为

您最近一年使用:0次
2024-03-18更新
|
380次组卷
|
3卷引用:湖南省衡阳市第八中学2024届高三模拟预测信息卷(一)化学试题
名校
6 . 常温下,向 和
和 的混合液中加入
的混合液中加入 固体(忽略溶液体积变化),
固体(忽略溶液体积变化), 与
与 的部分关系如图所示。已知:
的部分关系如图所示。已知: 代表
代表 或
或 。下列叙述错误的是
。下列叙述错误的是
 和
和 的混合液中加入
的混合液中加入 固体(忽略溶液体积变化),
固体(忽略溶液体积变化), 与
与 的部分关系如图所示。已知:
的部分关系如图所示。已知: 代表
代表 或
或 。下列叙述错误的是
。下列叙述错误的是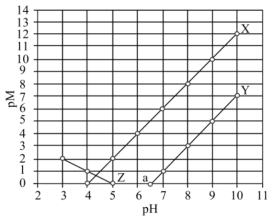
A. 代表 代表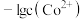 与 与 的关系 的关系 |
B.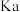 为弱酸 为弱酸 的电离常数,则常温下 的电离常数,则常温下 |
C.常温下, 和 和 共存时: 共存时: |
D.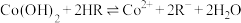 的平衡常数 的平衡常数 |
您最近一年使用:0次
2024-02-21更新
|
396次组卷
|
3卷引用:湖南省长沙市雅礼中学2023-2024学年高三下学期月考(七)化学试题
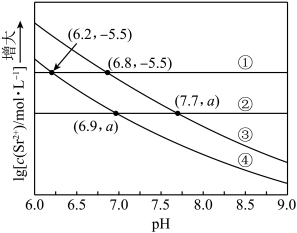
7 . 工业上常用 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数 与
与 的关系如图所示。已知:
的关系如图所示。已知: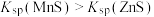 。下列说法错误的是
。下列说法错误的是
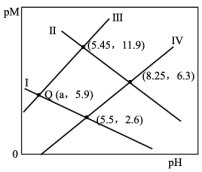
 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数 与
与 的关系如图所示。已知:
的关系如图所示。已知: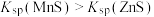 。下列说法错误的是
。下列说法错误的是
A.Ⅱ表示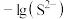 与 与 的关系曲线 的关系曲线 |
B. 点对应 点对应 的数量级为 的数量级为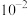 |
C.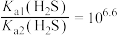 |
D.溶液中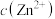 和 和 均为 均为 , , 完全沉淀时溶液的最小 完全沉淀时溶液的最小 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) |
您最近一年使用:0次
2024-02-06更新
|
264次组卷
|
2卷引用:湖南省长沙市宁乡市第一高级中学2021届高三新高考第一次模拟考试化学试卷
名校
解题方法
8 . 某废钒渣(主要成分为V2O3,含有少量Al2O3、CaO)为原料生产V2O5的工艺流程如图:
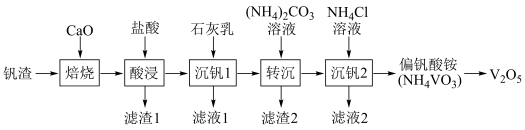
已知:钒酸(H3VO4)是强酸,NH4VO3难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
(1)向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为_______ 。
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为_______ 。
(3)已知加入石灰乳后生成Ca3(VO4)2沉淀,则加入石灰乳的作用是_______ 。
(4)反应Ca3(VO4)2(s)+3 (aq)⇌2VO
(aq)⇌2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为_______ (用含m,n的代数式表示),已知:Ksp(CaCO3)=m,Ksp[Ca3(VO4)2]=n。
(5)沉钒2过程中加入氯化铵溶液,控制溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是_______ 。
(6)测定产品中V2O5的纯度:取ag产品用硫酸溶解得(VO2)2SO4溶液,加入b1mLclmol·L-1(NH4)2Fe(SO4)2溶液(VO +2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知
+2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知 被还原为Mn2+,假设杂质不参与反应。
被还原为Mn2+,假设杂质不参与反应。
①滴定时装KMnO4溶液为_______ 滴定管(填“酸式”或“碱式”)
②则产品中V2O5的质量分数是_______ (V2O5的摩尔质量为Mg·mol-1)。
(7)下列操作会导致测定的纯度偏高的是_______。

已知:钒酸(H3VO4)是强酸,NH4VO3难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO |  | V2O | VO |
(1)向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为
(3)已知加入石灰乳后生成Ca3(VO4)2沉淀,则加入石灰乳的作用是
(4)反应Ca3(VO4)2(s)+3
 (aq)⇌2VO
(aq)⇌2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为(5)沉钒2过程中加入氯化铵溶液,控制溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是
(6)测定产品中V2O5的纯度:取ag产品用硫酸溶解得(VO2)2SO4溶液,加入b1mLclmol·L-1(NH4)2Fe(SO4)2溶液(VO
 +2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知
+2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知 被还原为Mn2+,假设杂质不参与反应。
被还原为Mn2+,假设杂质不参与反应。①滴定时装KMnO4溶液为
②则产品中V2O5的质量分数是
(7)下列操作会导致测定的纯度偏高的是_______。
| A.锥形瓶水洗后未干燥 |
| B.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| C.滴定终点时俯视读数 |
| D.滴定管用蒸馏水洗净后未用标准溶液润洗 |
您最近一年使用:0次
9 . 现有含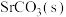 的0.1 mol⋅L
的0.1 mol⋅L 、1.0 mol⋅L
、1.0 mol⋅L
 溶液,含
溶液,含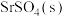 的0.1 mol⋅L
的0.1 mol⋅L 、1.0 mol⋅L
、1.0 mol⋅L
 溶液。在一定pH范围内,四种溶液中
溶液。在一定pH范围内,四种溶液中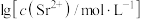 随pH的变化关系如图所示。下列说法错误的是
随pH的变化关系如图所示。下列说法错误的是
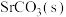 的0.1 mol⋅L
的0.1 mol⋅L 、1.0 mol⋅L
、1.0 mol⋅L
 溶液,含
溶液,含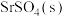 的0.1 mol⋅L
的0.1 mol⋅L 、1.0 mol⋅L
、1.0 mol⋅L
 溶液。在一定pH范围内,四种溶液中
溶液。在一定pH范围内,四种溶液中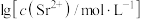 随pH的变化关系如图所示。下列说法错误的是
随pH的变化关系如图所示。下列说法错误的是
A.可以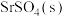 为原料生产 为原料生产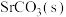 |
B. |
C.曲线④表示含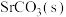 的1.0 mol⋅L 的1.0 mol⋅L  溶液的变化 溶液的变化 |
D.对含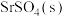 且 且 和 和 初始浓度均为1.0 mol⋅L 初始浓度均为1.0 mol⋅L 的混合溶液, 的混合溶液,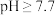 时才发生沉淀转化 时才发生沉淀转化 |
您最近一年使用:0次
2023-05-04更新
|
608次组卷
|
2卷引用:湖南师范大学附属中学2024届高三上学期月考(二) 化学试题
10 . 二元有机酸(H2X)的电离常数Ka1=1.67×10-8、Ka2=3.34×10-17。BaX难溶于水,常温下,将一定浓度的HY溶液,逐滴加入盛有一定量BaX固体的试管中,直到BaX全部溶解,测得混合液中c2(H+)与c2(Ba2+)的关系如图所示。下列说法错误的是
②0.192=0.0361,0.382=0.1444
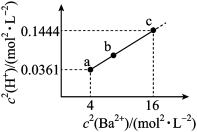
②0.192=0.0361,0.382=0.1444
| A.NaHX溶液显碱性 |
| B.溶度积Ksp(BaX)≈6.18×10-21mol2•L-2 |
| C.b点:2c(Ba2+)+c(H+)=2c(X2-)+c(HX-)+c(OH-)+c(Y-) |
| D.若0.1molBaX溶于25mLxmol•L-1HY溶液中得到c点溶液,则x≈8.38 |
您最近一年使用:0次
2023-04-27更新
|
1039次组卷
|
2卷引用:湖南省张家界市慈利县第一中学2023-2024学年高二上学期第二次月考化学试题