名校
解题方法
1 . 已知水的电离平衡曲线如图所示:
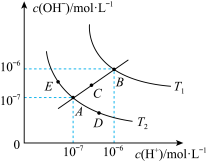
试回答下列问题:
(1)图中
_______  (用“>”、“<”、“=”回答)
(用“>”、“<”、“=”回答)
(2)图中五点的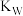 间的关系是
间的关系是_______ 。
(3)若从A点到E点,可采用的措施是_______ 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH溶液
(4)点E对应的温度下,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为_______ 。
(5)点B对应的温度下,若100体积 的某强酸溶液与1体积
的某强酸溶液与1体积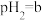 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的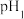 与强碱的
与强碱的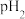 之间应满足的关系是
之间应满足的关系是_______ 。
(6)写出用pH试纸测溶液pH的操作_______ 。

试回答下列问题:
(1)图中

 (用“>”、“<”、“=”回答)
(用“>”、“<”、“=”回答)(2)图中五点的
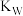 间的关系是
间的关系是(3)若从A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH溶液
(4)点E对应的温度下,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(5)点B对应的温度下,若100体积
 的某强酸溶液与1体积
的某强酸溶液与1体积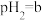 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的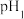 与强碱的
与强碱的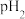 之间应满足的关系是
之间应满足的关系是(6)写出用pH试纸测溶液pH的操作
您最近一年使用:0次
2022-11-10更新
|
348次组卷
|
3卷引用:山东省菏泽市2022-2023学年高二上学期期中考试(B)化学试题
名校
解题方法
2 .  是一种可溶于水的二元弱碱,在水中能电离出
是一种可溶于水的二元弱碱,在水中能电离出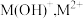 。已知
。已知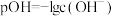 。常温下,向
。常温下,向 溶液中滴加某浓度的硫酸溶液,调节
溶液中滴加某浓度的硫酸溶液,调节 的值,测得溶液的
的值,测得溶液的 随x{
随x{ 或
或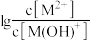 }的变化关系如图所示。下列说法正确的是
}的变化关系如图所示。下列说法正确的是
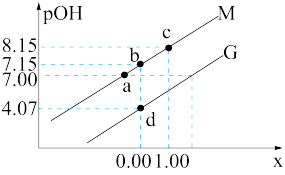
 是一种可溶于水的二元弱碱,在水中能电离出
是一种可溶于水的二元弱碱,在水中能电离出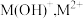 。已知
。已知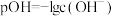 。常温下,向
。常温下,向 溶液中滴加某浓度的硫酸溶液,调节
溶液中滴加某浓度的硫酸溶液,调节 的值,测得溶液的
的值,测得溶液的 随x{
随x{ 或
或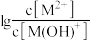 }的变化关系如图所示。下列说法正确的是
}的变化关系如图所示。下列说法正确的是
| A.溶液中水的电离程度:a点大于b点 |
B.曲线M代表 与 与 的变化关系 的变化关系 |
C.常温下,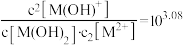 |
D.b点处有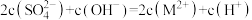 |
您最近一年使用:0次
3 . 常温下,下列关于溶液的说法错误的是
A.某盐溶液pH<7,则此溶液中水电离的 浓度大于 浓度大于 |
B.pH均为3的 和HCl溶液的导电能力基本相同 和HCl溶液的导电能力基本相同 |
C.0.1mol/L的氨水pH约为11,则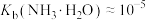 |
D.将 溶液稀释,pH减小 溶液稀释,pH减小 |
您最近一年使用:0次
名校
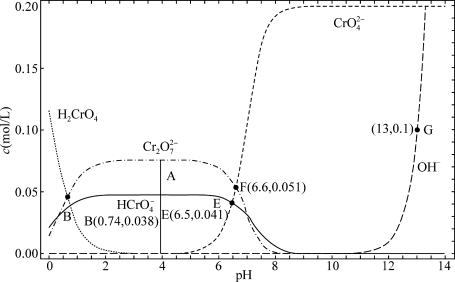
4 . 某温度下,改变0.1mol/L  溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
 溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
A.该温度下的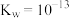 |
B.溶液中存在平衡 ,该温度下此反应的 ,该温度下此反应的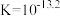 |
C.向0.1mol/L  溶液中加入一定量NaOH固体,溶液橙色变浅 溶液中加入一定量NaOH固体,溶液橙色变浅 |
D.E点溶液中存在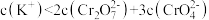 |
您最近一年使用:0次
解题方法
5 . 室温下,向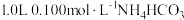 溶液中加入
溶液中加入 稀溶液,溶液中主要微粒的分布系数【如
稀溶液,溶液中主要微粒的分布系数【如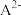 的分布系数
的分布系数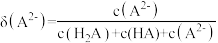 】以及
】以及 随
随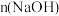 变化如图。
变化如图。
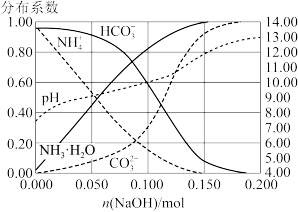
下列叙述错误的是
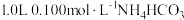 溶液中加入
溶液中加入 稀溶液,溶液中主要微粒的分布系数【如
稀溶液,溶液中主要微粒的分布系数【如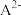 的分布系数
的分布系数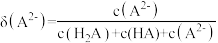 】以及
】以及 随
随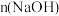 变化如图。
变化如图。
下列叙述错误的是
A.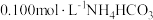 溶液中 溶液中 ,水电离受到促进 ,水电离受到促进 |
B.加入 稀溶液过程中,溶液满足关系式 稀溶液过程中,溶液满足关系式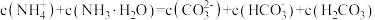 |
C.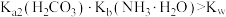 |
D.加入少量 时, 时, 先与 先与 发生主要反应 发生主要反应 |
您最近一年使用:0次
解题方法
6 . 常温时,采用甲基橙和酚酞双指示剂,用盐酸滴定Na2CO3溶液,溶液中lgc(H2CO3)、lgc(HCO )、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
)、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
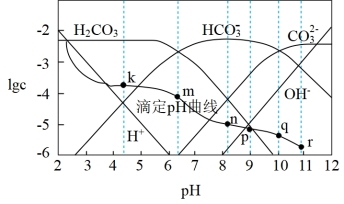
 )、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
)、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
| A.整个滴定过程中可先用酚酞再用甲基橙作指示剂 |
| B.n点的pH为m点和q点pH的平均值 |
C.r点溶液中c(OH-)=c(H+)+c(HCO )+2c(H2CO3) )+2c(H2CO3) |
| D.r点到k点对应的变化过程中,溶液中水的电离程度先减小后增大 |
您最近一年使用:0次
名校
7 . 常温下,某实验人员在两个相同的容器中分别加入20 mL 0.2 mol/LNa2A溶液和40 mL 0.1 mol/L NaHA溶液,再分别用0.2mol/L盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(H2A溶液达到某浓度后,会放出一定量气体)下列说法正确的是(溶液体积变化可忽略)
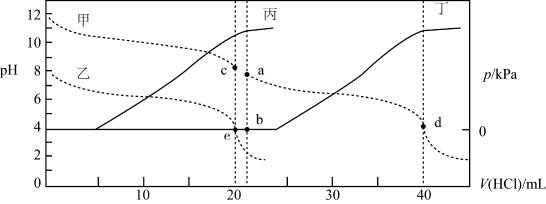

| A.图中曲线乙和丁代表向NaHA溶液中滴加盐酸 |
| B.由图可知,Ka1×Ka2>Kw |
| C.c点pH约为8,且此时溶液中满足:c(Na+)+c(H+)<2c(A2-)+2c(H2A)+c(HA-) |
| D.水的电离程度:b点>d点 |
您最近一年使用:0次
解题方法
8 . 已知水在25℃和95℃时,其电离平衡曲线如图所示:
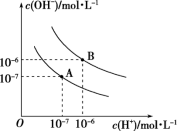
(1)则25℃时水的电离平衡曲线应为_______ (填“A”或“B”),请说明理由:_______ 。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为_______ 。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______ 。
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积不变,则a=_______ ,实验②所得溶液中由水电离产生的c(OH-)=_______ mol·L-1。
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显_______ (填“酸”“碱”或“中”)性。
②写出按乙方式混合后,反应的化学方程式:_______ ,所得溶液显_______ (填“酸”“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为_______ (混合时,忽略溶液体积的变化)。
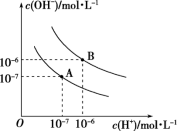
(1)则25℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的化学方程式:
③按甲方式混合,所得溶液的pH为
您最近一年使用:0次
9 . 实验测得浓度均为0.1mol·L-1的NaOH溶液、CH3COONa溶液和NH4Cl溶液的pH随温度变化的曲线如图所示。下列说法错误的是
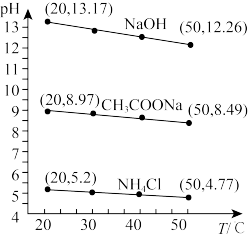

| A.20℃时,纯水的Kw约为10-14.17 |
| B.随温度升高,CH3COONa溶液和NH4Cl溶液中的c(OH-)均减小 |
| C.随温度升高,CH3COONa溶液和NH4Cl溶液的水解平衡均正向移动 |
D.50℃时,将CH3COONa和NH4Cl配制成pH=7的混合液,溶液中存在:c(CH3COO-)+c(Cl-)=c( )+c(Na+) )+c(Na+) |
您最近一年使用:0次
名校
解题方法
10 . 常温下,浓度相同的一元弱酸 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是
 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是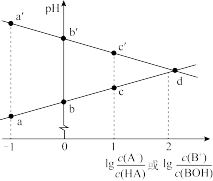
A.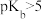 | B.a和a′点的纵坐标之和为14 |
C.水的电离程度: | D.溶液中的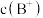 :c点大于c′点 :c点大于c′点 |
您最近一年使用:0次
2022-05-05更新
|
649次组卷
|
4卷引用:山东省济南市2022届高三第二次模拟化学试题



