解题方法
1 . 已知水在25℃和95℃时,其电离平衡曲线如图所示:
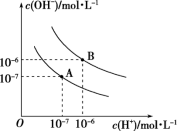
(1)则25℃时水的电离平衡曲线应为_______ (填“A”或“B”),请说明理由:_______ 。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为_______ 。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______ 。
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积不变,则a=_______ ,实验②所得溶液中由水电离产生的c(OH-)=_______ mol·L-1。
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显_______ (填“酸”“碱”或“中”)性。
②写出按乙方式混合后,反应的化学方程式:_______ ,所得溶液显_______ (填“酸”“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为_______ (混合时,忽略溶液体积的变化)。
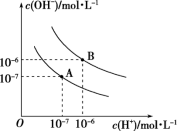
(1)则25℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的化学方程式:
③按甲方式混合,所得溶液的pH为
您最近一年使用:0次
名校
解题方法
2 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol•L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH- |
B. =10-12的溶液中:Na+、NO =10-12的溶液中:Na+、NO 、[Al(OH)4]-、CO 、[Al(OH)4]-、CO |
C.水电离的c(H+)=1×10-13mol•L-1溶液中:Na+、K+、NO 、HCO 、HCO |
D.0.1mol•L-1的FeCl3溶液中:K+、Mg2+、SO 、SCN- 、SCN- |
您最近一年使用:0次
名校
3 . 常温下,某实验人员在两个相同的容器中分别加入20 mL 0.2 mol/LNa2A溶液和40 mL 0.1 mol/L NaHA溶液,再分别用0.2mol/L盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(H2A溶液达到某浓度后,会放出一定量气体)下列说法正确的是(溶液体积变化可忽略)
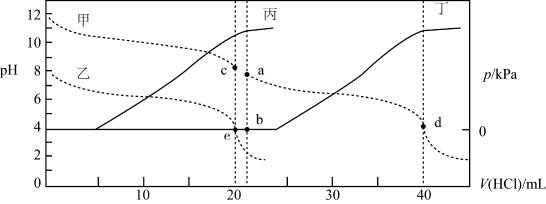

| A.图中曲线乙和丁代表向NaHA溶液中滴加盐酸 |
| B.由图可知,Ka1×Ka2>Kw |
| C.c点pH约为8,且此时溶液中满足:c(Na+)+c(H+)<2c(A2-)+2c(H2A)+c(HA-) |
| D.水的电离程度:b点>d点 |
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
4 . 室温下,向10mL0.1mol·L-1HA溶液中滴加0.1mol·L-1的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知:AG=lg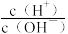 。
。
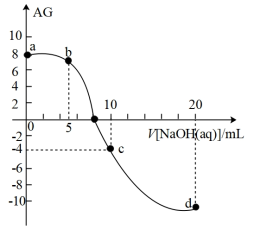
下列说法错误的是
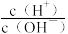 。
。
下列说法错误的是
| A.在a、b、c、d点对应的溶液中,c点时水的电离程度最大 |
| B.b点对应的溶液中:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C.d点对应的溶液中:c(OH-)=c(H+)+c(HA)+c(A-) |
| D.室温下,HA的电离常数Ka约为1.0×10-4 |
您最近一年使用:0次
2022-04-30更新
|
354次组卷
|
3卷引用:押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)
(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题广东省韶关市2021-2022学年高三上学期期中考试化学试题
名校
解题方法
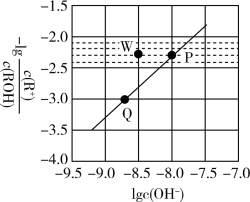
5 . 常温时,将 的
的 溶液(
溶液( )加水稀释,溶液中
)加水稀释,溶液中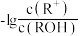 与
与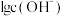 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 的
的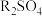 溶液(
溶液(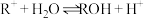 )加水稀释,溶液中
)加水稀释,溶液中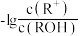 与
与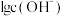 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.常温时,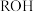 的电离平衡常数为 的电离平衡常数为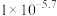 |
B.P、Q点对应的水的电离程度: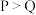 |
C.Q点对应的溶液中, |
D.常温时,加入适量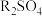 固体可使P点向W点移动 固体可使P点向W点移动 |
您最近一年使用:0次
2022-04-13更新
|
1445次组卷
|
8卷引用:陕西省榆林市2022届高三第二次联考化学试题
陕西省榆林市2022届高三第二次联考化学试题河南省大联考2022届高三第三次模拟考试理科综合化学试题湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题(已下线)化学-2022年高考押题预测卷01(全国乙卷)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)四川省遂宁市第二中学校2021-2022学年高二下学期半期考试化学试题甘肃省白银市靖远县2021-2022学年高三下学期开学考试理综化学试题山西省阳泉市2022-2023学年高三上学期期末教学质量监测理科综合化学试题
名校
6 . 已知部分弱酸的电离平衡常数如表,根据表中数据回答下列问题。
(1)已知某浓度的 水溶液
水溶液 ,原因是
,原因是_______ (用离子方程式表示), 的
的 溶液中,由水电离出的
溶液中,由水电离出的 浓度为
浓度为_______ 。
(2)同浓度 这4种溶液中碱性由强到弱的顺序是
这4种溶液中碱性由强到弱的顺序是_______ ; 溶液中各离子浓度由大到小的顺序是
溶液中各离子浓度由大到小的顺序是_______ 。
(3)体积相同、 相同的三种酸溶液a.
相同的三种酸溶液a. ;b.
;b. ;c.
;c. 分别与同浓度的
分别与同浓度的 溶液完全中和,消耗
溶液完全中和,消耗 溶液的体积由大到小的排列顺序是(填字母)
溶液的体积由大到小的排列顺序是(填字母)_______ 。
| 弱酸 |  |  |  |
电离平衡常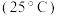 | 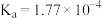 |  | 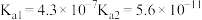 |
 水溶液
水溶液 ,原因是
,原因是 的
的 溶液中,由水电离出的
溶液中,由水电离出的 浓度为
浓度为(2)同浓度
 这4种溶液中碱性由强到弱的顺序是
这4种溶液中碱性由强到弱的顺序是 溶液中各离子浓度由大到小的顺序是
溶液中各离子浓度由大到小的顺序是(3)体积相同、
 相同的三种酸溶液a.
相同的三种酸溶液a. ;b.
;b. ;c.
;c. 分别与同浓度的
分别与同浓度的 溶液完全中和,消耗
溶液完全中和,消耗 溶液的体积由大到小的排列顺序是(填字母)
溶液的体积由大到小的排列顺序是(填字母)
您最近一年使用:0次
2022-04-04更新
|
79次组卷
|
2卷引用:新疆乌鲁木齐市第四中学2021-2022学年高二上学期期末考试化学试题
名校
7 . 设NA为阿伏加德罗常数的值。下列说法正确的是
| A.100g质量分数为46%的乙醇溶液中,含O—H键的数目为7NA |
| B.0.1mol·L-1的CH3COONa溶液中,含CH3COO-的数目小于0.1NA |
| C.含0.2molH2SO4的浓硫酸与足量的镁反应,转移的电子数小于0.2NA |
| D.常温下,1LpH=11的Ba(OH)2溶液中,含OH-的数目为0.002NA |
您最近一年使用:0次
2022-03-28更新
|
2950次组卷
|
9卷引用:河南省新乡市2022届高三第二次模拟考试理科综合化学试题
河南省新乡市2022届高三第二次模拟考试理科综合化学试题(已下线)专题02化学计量与化学计算-2022年高考真题+模拟题汇编(全国卷)(已下线)专题02化学计量与化学计算-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题02化学计量与化学计算-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题03 破解“七陷阱”突破NA-备战2023年高考化学一轮复习考点微专题(已下线)2022年辽宁省高考真题变式题(1-10)(已下线)2022年辽宁高考真题化学试题变式题(选择题1-5)山西省阳泉市第一中学校2022-2023学年高二上学期11月期中考试化学试题2023届河南省南阳市六校高三下学期第一次联考化学试卷
名校
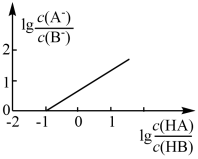
8 . 常温下,向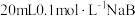 溶液中滴入等物质的量浓度的
溶液中滴入等物质的量浓度的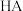 溶液,所得溶液中
溶液,所得溶液中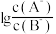 与
与 的关系如图所示,已知
的关系如图所示,已知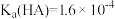 。下列说法正确的是
。下列说法正确的是
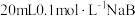 溶液中滴入等物质的量浓度的
溶液中滴入等物质的量浓度的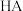 溶液,所得溶液中
溶液,所得溶液中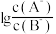 与
与 的关系如图所示,已知
的关系如图所示,已知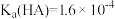 。下列说法正确的是
。下列说法正确的是
A.滴加过程反应为 |
B.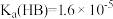 |
| C.滴加过程溶液中水的电离程度先增大后减小 |
D.滴入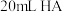 ,溶液中 ,溶液中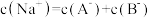 |
您最近一年使用:0次
2022-02-03更新
|
462次组卷
|
3卷引用:山东省青岛市黄岛区2021-2022学年高三上学期期末考试化学试题
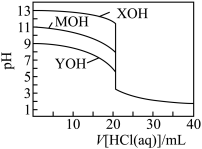
9 . 常温下,用 盐酸分别逐滴加入到
盐酸分别逐滴加入到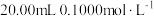 的三种一元碱溶液中,溶液的
的三种一元碱溶液中,溶液的 随加入盐酸体积的变化如图所示。下列叙述错误的是
随加入盐酸体积的变化如图所示。下列叙述错误的是
 盐酸分别逐滴加入到
盐酸分别逐滴加入到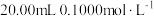 的三种一元碱溶液中,溶液的
的三种一元碱溶液中,溶液的 随加入盐酸体积的变化如图所示。下列叙述错误的是
随加入盐酸体积的变化如图所示。下列叙述错误的是
A.一元碱电离常数大小关系为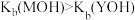 |
B.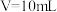 时, 时,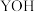 溶液中 溶液中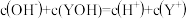 |
C.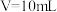 时,三种溶液中阳离子总浓度大小顺序为 时,三种溶液中阳离子总浓度大小顺序为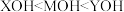 |
D. 时,三种溶液中水的电离程度最大的是 时,三种溶液中水的电离程度最大的是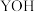 |
您最近一年使用:0次
2022-02-03更新
|
267次组卷
|
2卷引用:山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题
解题方法
10 . 人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO ),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3
),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3 HCO
HCO +H+的Ka=10−6.1,正常人的血液中c(HCO
+H+的Ka=10−6.1,正常人的血液中c(HCO ):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)
):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)
 ),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3
),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3 HCO
HCO +H+的Ka=10−6.1,正常人的血液中c(HCO
+H+的Ka=10−6.1,正常人的血液中c(HCO ):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)
):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)| A.正常人血液内Kw=10-14 |
B.当过量的碱进入血液中时,只发生反应HCO +OH-=CO +OH-=CO +H2O +H2O |
C.正常人血液中存在:c(HCO )+c(OH-)+2c(CO )+c(OH-)+2c(CO )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
| D.由题给数据可算得正常人血液的pH约为7.4 |
您最近一年使用:0次
2022-01-26更新
|
194次组卷
|
2卷引用:浙江省绍兴柯桥区2021-2022学年高二上学期期末教学质量调测化学试题



