名校
解题方法
1 . 化学是一门实验的科学,滴定法是化学上常用的定量分析的方法,有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:________ (填“1”或“2”),滴加2~3滴________ 作指示剂(填“甲基橙”或“酚酞”)。
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>________ 。
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
________ mL。
(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵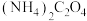 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为 。
。
iii.终点时用去bmL 的KMnO4溶液。
的KMnO4溶液。
(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式___________ 。
(7)如何判定滴定终点___________ 。
(8)计算:血液中含钙离子的浓度为___________ mol/L(用字母表示)。
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于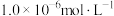 )时,溶液中
)时,溶液中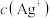 为
为___________  (已知
(已知 )。
)。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
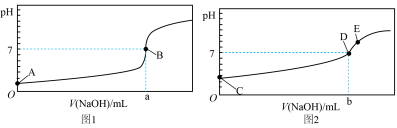
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
| A.> | B.< | C.= | D.不确定 |
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
| 滴定次数 | 待测液体积(mL) | 标准溶液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 1.02 | 18.97 |
| 2 | 20.00 | 0.60 | 见图 |
| 3 | 20.00 | 0.20 | 18.25 |

(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
| A.盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| B.配制标准溶液的固体NaOH中混有KOH杂质 |
| C.盛装NaOH标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失 |
| D.读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数 |
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵
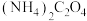 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为
 。
。iii.终点时用去bmL
 的KMnO4溶液。
的KMnO4溶液。(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式
(7)如何判定滴定终点
(8)计算:血液中含钙离子的浓度为
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中
 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于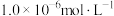 )时,溶液中
)时,溶液中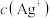 为
为 (已知
(已知 )。
)。
您最近一年使用:0次
2023-12-18更新
|
314次组卷
|
2卷引用:上海市七宝中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
2 . Ⅰ. 下的某溶液中,
下的某溶液中,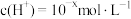 ,
,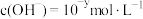 ,
, 与
与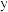 的关系如下图所示:
的关系如下图所示:
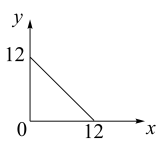
(1)在此温度下,向 溶液中逐滴加入
溶液中逐滴加入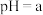 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:
假设溶液混合前后的体积变化忽略不计,则
_______ ,实验②中由水电离产生的
_______  。
。
(2)在此温度下,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为_______ 。
Ⅱ.在保持体系总压为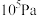 的条件下进行反应:
的条件下进行反应: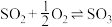 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度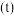 的关系如图所示:
的关系如图所示:

(3)图中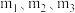 的大小顺序为
的大小顺序为_______ 。
(4)图中A点原料气的成分: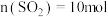 ,
,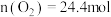 ,
, ,达平衡时
,达平衡时 的分压
的分压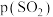 为
为_______ 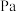 (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。
(5)若在容积均为2L的密闭容器内, 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: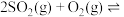
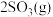
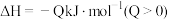 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
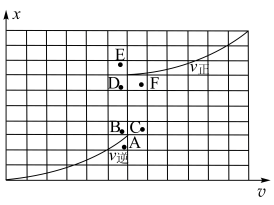
三个容器中的反应分别达平衡时下列各组数据关系正确的是_______(填字母)。
Ⅲ. 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: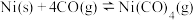
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和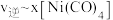 的关系如图所示:
的关系如图所示:
(6)当降低温度时,反应重新达到平衡, 和
和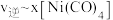 相对应的点分别为
相对应的点分别为_______ 、_______ (填字母)。
 下的某溶液中,
下的某溶液中,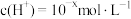 ,
,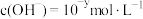 ,
, 与
与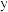 的关系如下图所示:
的关系如下图所示:
(1)在此温度下,向
 溶液中逐滴加入
溶液中逐滴加入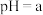 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:| 实验序号 |  溶液的体积/mL 溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |


 。
。(2)在此温度下,将
 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为Ⅱ.在保持体系总压为
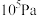 的条件下进行反应:
的条件下进行反应: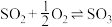 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度 的关系如图所示:
的关系如图所示:
(3)图中
 的大小顺序为
的大小顺序为(4)图中A点原料气的成分:
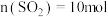 ,
,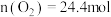 ,
, ,达平衡时
,达平衡时 的分压
的分压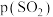 为
为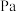 (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。(5)若在容积均为2L的密闭容器内,
 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: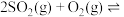
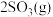
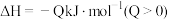 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 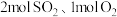 | 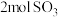 |  |
平衡时n( ) ) |  |  |  |
| 反应的能量变化 | 放出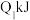 | 吸收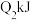 | 放出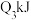 |
| 体系的压强 |  |  |  |
| 反应物的转化率 | 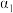 | 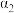 | 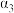 |
A.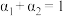 |
B.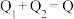 |
C. |
D. |
E. |
F.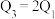 |
Ⅲ.
 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: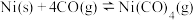
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和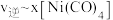 的关系如图所示:
的关系如图所示:
(6)当降低温度时,反应重新达到平衡,
 和
和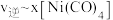 相对应的点分别为
相对应的点分别为
您最近一年使用:0次
解题方法
3 . 草酸 是二元弱酸,常温下,用
是二元弱酸,常温下,用 溶液滴定草酸溶液,溶液中
溶液滴定草酸溶液,溶液中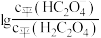 或
或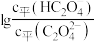 与混合溶液
与混合溶液 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 是二元弱酸,常温下,用
是二元弱酸,常温下,用 溶液滴定草酸溶液,溶液中
溶液滴定草酸溶液,溶液中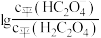 或
或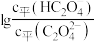 与混合溶液
与混合溶液 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.草酸的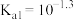 | B.水的电离程度 |
C. 点时, 点时, | D.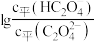 随溶液 随溶液 的变化为曲线Ⅱ 的变化为曲线Ⅱ |
您最近一年使用:0次
2023-12-03更新
|
311次组卷
|
2卷引用:山东省日照市2023-2024学年高二上学期期中校际联合考试化学试题
4 . 水溶液中的离子平衡在生产生活中有广泛的应用,下列说法正确的是
| A.蒸干氯化镁溶液并灼烧可得到干燥的氯化镁固体 |
| B.用氯化铵溶液除去铁器表面的铁锈是利用了电离生成的氢离子 |
C.向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察到溶液颜色变浅,证明 溶液,观察到溶液颜色变浅,证明 溶液中存在水解平衡 溶液中存在水解平衡 |
D. 的盐酸和 的盐酸和 的碳酸钠溶液中,二者由水电离出的氢离子浓度一定相同 的碳酸钠溶液中,二者由水电离出的氢离子浓度一定相同 |
您最近一年使用:0次
名校
解题方法
5 . 已知 ℃时,
℃时,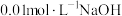 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为
 ℃时,
℃时,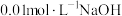 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为A.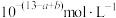 | B. |
C.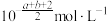 | D.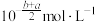 |
您最近一年使用:0次
2023-11-12更新
|
471次组卷
|
3卷引用:河北省邢台市五岳联盟2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
6 . Ⅰ.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为___________ 。
(2)在该条件下,反应前后容器的体积之比为___________ 。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)___________ 0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量___________ Q kJ(填 “大于”、“小于”或“等于”)。
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
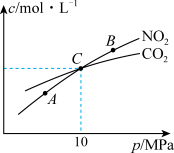
(4)A、B两点的浓度平衡常数关系:Kc(A)___________ Kc(B) (填 “﹥”、“<”或“﹦”)。
(5)A、B、C三点中NO2的转化率最高的是___________ (填“A”或“B”或“C”)点。
(6)计算C点时该反应的压强平衡常数Kp(C)=___________ (Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
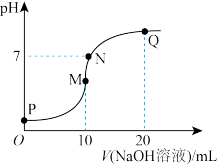
(7)M、Q两点中,水的电离程度较大的是___________ 点。
(8)下列关系中,正确的是___________ 。
a.M点c(Na+)>c(NH )
)
b.N点c(NH )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)
c.Q点c(NH )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
(1)写出该反应的热化学方程式为
(2)在该条件下,反应前后容器的体积之比为
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s )
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
(4)A、B两点的浓度平衡常数关系:Kc(A)
(5)A、B、C三点中NO2的转化率最高的是
(6)计算C点时该反应的压强平衡常数Kp(C)=
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:

(7)M、Q两点中,水的电离程度较大的是
(8)下列关系中,正确的是
a.M点c(Na+)>c(NH
 )
)b.N点c(NH
 )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)c.Q点c(NH
 )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
您最近一年使用:0次
解题方法
7 . 室温下,以酚酞为指示剂,用 溶液滴定
溶液滴定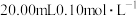 二元酸
二元酸 溶液。溶液pH随滴加NaOH溶液体积
溶液。溶液pH随滴加NaOH溶液体积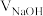 的变化关系如图所示。已知
的变化关系如图所示。已知 的电离过程为:
的电离过程为: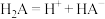 ,
, 。下列叙述正确的是
。下列叙述正确的是

 溶液滴定
溶液滴定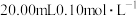 二元酸
二元酸 溶液。溶液pH随滴加NaOH溶液体积
溶液。溶液pH随滴加NaOH溶液体积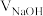 的变化关系如图所示。已知
的变化关系如图所示。已知 的电离过程为:
的电离过程为: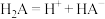 ,
, 。下列叙述正确的是
。下列叙述正确的是
A.室温下,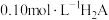 溶液 溶液 |
| B.滴定过程中,水的电离程度一直在增大 |
C.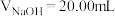 时,溶液中 时,溶液中 |
D.滴定终点时,溶液中 |
您最近一年使用:0次
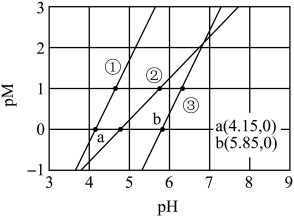
8 . 常温下,向含有 、
、 、
、 的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示
的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示 或
或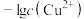 或
或 ]。
]。
已知: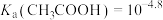 ,
,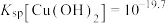 。若溶液中离子浓度小于
。若溶液中离子浓度小于 ,认为该离子沉淀完全。下列说法不正确的是
,认为该离子沉淀完全。下列说法不正确的是
 、
、 、
、 的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示
的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示 或
或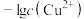 或
或 ]。
]。已知:
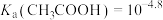 ,
,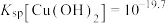 。若溶液中离子浓度小于
。若溶液中离子浓度小于 ,认为该离子沉淀完全。下列说法不正确的是
,认为该离子沉淀完全。下列说法不正确的是
A.曲线①表示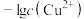 与pH的关系 与pH的关系 |
B. 时,溶液中 时,溶液中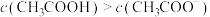 |
C. 时,可认为 时,可认为 沉淀完全 沉淀完全 |
D. 时, 时,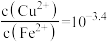 |
您最近一年使用:0次
2023-04-19更新
|
1598次组卷
|
5卷引用:广东省广州市2023届高三二模考试化学试题
广东省广州市2023届高三二模考试化学试题(已下线)押题密卷 03-【热题狂飙】2023年高考化学样卷(全国卷专用)辽宁省沈阳市第二中学2023届高三下学期第六次模拟考试化学试题广东省肇庆市德庆县香山中学2023-2024学年高三上学期9月月考化学试题四川省泸州市泸县第四中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
9 . 常温下,用如图1所示装置,向10mL 0.1 mol·L-1 Na2CO3和c mol·L-1NaHCO3混合溶液中逐滴滴加0.1 mol·L-1的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示(忽略温度的变化)。下列说法错误的是
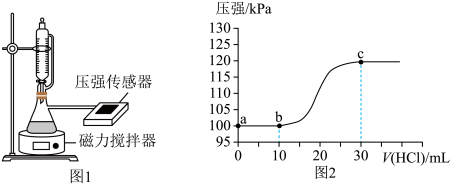
| A.c=0.1 |
B.a点的溶液中: 2c(Na+)=3[c(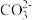 )+c( )+c(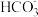 )+c(H2CO3)] )+c(H2CO3)] |
C.b点的溶液中:c(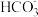 )>c( )>c(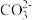 )>c(H2CO3) )>c(H2CO3) |
| D.a、b两点水的电离程度: a>b |
您最近一年使用:0次
2023-04-14更新
|
456次组卷
|
4卷引用:陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题(已下线)2023年湖南卷高考真题变式题(选择题11-14)广西玉林市博白县2023-2024学年高三上学期六校联考化学试卷 海南省海南中学2023-2024学年高三下学期第6次月考化学试题
名校
解题方法
10 . 25℃时,某混合溶液中c(H2A) +c(HA-) +c(A2-) =0.01 mol/L,由水电离出的c水(H+) 的对数lgc水(H+ )与 、
、 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
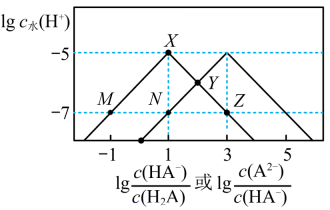
 、
、 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.Ka1(H2A) =10-8 |
| B.Z点时溶液的pH=7 |
| C.M点和N点溶液的组成完全相同 |
| D.从X点到Y点发生的反应可能为:HA- +OH- =A2- +H2O |
您最近一年使用:0次
2023-03-16更新
|
907次组卷
|
2卷引用:河南省平许济洛四市2023届高三下学期第二次质量检测理科综合化学试题



