解题方法
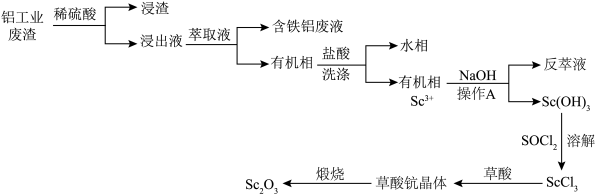
1 . 钪(Sc)可用于制造特种玻璃、轻质耐高温合金及半导体器件等,在航天,航空、核反应、医疗等方面有广泛应用。以制铝工业提取氧化铝时排出的废渣(含有Se2O3,Al2O3、Fe2O3、SiO2等)为原料提取氧化钪(Sc2O3)的流程如下:
②25℃时,Ka1(H2C2O4)=5.0×10-2、Ka2(H2C2O4)=5.0×10-5。
回答下列问题:
(1)废渣酸浸时,为了提高浸出率,可采取的措施有___________ (任写两条);浸渣的主要用途有___________ 。
(2)“萃取”时选用酸性磷酸酯(P507)为主的复合萃取剂,其中P507的质量分数(ω)对萃取率的影响如图1所示,料液温度对分离系数[分离系数指分离后混合体系中某物质的物质的量分数,如βSc/Fe= ×100%]的影响如图2所示:
×100%]的影响如图2所示:___________ ,料液的最适合温度为___________ 。
(3)一般认为c≤1.0×10-5mol/L时沉淀完全,已知lg2≈0.3,反萃取时,为了让Sc3+沉淀完全,应控制溶液pH的最小值为___________ 。
(4)在实验室中完成操作A和煅烧草酸钪晶体,所需装置分别为___________ (填字母)。___________ 。
(6)25℃时,pH=2的草酸溶液中 =
=___________ 。
②25℃时,Ka1(H2C2O4)=5.0×10-2、Ka2(H2C2O4)=5.0×10-5。
回答下列问题:
(1)废渣酸浸时,为了提高浸出率,可采取的措施有
(2)“萃取”时选用酸性磷酸酯(P507)为主的复合萃取剂,其中P507的质量分数(ω)对萃取率的影响如图1所示,料液温度对分离系数[分离系数指分离后混合体系中某物质的物质的量分数,如βSc/Fe=
 ×100%]的影响如图2所示:
×100%]的影响如图2所示:
(3)一般认为c≤1.0×10-5mol/L时沉淀完全,已知lg2≈0.3,反萃取时,为了让Sc3+沉淀完全,应控制溶液pH的最小值为
(4)在实验室中完成操作A和煅烧草酸钪晶体,所需装置分别为
(6)25℃时,pH=2的草酸溶液中
 =
=
您最近一年使用:0次
解题方法
2 . 油气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。
I.已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ∆H1
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ∆H2
③2H2(g)+O2(g)=2H2O(g) ∆H3
④2H2S(g)=S2(g)+2H2(g) ∆H4
(1)∆H4=
(2)已知∆H4>0,
A.低温 B.高温
(3)处理H2S普遍采用的方法是克劳斯工艺,即利用反应①和②生成S2;另一种方法是利用反应④分解H2S。相比克劳斯工艺,分解法的优点是
II.在1373K、100 kPa下,分别将n(H2S):n(Ar)为4:1、1:1、1:4、1:9的H2S-Ar混合气体置于密闭容器中发生反应④,反应过程中H2S转化率随时间的变化如下图所示:
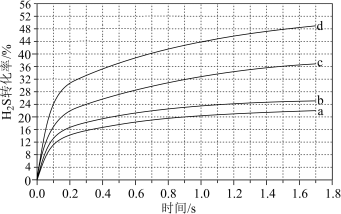
(4)n(H2S):n(Ar)=1:9对应图中曲线
A.a B.b C.c D.d
(5)n(H2S):n(Ar)=1:4的混合气体投料后,若将温度升高至1473K,达到平衡时混合气体中H2S与H2的分压相等,H2S平衡转化率为
III.在真空克劳斯法脱硫中,用K2CO3溶液吸收H2S。
电离平衡常数 | H2CO3 | H2S |
K1 | 4.2×10-7 | 5.6×10-8 |
K2 | 5.6×10-11 | 1.2×10-15 |
(6)下列关于K2CO3溶液中微粒关系正确的是___________。
A.c(OH-)>c(HCO ) ) | B.c(H+)>c(HCO ) ) |
C.c(OH-)=c(H+)+c(HCO )+2c(H2CO3) )+2c(H2CO3) | D.2c(K+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
(7)K2CO3溶液吸收少量H2S的离子方程式为
您最近一年使用:0次
解题方法
3 . 资源化利用二氧化硫,一方面能保护环境,另一方面能提高经济效益,具有深远意义。
(1)下列生产、生活活动中,不易产生 的是___________。
的是___________。
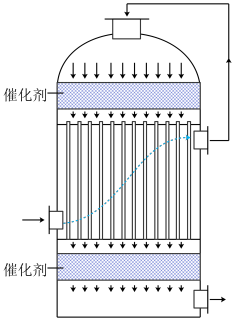
(2)工业中可用含 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了___________。
转化”工序。使用该装置实现了___________。
(3)研究 的性质有利于探索其资源化利用。下列实验方案设计正确的是
的性质有利于探索其资源化利用。下列实验方案设计正确的是___________ 。
钠碱法的启动吸收剂为 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。
(4)常温下进行“钠碱法”的模拟实验。用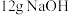 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为___________ L(折算成标准状况)。若实验时只吸收了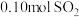 ,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为___________ 。
(5)当钠碱法的吸收液 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是________ (填写化学式)。
(6)将 通入
通入 溶液时,得到一组
溶液时,得到一组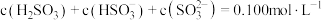 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
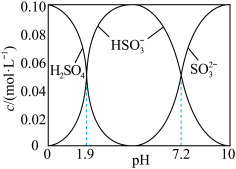
若溶液的 ,溶液中
,溶液中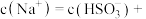
___________ ,此时溶液中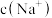
___________  。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)
(7)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数( )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数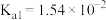 ,
,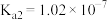 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。___________
(8)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为 吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价_____ 。
(1)下列生产、生活活动中,不易产生
 的是___________。
的是___________。| A.燃放鞭炮 | B.火力发电 | C.火山爆发 | D.海水晒盐 |
(2)工业中可用含
 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了___________。
转化”工序。使用该装置实现了___________。
| A.充分利用热能 | B.防止形成酸雾 | C.加速转化 | D.获取纯净 |
(3)研究
 的性质有利于探索其资源化利用。下列实验方案设计正确的是
的性质有利于探索其资源化利用。下列实验方案设计正确的是 |  |  |  |
A.制取 | B.收集 | C.验证 水溶液的酸性 水溶液的酸性 | D.验证 的还原性 的还原性 |
钠碱法的启动吸收剂为
 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。(4)常温下进行“钠碱法”的模拟实验。用
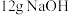 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为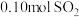 ,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为(5)当钠碱法的吸收液
 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是(6)将
 通入
通入 溶液时,得到一组
溶液时,得到一组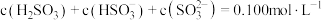 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
若溶液的
 ,溶液中
,溶液中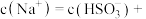
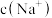
 。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)(7)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(
 )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数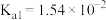 ,
,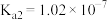 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。(8)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为
 吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
您最近一年使用:0次
名校
解题方法
4 . 我国力争于2030年前做到碳达峰、2060年前实现碳中和,体现了中国对解决气候问题的担当。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径、CO、捕获与CO2重整是CO2利用的研究热点,
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
则 △H=
△H=________ kJ∙mol−1。
(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:_____ T2(填“>”“<”或“=”),依据为________ ;
②图中a=________ ;
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为________ 。
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为___________ (写离子符号);若所得溶液

 溶液pH=
溶液pH=_____ (室温下,
 的
的
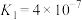 ;
;
 )。
)。
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是___________ 。
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
| 共价键 | C=O | C-O | H-H | H-O | C-H |
| 键能/(kJ·mol⁻¹) | 799 | 343 | 436 | 463 | 413 |
 △H=
△H=(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:
②图中a=
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为

 溶液pH=
溶液pH= 的
的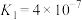 ;
; )。
)。(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是
您最近一年使用:0次
2023-10-29更新
|
375次组卷
|
2卷引用:内蒙古自治区赤峰市2024届高三上学期10月一轮复习大联考化学试题
解题方法
5 . 氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)NH3极易溶于水且溶液显碱性,请用化学方程式解释原因:___________ 。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaHN2O2)___________ pH(NaNO2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=___________ (保留三位有效数字)。
③0.1mol/LNa2N2O2溶液中离子浓度由大到小的顺序为___________ 。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
反应Ⅲ:H2O(l)=H2O(g) ΔH3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为___________ 。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g

①T1℃时,NH3的平衡转化率=______ ,该反应的平衡常数K的值为_____ 。
②图2中能正确反应平衡常数K随温度变化关系的曲线为_____ (填字母标号)。
(1)NH3极易溶于水且溶液显碱性,请用化学方程式解释原因:
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=
③0.1mol/LNa2N2O2溶液中离子浓度由大到小的顺序为
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ:2NH3(g)+CO2(g)
 NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;反应Ⅱ:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;反应Ⅲ:H2O(l)=H2O(g) ΔH3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g

①T1℃时,NH3的平衡转化率=
②图2中能正确反应平衡常数K随温度变化关系的曲线为
您最近一年使用:0次
6 . 25℃时,某小组同学分别用如下方法测定CH3COOH的电离常数(Ka)。
【方法一】实验步骤:
i.取amL稀CH3COOH溶液于锥形瓶中,再加入……
ii.用c1mol•L-1NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V1mL。
iii.另取一份该稀CH3COOH溶液于烧杯中,用pH计测得其pH为x。
(1)CH3COOH电离方程式为______ 。
(2)补全i中试剂及用量______ 。
(3)该稀CH3COOH溶液的浓度c=______ mol•L-1(用代数式表示)。
数据处理:醋酸的电离平衡常数Ka=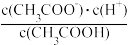 ≈
≈ 。代入相关数据,即可得Ka。
。代入相关数据,即可得Ka。
误差分析:
(4)若i中锥形瓶提前用该稀CH3COOH溶液进行了润洗,会使测得的Ka______ 。(填“偏大”、“偏小”、“无影响”)
【方法二】实验原理:
由CH3COOH的电离平衡常数表达式可知,当c(CH3COO-)=c(CH3COOH)时,Ka=c(H+)。
实验步骤:①取25mL某CH3COOH溶液,用NaOH溶液滴定至终点。
②继续向①中加入一定量的该CH3COOH溶液。
③用pH计测定②中混合溶液的pH为y。
(5)为保证c(CH3COO-)≈c(CH3COOH),步骤②中加入的CH3COOH溶液应为______ 。(填序号)
数据处理:
(6)Ka=______ (用代数式表示)。
迁移应用:
(7)已知亚磷酸(H3PO3)为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。

下列说法正确的是______ (填字母序号)。
A.H3PO3的Ka1=10-1.43
B.NaH2PO3溶液显碱性
C.向H3PO3溶液中逐滴加入NaOH溶液至pH=6.54,发生反应:3OH-+2H3PO3=H2PO +HPO
+HPO +3H2O
+3H2O
【方法一】实验步骤:
i.取amL稀CH3COOH溶液于锥形瓶中,再加入……
ii.用c1mol•L-1NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V1mL。
iii.另取一份该稀CH3COOH溶液于烧杯中,用pH计测得其pH为x。
(1)CH3COOH电离方程式为
(2)补全i中试剂及用量
(3)该稀CH3COOH溶液的浓度c=
数据处理:醋酸的电离平衡常数Ka=
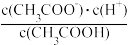 ≈
≈ 。代入相关数据,即可得Ka。
。代入相关数据,即可得Ka。误差分析:
(4)若i中锥形瓶提前用该稀CH3COOH溶液进行了润洗,会使测得的Ka
【方法二】实验原理:
由CH3COOH的电离平衡常数表达式可知,当c(CH3COO-)=c(CH3COOH)时,Ka=c(H+)。
实验步骤:①取25mL某CH3COOH溶液,用NaOH溶液滴定至终点。
②继续向①中加入一定量的该CH3COOH溶液。
③用pH计测定②中混合溶液的pH为y。
(5)为保证c(CH3COO-)≈c(CH3COOH),步骤②中加入的CH3COOH溶液应为
| A.25mL | B.50mL | C.75mL | D.用量与①中使用的NaOH溶液浓度有关 |
数据处理:
(6)Ka=
迁移应用:
(7)已知亚磷酸(H3PO3)为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。

下列说法正确的是
A.H3PO3的Ka1=10-1.43
B.NaH2PO3溶液显碱性
C.向H3PO3溶液中逐滴加入NaOH溶液至pH=6.54,发生反应:3OH-+2H3PO3=H2PO
 +HPO
+HPO +3H2O
+3H2O
您最近一年使用:0次
7 . 钪的特殊性质,使其在电子工业、航天、核技术、激光技术、冶金、化工、医学、农业等各方面得到广泛应用。一种利用高温沸腾氯化烟尘(主要成分为AlCl3、FeCl3、TiCl4、ScCl3等,还含有其他难溶于酸的物质)回收Sc的工艺流程如图。

已知:钪(原子序数为21)与铝类似,其氢氧化物具有两性;钪离子可以在不同pH下生成[Sc(OH)n]3-n(n=1~6)。
请回答以下问题:
(1)某次实验中需要使用480mL3mol·L-1的盐酸,用浓盐酸(密度为1.2g·cm-3,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为_______ mL,需要使用的玻璃仪器除烧杯、量筒、玻璃棒外,还需要的是_______ 。
(2)钪的一种核素可用作示踪原子,用于对恶性肿瘤放射治疗,该种核素的中子数为25,则该核素的符号为_______ 。
(3)“反萃取”时,若加入的氢氧化钠溶液过量,则Sc(OH)3沉淀会溶解。写出Se(OH)3与过量NaOH溶液反应生成n=6的含钪产物的化学方程式:_______ 。
(4)加入草酸进行“沉淀转化”,将Sc(OH)3沉淀转化为Sc2(C2O4)3。25°C时pH=2的草酸溶液中 =
=_______ 。(25°C时,草酸的电离平衡常数为Ka1=5.0×10-2,Ka2=5.4×10-5)
(5)草酸钪在空气中“灼烧”可制得Sc2O3,写出反应的化学方程式:_______ 。
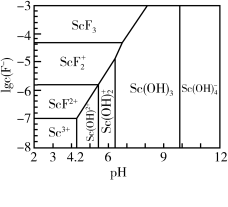
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。若溶液中c(F-)=1×10-5mol·L-1,“调pH”过程中控制pH=5,此时三价Sc的主要存在形式为_______ (填化学式)。

已知:钪(原子序数为21)与铝类似,其氢氧化物具有两性;钪离子可以在不同pH下生成[Sc(OH)n]3-n(n=1~6)。
请回答以下问题:
(1)某次实验中需要使用480mL3mol·L-1的盐酸,用浓盐酸(密度为1.2g·cm-3,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为
(2)钪的一种核素可用作示踪原子,用于对恶性肿瘤放射治疗,该种核素的中子数为25,则该核素的符号为
(3)“反萃取”时,若加入的氢氧化钠溶液过量,则Sc(OH)3沉淀会溶解。写出Se(OH)3与过量NaOH溶液反应生成n=6的含钪产物的化学方程式:
(4)加入草酸进行“沉淀转化”,将Sc(OH)3沉淀转化为Sc2(C2O4)3。25°C时pH=2的草酸溶液中
 =
=(5)草酸钪在空气中“灼烧”可制得Sc2O3,写出反应的化学方程式:
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。若溶液中c(F-)=1×10-5mol·L-1,“调pH”过程中控制pH=5,此时三价Sc的主要存在形式为

您最近一年使用:0次
解题方法
8 . 利用氧化锌烟尘(主要成分为ZnO、PbS、As2O3、Fe2O3、SiO2等)制备饲料级碱式氯化锌[Zn5(OH)8Cl·H2O]。其工艺流程如下所示:

回答下列问题:
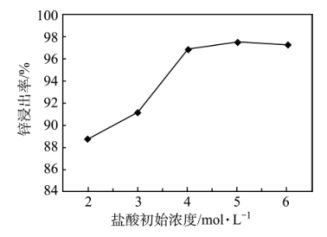
(1)“浸出”过程中的浸出液含有的阳离子是H+、Pb2+、As3+、Zn2+、Fe2+,则滤渣1主要成分为S和___________ (写出化学式);锌的浸出率和盐酸浓度关系如图;工业上,选择初始浓度为___________ 4mol/L的原因是___________ 。
(2)氢氧化铁胶体可以特异性吸附As3+,在“调pH”的过程中,检验有胶体生成的物理方法是___________ 。
(3)写出“除铅”的离子反应方程式___________ ,若除铅后测得c(Zn2+)=0.36mol/L,则溶液中c(Pb2+)=___________ mol/L,已:Ksp(PbCO3)=7.20×10-14;Ksp(ZnCO3)=1.44×10-10.
(4)“合成”时,发生的总的化学反应方程式为___________ 。
(5)用Zn5(OH)8Cl·H2O制得纳米ZnO,其悬浊液可以用于吸收SO2尾气,已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、 、
、 的物质的量分数随pH的变化如图所示。
的物质的量分数随pH的变化如图所示。
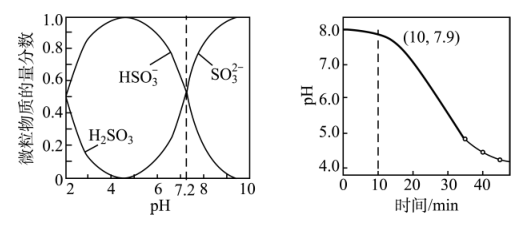
室温下,lgKa2(H2SO3)=___________ ;在开始吸收的40min内,溶液pH的变化如上图所示。0~10min,该反应主要产物是___________ (填化学式);30min以后阶段,主要的化学反应方程式为___________ 。

回答下列问题:
(1)“浸出”过程中的浸出液含有的阳离子是H+、Pb2+、As3+、Zn2+、Fe2+,则滤渣1主要成分为S和

(2)氢氧化铁胶体可以特异性吸附As3+,在“调pH”的过程中,检验有胶体生成的物理方法是
(3)写出“除铅”的离子反应方程式
(4)“合成”时,发生的总的化学反应方程式为
(5)用Zn5(OH)8Cl·H2O制得纳米ZnO,其悬浊液可以用于吸收SO2尾气,已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、
 、
、 的物质的量分数随pH的变化如图所示。
的物质的量分数随pH的变化如图所示。
室温下,lgKa2(H2SO3)=
您最近一年使用:0次
解题方法
9 . 综合利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4]获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如下:
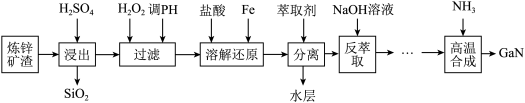
已知:常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表。
请回答:
(1)写出铁酸锌(ZnFe2O4) 中铁元素的化合价_______ 。
(2)Ga位于周期表IIIA族,性质与Al相似,反萃取后水溶液中镓元素以_______ (用化学式表示)存在。
(3)处理浸出液时,调节pH至5.4的目的是_______ 。
(4)加入铁的原因为_______ 。
(5)写出“高温合成”操作中Ga(CH3)3与NH3反应生成GaN的化学方程式_______ 。
(6)利用炼锌矿矿渣所获得的三种金属盐,分别为镓盐、_______ 和_______ 。(用化学式表示)
(7)取一定量GaN样品溶于足量的热NaOH溶液中,用H3BO3溶液将产生的NH3完全吸收,用标准浓度的盐酸滴定,通过消耗盐酸的体积,可测定样品的纯度。已知:NH3+ H3BO3= NH3·H3BO3;NH3·H3BO3 +HCl= NH4Cl+H3BO3,硼酸的Ka=10-9.24,从滴定角度分析可用过量H3BO3溶液吸收NH3的可能原因是_______ 。

已知:常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表。
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.9 |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
(1)写出铁酸锌(ZnFe2O4) 中铁元素的化合价
(2)Ga位于周期表IIIA族,性质与Al相似,反萃取后水溶液中镓元素以
(3)处理浸出液时,调节pH至5.4的目的是
(4)加入铁的原因为
(5)写出“高温合成”操作中Ga(CH3)3与NH3反应生成GaN的化学方程式
(6)利用炼锌矿矿渣所获得的三种金属盐,分别为镓盐、
(7)取一定量GaN样品溶于足量的热NaOH溶液中,用H3BO3溶液将产生的NH3完全吸收,用标准浓度的盐酸滴定,通过消耗盐酸的体积,可测定样品的纯度。已知:NH3+ H3BO3= NH3·H3BO3;NH3·H3BO3 +HCl= NH4Cl+H3BO3,硼酸的Ka=10-9.24,从滴定角度分析可用过量H3BO3溶液吸收NH3的可能原因是
您最近一年使用:0次
解题方法
10 . 盐与酸的反应是水溶液中常见的反应,某学习小组展开相关探究。
I.碳酸氢钠片抗酸容量(σ)的测定
(1)碳酸氢钠片能中和过多的胃酸(主要成分是HCl),小组同学测定其抗酸容量的实验步骤如下:
a.配制100mL0.2mol•L-1的盐酸溶液;
b.称取mg碳酸氢钠片,溶于20mL水中,用上述盐酸溶液滴定至pH=3。
已知:碳酸氢钠片的抗酸容量是指用盐酸溶液滴定碳酸氢钠片水溶液至pH=3时,单位质量的碳酸氢钠片所消耗的盐酸的物质的量,即σ= 。
。
①步骤a需4mol•L-1盐酸的体积为_____ mL(保留1位小数)。
②步骤b需要用到图中所示仪器中的_____ (填名称)。

③若步骤b中消耗盐酸的体积为VmL,则σ=______ mol•g-1。
II.Na2HPO4-KH2PO4混合溶液抗酸能力的探究
Na2HPO4-KH2PO4混合溶液具有抗酸能力。向该溶液中加入少量盐酸,溶液的pH变化不大;加入盐酸的量相等时,溶液的pH变化越小,溶液的抗酸能力越强。
已知:i.25℃时,H3PO4的Ka1=7.6×10-3,Ka2=6.3×10-8,Ka3=4.4×10-13,lg4.4=0.64,lg6.3=0.80,lg7.6=0.88;
ii.Na2HPO4-KH2PO4混合溶液的抗酸能力与[c(Na2HPO4)+c(KH2PO4)]、 有关。
有关。
(2)HPO 和H2PO
和H2PO 可发生相互转化,写出其中一种转化的离子方程式:
可发生相互转化,写出其中一种转化的离子方程式:______ 。
(3)小组同学设计实验探究 相同时,[c(Na2HPO4)+c(KH2PO4)]对混合溶液抗酸能力的影响,溶液配制方案如表。分别向溶液1、溶液2、溶液3中滴加0.1mol•L-1盐酸,溶液的pH随加入盐酸滴数的变化情况如图所示。
相同时,[c(Na2HPO4)+c(KH2PO4)]对混合溶液抗酸能力的影响,溶液配制方案如表。分别向溶液1、溶液2、溶液3中滴加0.1mol•L-1盐酸,溶液的pH随加入盐酸滴数的变化情况如图所示。

①已知A点时, =1,则此时溶液的pH=
=1,则此时溶液的pH=______ (精确至小数点后1位)。
②实验结果显示,NaCl溶液不具有抗酸能力,即曲线_____ (填曲线标号)表示溶液1。
③实验结果显示,当 相同时,[c(Na2HPO4)+c(KH2PO4)]越大,混合溶液的抗酸能力越强,则曲线b表示溶液
相同时,[c(Na2HPO4)+c(KH2PO4)]越大,混合溶液的抗酸能力越强,则曲线b表示溶液______ (填溶液序号)。
(4)小组同学继续探究[c(Na2HPO4)+c(KH2PO4)]相同时, 对混合溶液抗酸能力的影响,实验方案如表:
对混合溶液抗酸能力的影响,实验方案如表:
①表中x=_____ 。
②实验结果显示,当[c(Na2HPO4)+c(KH2PO4)]相同时, 越大,溶液的抗酸能力越强,能支撑该结论的实验结果是
越大,溶液的抗酸能力越强,能支撑该结论的实验结果是______ (用含A1、A2、A3、A4、A5、A6的关系式表示)。
I.碳酸氢钠片抗酸容量(σ)的测定
(1)碳酸氢钠片能中和过多的胃酸(主要成分是HCl),小组同学测定其抗酸容量的实验步骤如下:
a.配制100mL0.2mol•L-1的盐酸溶液;
b.称取mg碳酸氢钠片,溶于20mL水中,用上述盐酸溶液滴定至pH=3。
已知:碳酸氢钠片的抗酸容量是指用盐酸溶液滴定碳酸氢钠片水溶液至pH=3时,单位质量的碳酸氢钠片所消耗的盐酸的物质的量,即σ=
 。
。①步骤a需4mol•L-1盐酸的体积为
②步骤b需要用到图中所示仪器中的

③若步骤b中消耗盐酸的体积为VmL,则σ=
II.Na2HPO4-KH2PO4混合溶液抗酸能力的探究
Na2HPO4-KH2PO4混合溶液具有抗酸能力。向该溶液中加入少量盐酸,溶液的pH变化不大;加入盐酸的量相等时,溶液的pH变化越小,溶液的抗酸能力越强。
已知:i.25℃时,H3PO4的Ka1=7.6×10-3,Ka2=6.3×10-8,Ka3=4.4×10-13,lg4.4=0.64,lg6.3=0.80,lg7.6=0.88;
ii.Na2HPO4-KH2PO4混合溶液的抗酸能力与[c(Na2HPO4)+c(KH2PO4)]、
 有关。
有关。(2)HPO
 和H2PO
和H2PO 可发生相互转化,写出其中一种转化的离子方程式:
可发生相互转化,写出其中一种转化的离子方程式:(3)小组同学设计实验探究
 相同时,[c(Na2HPO4)+c(KH2PO4)]对混合溶液抗酸能力的影响,溶液配制方案如表。分别向溶液1、溶液2、溶液3中滴加0.1mol•L-1盐酸,溶液的pH随加入盐酸滴数的变化情况如图所示。
相同时,[c(Na2HPO4)+c(KH2PO4)]对混合溶液抗酸能力的影响,溶液配制方案如表。分别向溶液1、溶液2、溶液3中滴加0.1mol•L-1盐酸,溶液的pH随加入盐酸滴数的变化情况如图所示。
| 溶液序号 | 组成 | 体积/mL |
| 1 | 0.2mol•L-1NaCl溶液 | 10 |
| 2 | 0.2mol•L-1Na2HPO4溶液 | 5 |
| 0.2mol•L-1KH2PO4溶液 | 5 | |
| 3 | 0.06mol•L-1Na2HPO4溶液 | 5 |
| 0.06mol•L-1KH2PO4溶液 | 5 |
 =1,则此时溶液的pH=
=1,则此时溶液的pH=②实验结果显示,NaCl溶液不具有抗酸能力,即曲线
③实验结果显示,当
 相同时,[c(Na2HPO4)+c(KH2PO4)]越大,混合溶液的抗酸能力越强,则曲线b表示溶液
相同时,[c(Na2HPO4)+c(KH2PO4)]越大,混合溶液的抗酸能力越强,则曲线b表示溶液(4)小组同学继续探究[c(Na2HPO4)+c(KH2PO4)]相同时,
 对混合溶液抗酸能力的影响,实验方案如表:
对混合溶液抗酸能力的影响,实验方案如表:| 溶液序号 | 试剂体积/mL | pH | 加入24滴0.1mol•L-1盐酸后的pH | |
| 0.2mol•L-1Na2HPO4溶液 | xmol•L-1KH2PO4溶液 | |||
| 4 | 9 | 1 | A1 | A4 |
| 5 | 8 | 2 | A2 | A5 |
| 6 | 5 | 5 | A3 | A6 |
②实验结果显示,当[c(Na2HPO4)+c(KH2PO4)]相同时,
 越大,溶液的抗酸能力越强,能支撑该结论的实验结果是
越大,溶液的抗酸能力越强,能支撑该结论的实验结果是
您最近一年使用:0次



