解题方法
1 . 200℃时,气态肼(N2H4)在Cu-Ni双金属表面分解的过程如下:
过程Ⅰ:3N2H4(g)=N2(g)+4NH3(g) △H1=akJ•mol-1
过程Ⅱ:2NH3(g)=N2(g)+3H2(g) △H2=+92kJ•mol-1
已知相关化学键的数据如表所示:
(1)过程Ⅰ中a=_____ ,写出气态肼(N2H4)在Cu-Ni双金属表面分解成氮气和氢气的热化学方程式_____ 。
(2)300℃时,向2L刚性容器中充入1molN2H4发生分解成N2和H2的反应,不同时刻测得容器内压强的变化如表所示:
反应前5小时内的平均反应速率v(N2)为_____ mol•L-1•h-1,平衡时H2的分压p(H2)=_____ MPa。
(3)在温度为573K、压强为100kPa的反应条件下,对于n(N2H4):n(Ne)分别为3:1、1:1、1:3、1:6的N2H4-Ne混合气在热分解反应过程中N2H4的转化率随时间的变化如图所示:

①n(N2H4):n(Ne)的比值越小,N2H4的平衡转化率越_____ (填“大”或“小”),理由是_____ 。
②n(N2H4):n(Ne)=1:3所对应的曲线是_____ (填字母代号)。
(4)肼(N2H4)又称联氨,溶于水可以发生与氨水类似的电离,是一种二元弱碱。肼溶于水的电离方程式为:
N2H4+H2O N2H
N2H +OH- Kb1=2×10-8
+OH- Kb1=2×10-8
N2H +H2O
+H2O N2H
N2H +OH- Kb2=6×10-10
+OH- Kb2=6×10-10
现将等浓度等体积的肼的水溶液与硫酸溶液混合,混合后生成的盐的化学式为_____ ,混合后溶液中 =
=_____ 。
过程Ⅰ:3N2H4(g)=N2(g)+4NH3(g) △H1=akJ•mol-1
过程Ⅱ:2NH3(g)=N2(g)+3H2(g) △H2=+92kJ•mol-1
已知相关化学键的数据如表所示:
| 化学键 | H-H | N-N | N≡N | H-N |
| E/(kJ•mol-1) | x | 265 | 946 | y |
(2)300℃时,向2L刚性容器中充入1molN2H4发生分解成N2和H2的反应,不同时刻测得容器内压强的变化如表所示:
| 时间/h | 0 | 1 | 2 | 3 | 5 | 6 | 7 |
| p/MPa | 50 | 60 | 80 | 120 | 140 | 140 | 140 |
(3)在温度为573K、压强为100kPa的反应条件下,对于n(N2H4):n(Ne)分别为3:1、1:1、1:3、1:6的N2H4-Ne混合气在热分解反应过程中N2H4的转化率随时间的变化如图所示:

①n(N2H4):n(Ne)的比值越小,N2H4的平衡转化率越
②n(N2H4):n(Ne)=1:3所对应的曲线是
(4)肼(N2H4)又称联氨,溶于水可以发生与氨水类似的电离,是一种二元弱碱。肼溶于水的电离方程式为:
N2H4+H2O
 N2H
N2H +OH- Kb1=2×10-8
+OH- Kb1=2×10-8N2H
 +H2O
+H2O N2H
N2H +OH- Kb2=6×10-10
+OH- Kb2=6×10-10现将等浓度等体积的肼的水溶液与硫酸溶液混合,混合后生成的盐的化学式为
 =
=
您最近一年使用:0次
名校
2 . I、常温下,有浓度均为 的下列4种溶液:
的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③ 溶液 ④
溶液 ④ 溶液
溶液
(1)这4种溶液pH由大到小的顺序是______ (填序号)
(2)若分别向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____ ④(填“>”“<”或“=”)。
(3)向NaCN溶液中通入少量 ,则发生反应的离子方程式为
,则发生反应的离子方程式为______ 。
(4)泡沫灭火器中通常装有 溶液和
溶液和 溶液,请写出这两种溶液混合时反应的离子方程式:
溶液,请写出这两种溶液混合时反应的离子方程式:______ 。
(5)已知25℃时, 第一步水解的平衡常数
第一步水解的平衡常数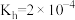 ,当溶液中
,当溶液中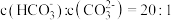 时,溶液的pH=
时,溶液的pH=________ 。
II、某同学用酸性 溶液测定绿矾产品中
溶液测定绿矾产品中 含量:请回答下列问题:
含量:请回答下列问题:
反应原理为: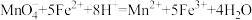 (
( 在溶液中为无色)
在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L 溶液滴定至终点
溶液滴定至终点
(6)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为_________ mL。

(7)此滴定实验达到终点的颜色变化为______ 。
(8)重复滴定4次,每次消耗酸性 标准溶液的体积如表所示:
标准溶液的体积如表所示:
计算上述样品中 的质量分数为
的质量分数为______ 。( ,
,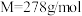 ,小数点后保留一位)
,小数点后保留一位)
(9)若滴定前平视读数,滴定终点时仰视读数,则所测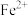 含量:
含量:______ 。(填“无影响”、“偏高”或“偏低”)。
 的下列4种溶液:
的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③
 溶液 ④
溶液 ④ 溶液
溶液| HCN |  |  |
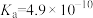 | 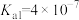 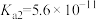 | 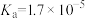 |
(2)若分别向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③
(3)向NaCN溶液中通入少量
 ,则发生反应的离子方程式为
,则发生反应的离子方程式为(4)泡沫灭火器中通常装有
 溶液和
溶液和 溶液,请写出这两种溶液混合时反应的离子方程式:
溶液,请写出这两种溶液混合时反应的离子方程式:(5)已知25℃时,
 第一步水解的平衡常数
第一步水解的平衡常数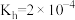 ,当溶液中
,当溶液中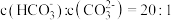 时,溶液的pH=
时,溶液的pH=II、某同学用酸性
 溶液测定绿矾产品中
溶液测定绿矾产品中 含量:请回答下列问题:
含量:请回答下列问题:反应原理为:
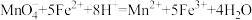 (
( 在溶液中为无色)
在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L
 溶液滴定至终点
溶液滴定至终点(6)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为

(7)此滴定实验达到终点的颜色变化为
(8)重复滴定4次,每次消耗酸性
 标准溶液的体积如表所示:
标准溶液的体积如表所示:| 第一次 | 第二次 | 第三次 | 第四次 | |
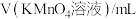 | 17.10 | 19.98 | 20.00 | 20.02 |
 的质量分数为
的质量分数为 ,
,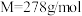 ,小数点后保留一位)
,小数点后保留一位)(9)若滴定前平视读数,滴定终点时仰视读数,则所测
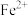 含量:
含量:
您最近一年使用:0次
3 . 均苯三甲酸是一种重要的有机三元弱酸,可表示为 。向
。向 的
的 溶液中加入
溶液中加入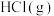 或
或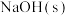 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:
已知:①[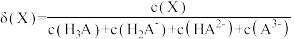 ,X为
,X为 、
、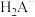 、
、 或
或 ]
]
②(
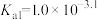 、
、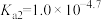 、
、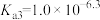 )
)
 。向
。向 的
的 溶液中加入
溶液中加入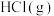 或
或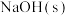 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:已知:①[
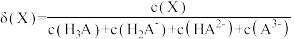 ,X为
,X为 、
、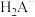 、
、 或
或 ]
]②(

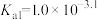 、
、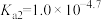 、
、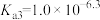 )
)
A.若用 滴定 滴定 至恰好生成 至恰好生成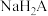 ,可选甲基橙做指示剂 ,可选甲基橙做指示剂 |
B.N点的 |
C.常温下,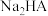 的水解常数 的水解常数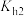 的数量级为 的数量级为 |
D.R点满足: |
您最近一年使用:0次
2022-11-25更新
|
1559次组卷
|
6卷引用:重庆市第一中学校2022-2023学年高二上期期中考试化学试题
名校
解题方法
4 . 常温下,向0.1mol•L-1的乙二胺(H2NCH2CH2NH2)溶液中不断通入HCl气体,溶液中三种含氮微粒的物质的量分数δ与pOH的关系图如图。已知:①乙二胺为无色液体,有类似氨的性质,常温下Kb1=10-4.07,Kb2=10-7.15;②假设溶液体积保持不变。下列说法中不正确 的是{已知:pOH=-lgc(OH-)}
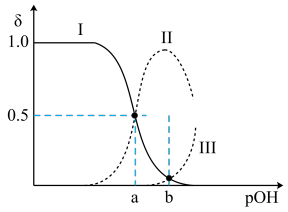

A.曲线Ⅱ代表的微粒符号为H2NCH2CH2NH |
| B.b点的对应pOH=5.61 |
| C.pOH=a时,c(Cl-)>0.05mol•L-1 |
| D.在0.1mol•L-1H2NCH2CH2NH3Cl溶液中:c([H2NCH2CH2NH3]+)>c([H3NCH2CH2NH3]2+)>c(H2NCH2CH2NH2) |
您最近一年使用:0次
2022-10-08更新
|
1169次组卷
|
2卷引用:浙江省浙南名校联盟2022-2023学年高三上学期第一次联考化学试题
解题方法
5 . 平衡常数是分析平衡问题的重要依据。回答下列问题:
(1)已知: 时,
时, 的
的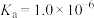 ,则
,则 时,
时, 的
的 溶液的
溶液的
_______ 。
(2)在温度为 时,某研究人员测定
时,某研究人员测定 的电离常数
的电离常数 为
为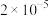 ,
, 的水解常数
的水解常数 为
为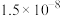 ,则该温度下水的离子积常数
,则该温度下水的离子积常数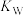 为
为_______ ,请判断
_______ (填“>”“<”或“=”) 。
。
(3)化工生产中常用 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 :
: 。该反应的平衡常数
。该反应的平衡常数 为
为_______ ( 和
和 的
的 分别为
分别为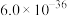 、
、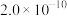 )。
)。
(4) 时,将
时,将 的氨水与
的氨水与 的盐酸等体积混合,所得溶液中
的盐酸等体积混合,所得溶液中 ,则溶液显
,则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离常数
的电离常数
_______ 。
(1)已知:
 时,
时, 的
的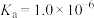 ,则
,则 时,
时, 的
的 溶液的
溶液的
(2)在温度为
 时,某研究人员测定
时,某研究人员测定 的电离常数
的电离常数 为
为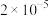 ,
, 的水解常数
的水解常数 为
为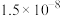 ,则该温度下水的离子积常数
,则该温度下水的离子积常数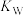 为
为
 。
。(3)化工生产中常用
 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 :
: 。该反应的平衡常数
。该反应的平衡常数 为
为 和
和 的
的 分别为
分别为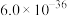 、
、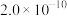 )。
)。(4)
 时,将
时,将 的氨水与
的氨水与 的盐酸等体积混合,所得溶液中
的盐酸等体积混合,所得溶液中 ,则溶液显
,则溶液显 的电离常数
的电离常数
您最近一年使用:0次
2022高三·全国·专题练习
6 . 甘氨酸 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、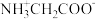 和
和 的分布分数【如
的分布分数【如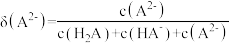 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是
 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、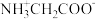 和
和 的分布分数【如
的分布分数【如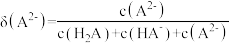 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是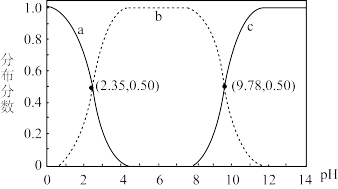
| A.甘氨酸具有两性 |
B.曲线c代表 |
C.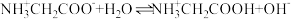 的平衡常数 的平衡常数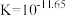 |
D.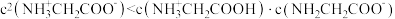 |
您最近一年使用:0次
2022-07-06更新
|
12721次组卷
|
32卷引用:专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编
(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市第二中学2022-2023学年高三上学期12月考化学试题(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题四 电解质溶液图象(练)(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)江苏省连云港市东海县2022-2023学年高二下学期期中考试化学试题(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)微专题(9) 利用图像判断溶液粒子浓度关系(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 第2课时 影响盐类水解的因素 水解原理的应用(已下线)微专题 水溶液中函数图像的分析第1讲 弱电解质的电离平衡(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖北省沙市中学2023-2024学年高三下学期3月月考化学试题吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题福建省宁化市第一中学2023-2024学年高三下学期3月质量检测化学试题
7 . 合成氨是目前人工固氮最重要的途径,对人类生存具有重大意义,反应为:
(1)N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ/mol。
2NH3(g) ∆H=-92.4kJ/mol。
①该反应在___________ (填“高温”“低温”或“任意温度”)下可自发进行。
我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
i. 3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
ii. Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-88kJ·mol-1
iii. LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
②则ΔH3=___________ 。
(2)为了研究反应的热效应,我国的科研人员计算了在一定范围内下列反应的平衡常数 。
。
i.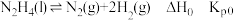
ii.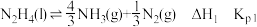
iii.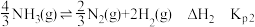
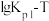 和
和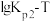 的线性关系图如下所示:
的线性关系图如下所示:

①由图可知ΔH1___________ 0(填“大于”或“小于”)。
②反应i的Kp0=______________ (用Kp1和Kp2表示)。
反应i的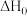
___________ 0(填“大于”或“小于”),写出推理过程_____________________ 。
(3)氨水可以吸收二氧化碳。已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=____ mol/L,将CO2通入氨水中使溶液恰好呈中性,则此时 =
=______ (保留小数点后4位数字)
(1)N2(g)+3H2(g)
 2NH3(g) ∆H=-92.4kJ/mol。
2NH3(g) ∆H=-92.4kJ/mol。①该反应在
我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
i. 3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
ii. Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-88kJ·mol-1
iii. LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
②则ΔH3=
(2)为了研究反应的热效应,我国的科研人员计算了在一定范围内下列反应的平衡常数
 。
。i.
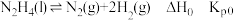
ii.
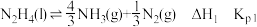
iii.
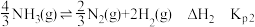
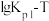 和
和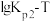 的线性关系图如下所示:
的线性关系图如下所示:
①由图可知ΔH1
②反应i的Kp0=
反应i的
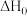
(3)氨水可以吸收二氧化碳。已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=
 =
=
您最近一年使用:0次
解题方法
8 . 在“水质研学行动”中,科学兴趣小组对某地矿泉水进行了检测。室温下,测得该水中p(X)与pOH关系如图所示[已知:p(X)=-lgc(X),X为H2CO3、 、
、 或Ca2+]。下列说法错误的是
或Ca2+]。下列说法错误的是

 、
、 或Ca2+]。下列说法错误的是
或Ca2+]。下列说法错误的是
| A.曲线③代表p(Ca2+)随pOH的变化 | B.该温度下,pH+ p( p( )=10.8 )=10.8 |
| C.该温度下的Ksp(CaCO3)=1×10-9.2 | D.当p(Ca2+)=6.1时,p( )=1.8 )=1.8 |
您最近一年使用:0次
9 . 常温下,向一定浓度的NaA溶液中加适量强酸或强碱(忽略溶液体积变化),溶液中 、
、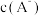 、
、 、
、 的负对数
的负对数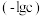 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是

 、
、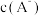 、
、 、
、 的负对数
的负对数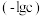 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是
A.曲线①表示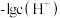 随溶液pH的变化情况 随溶液pH的变化情况 |
B.曲线①和曲线②的交点对应的溶液中存在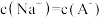 |
C.常温下,将A点对应溶液加水稀释,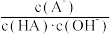 不变 不变 |
D.等物质的量浓度、等体积的NaA溶液与HA溶液混合后: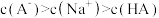 |
您最近一年使用:0次
2022-03-31更新
|
2750次组卷
|
6卷引用:广东省2021-2022学年高三下学期一模化学试题
广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)必刷卷02-2022年高考化学考前信息必刷卷(全国甲卷)(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)湖北省2022届高三5月联考化学试题(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题
10 . 已知:联氨(N2H4)是二元弱碱(pKb1=6,pKb2=15;pK=-lgK),在水中的电离方式类似于氨气,常温下,向0.1mol·L-1N2H5Cl溶液通入HCl或加入NaOH固体(假设溶液总体积不变),溶液中c(N2H )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是

 )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是
A.N2H5Cl溶液c(N2H )>c(N2H4)>c(N2H )>c(N2H4)>c(N2H ) ) |
| B.b点加入NaOH(或HCl)的物质的量与d点加入HCl(或NaOH)物质的量相等 |
| C.水的电离程度:b>a |
D.若c(N2H )>c(N2H4),则pH小于3.5 )>c(N2H4),则pH小于3.5 |
您最近一年使用:0次
2022-03-22更新
|
1387次组卷
|
3卷引用:山东省济南市2022届高三3月高考模拟考试(一模)化学试题



