1 . 室温下,向20mL含有0.10mol/LCr2+和0.10mol/LFe2+的混合溶液中滴加0.10mol/LNaOH溶液,金属阳离子的浓度与滴入NaOH溶液体积的关系如图所示。若溶液中金属阳离子浓度小于10-5mol/L可视为完全沉淀,则下列说法错误的是( )

已知:Ksp[Cr(OH)2]=2.0×10-16mol3/L3,Ksp[Fe(OH)2]=8.0×10-16mol3/L3

已知:Ksp[Cr(OH)2]=2.0×10-16mol3/L3,Ksp[Fe(OH)2]=8.0×10-16mol3/L3
| A.曲线A表示c(Fe2+)与NaOH溶液体积的关系 |
| B.当V(NaOH溶液)=30mL时,Cr2+开始沉淀 |
| C.当pH=7时,溶液中Fe2+、Cr2+均完全沉淀 |
| D.当V(NaOH溶液)>30mL时,溶液中c(Fe2+):c(Cr2+)=4 |
您最近一年使用:0次
2020-11-21更新
|
330次组卷
|
3卷引用:山西省长治市上党区一中2021-2022学年高二上学期10月月考化学试题
名校
解题方法
2 . 已知25℃时,AgCl的溶度积Ksp=1.8×10-10 mol2·L-2,则下列说法正确的是
| A.向饱和AgCl水溶液中加入盐酸, Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl沉淀析出 |
| D.在AgCl的悬浊液中加入Na2S溶液,AgCl转化为Ag2S,因为AgCl溶度积大于Ag2S |
您最近一年使用:0次
名校
3 . 下列方程式书写正确的是( )
A.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO |
B.H2SO3的电离方程式:H2SO3 2H++SO 2H++SO |
C.CO 的水解方程式:CO 的水解方程式:CO +H2O +H2O HCO HCO +OH- +OH- |
D.CaCO3沉淀溶解平衡方程式:CaCO3(s)= Ca2+(aq)+CO ( aq) ( aq) |
您最近一年使用:0次
2020-11-14更新
|
1182次组卷
|
14卷引用:山西省太原市第五中学2020-2021学年高二上学期12月阶段性检测化学试题
山西省太原市第五中学2020-2021学年高二上学期12月阶段性检测化学试题【校级联考】福建省“华安一中、长泰一中、南靖一中、平和一中、龙海二中”五校2018-2019学年高二上学期第二次联考化学试题福建省平和一中、南靖一中等五校2018-2019学年高二上学期第二次联考化学试题(已下线)第11单元 水溶液中的离子平衡(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷河南省焦作市博爱县英才学校2020-2021学年高二上学期11月月考化学试题黑龙江省哈尔滨工业大学附属中学2021届高三上学期期中考试化学试题福建省南安市侨光中学2020-2021学年高二上学期第二次阶段考化学试题河南省项城市第三高级中学2020-2021学年高二上学期第三次考试化学试题湖南省长沙市周南中学2020-2021学年高二上学期第三次月考化学试题吉林省长春市清蒲中学2020-2021学年度高二上学期期末化学试题重庆育才中学2021-2022学年高二上学期第四次定时练习化学试题福建省福州市协作体四校2021-2022学年高二上学期期末联考化学试题四川省绵阳市盐亭中学2021-2022学年高二下学期4月月考化学试题四川省绵阳市盐亭中学2021-2022学年高二下学期第三次月考化学试题
13-14高三下·山西·阶段练习
名校
4 . 某化学兴趣小组进行下列实验:
①将 的
的 溶液和
溶液和 的
的 溶液等体积混合得到浊液
溶液等体积混合得到浊液
②取少量①中浊液,滴加 的
的 溶液,出现红褐色沉淀
溶液,出现红褐色沉淀
③过滤①中浊液,取少量白色沉淀,滴加 的
的 溶液,白色沉淀变为红褐色沉淀
溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和 溶液,沉淀溶解
溶液,沉淀溶解
下列说法中错误的是( )
①将
 的
的 溶液和
溶液和 的
的 溶液等体积混合得到浊液
溶液等体积混合得到浊液②取少量①中浊液,滴加
 的
的 溶液,出现红褐色沉淀
溶液,出现红褐色沉淀③过滤①中浊液,取少量白色沉淀,滴加
 的
的 溶液,白色沉淀变为红褐色沉淀
溶液,白色沉淀变为红褐色沉淀④另取少量白色沉淀,滴加饱和
 溶液,沉淀溶解
溶液,沉淀溶解下列说法中错误的是( )
A.将①中浊液过滤,所得滤液中有微量的 存在 存在 |
B.实验②和③均能说明 比 比 难溶 难溶 |
C.③中沉淀转化反应式为: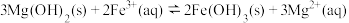 |
D. 溶液中的 溶液中的 水解可能是④中沉淀溶解的原因 水解可能是④中沉淀溶解的原因 |
您最近一年使用:0次
2020-11-06更新
|
921次组卷
|
14卷引用:2014届山西省山大附中高三下学期第一次月考化学试卷
(已下线)2014届山西省山大附中高三下学期第一次月考化学试卷山西省朔州市怀仁县大地学校2020-2021学年高二上学期第三次月考化学试题(已下线)2015届甘肃省天水市一中高三上学期第一学段考试化学试卷【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期末考试化学试题北京十二中2018-2019学年第二学期高二年级6月月考试题(已下线)专题8.4 难溶电解质的溶解平衡(讲)-《2020年高考一轮复习讲练测》四川省树德中学2020届高三11月月考化学试题江西省上高县第二中学2019-2020学年高二上学期第三次月考化学试题【懂做原理题】2020届高三化学选修4二轮专题练—— 浓度商及其应用【精编23题】四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)黑吉两省十校2020-2021学年高二上学期期中联考(其他8校用)化学试题(已下线)第28讲 难溶电解质的溶解平衡 (精讲)——2021年高考化学一轮复习讲练测(已下线)3.4.1 难溶电解质的沉淀溶解平衡(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)黑龙江省绥化市一中2020-2021学年度高二上学期第三次月考化学试题
名校
解题方法
5 . 已知:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________ 。
(2)要使0.2mol·L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为___ 。
 Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。(1)某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于
(2)要使0.2mol·L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
您最近一年使用:0次
2020-06-18更新
|
255次组卷
|
13卷引用:山西省应县第一中学校2019-2020学年高二上学期第四次月考化学试题
山西省应县第一中学校2019-2020学年高二上学期第四次月考化学试题(已下线)2011-2012学年陕西省西安市第一中学高二上学期期末考试化学(理)试卷(已下线)2011—2012学年福建省漳州市芗城中学高二上学期期末考试化学试卷(已下线)2011-2012年江苏宿迁泗洪县洪翔中学高二下学期期中考试化学试卷(已下线)2012年人教版高中化学选修4 3.4难溶电解质的溶解平衡练习卷(已下线)2014高考名师推荐化学Ksp的计算及有关图像的分析2015-2016学年山东省寿光现代中学高二下开学测化学试卷2015-2016学年青海师大附属二中高二下4月月考化学试卷(已下线)2018年11月14日 《每日一题》人教选修4-溶度积的有关计算宁夏贺兰县景博中学2019-2020学年高二上学期第二次月考化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年高二上学期第三次月考化学试题
解题方法
6 . 某研究性学习小组为研究水垢的生成,查得CaCO3和Mg(OH)2溶解度曲线如图所示。已知:40°C时,Ksp(MgCO3)=7×10-6,下列有关分析错误的是( )
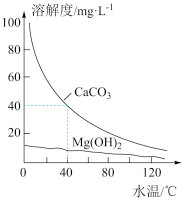

| A.CaCO3、Mg(OH)2溶解均放热 |
| B.MgCl2溶液中加入少量CaCO3粉末加热搅拌,有Mg(OH)2生成 |
| C.含有Ca(HCO3)2和Mg(HCO3)2的自来水长时间加热,水垢的主要成分为CaCO3和MgCO3 |
| D.40℃时,Ksp(CaCO3)=1.6×10-7 |
您最近一年使用:0次
7 . 25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10—10),下列说法正确的是
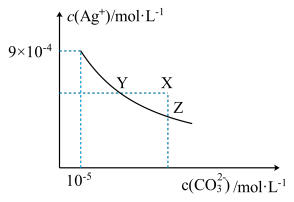

| A.根据图示可计算出Ksp(Ag2CO3)=9×10—9 |
| B.向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点 |
C.反应Ag2CO3(s)+2Cl—(aq) 2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108 2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108 |
| D.将0.001mol/LAgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CO3的混合溶液,CO32—先沉淀 |
您最近一年使用:0次
名校
8 . 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是
①20mL 0.01mol·L-1 KCl溶液 ②30mL 0.02mol·L-1 CaCl2溶液③40mL 0.03mol·L-1 HCl溶液
①20mL 0.01mol·L-1 KCl溶液 ②30mL 0.02mol·L-1 CaCl2溶液③40mL 0.03mol·L-1 HCl溶液
| A.①>③>② | B.①>②>③ | C.②>①>③ | D.③>②>① |
您最近一年使用:0次
2020-04-28更新
|
85次组卷
|
4卷引用:山西省汾阳市2020-2021学年高二上学期期末考试化学试题
名校
解题方法
9 . 某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法不正确的是
(已知:Ksp(ZnS)=3×10-25mol2/L2)
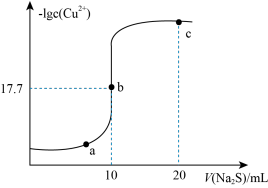
(已知:Ksp(ZnS)=3×10-25mol2/L2)

| A.a、b、c三点中,水的电离程度最大的为b点 |
| B.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+) |
| C.该温度下Ksp(CuS)=10-35.4 mol2/L2 |
| D.向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Cu2+先沉淀 |
您最近一年使用:0次
2020-03-27更新
|
304次组卷
|
3卷引用:山西省运城市2019-2020学年高二上学期期末调研测试化学试题
名校
解题方法
10 . 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是( )
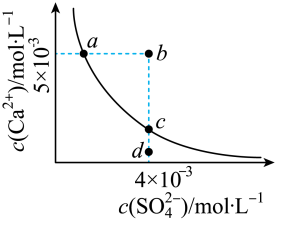

| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.向d点溶液中加入适量CaCl2固体可以变到c点 |
| C.a点对应的Ksp不等于c点对应的Ksp |
| D.b点将有沉淀生成,平衡后溶液中c(SO42-)=3×10-3mol/L |
您最近一年使用:0次



