1 . 羰基硫是一种粮食熏蒸剂,能防治某些害虫和真菌的危害,利用CO等制备羰基硫原理:CO+H2S⇌COS+H2。
(1)用FeOOH作催化剂,CO(g)+H2S(g)⇌COS(g)+H2(g)的反应分两步进行,其反应过程能量变化如图1所示。
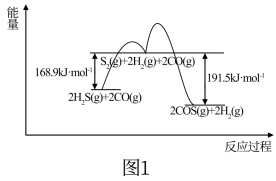
①CO(g)+H2S(g)⇌COS(g)+H2(g) △H=___________ 。
②决定COS生成速率的主要步骤是___________ (填“第1步”或“第2步”)。
(2)在2L的密闭容器中,保持温度不变,开始投入9molH2S和amolCO,经10min达到平衡,Kp=0.2(Kp为以分压表示的平衡常数),n(H2S)=5mol,则CO的平衡转化率α=___________ 。
(3)在2L的密闭容器中,开始时投入amolCO和1molH2S,图2中曲线I和II表示某温度下,CO和H2S投料比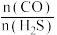 不同时,CO转化率随时间变化关系,则曲线I和II中a值的大小关系为:I
不同时,CO转化率随时间变化关系,则曲线I和II中a值的大小关系为:I___________ II(填“>”“<”或“=”),理由是___________ 。
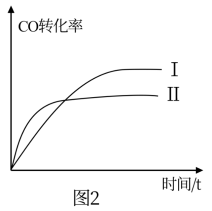
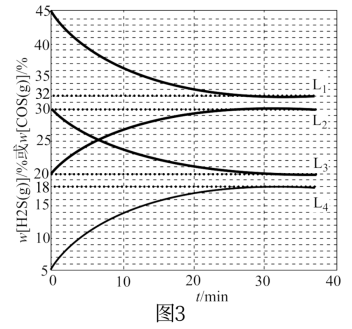
(4)已知起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等,在240℃时该反应平衡常数K=1,在300℃、340℃时反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图3所示。则300℃时,ω[COS(g)]随时间变化的曲线为___________ ,340℃时,ω[H2S(g)]随时间变化的曲线为___________ 。
(5)羰基硫在水存在时会缓慢水解生成H2S,会使钢铁设备发生析氢腐蚀,则其正极的电极反应式为___________ ,负极的反应产物为___________ (填化学式)。
(1)用FeOOH作催化剂,CO(g)+H2S(g)⇌COS(g)+H2(g)的反应分两步进行,其反应过程能量变化如图1所示。

①CO(g)+H2S(g)⇌COS(g)+H2(g) △H=
②决定COS生成速率的主要步骤是
(2)在2L的密闭容器中,保持温度不变,开始投入9molH2S和amolCO,经10min达到平衡,Kp=0.2(Kp为以分压表示的平衡常数),n(H2S)=5mol,则CO的平衡转化率α=
(3)在2L的密闭容器中,开始时投入amolCO和1molH2S,图2中曲线I和II表示某温度下,CO和H2S投料比
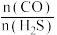 不同时,CO转化率随时间变化关系,则曲线I和II中a值的大小关系为:I
不同时,CO转化率随时间变化关系,则曲线I和II中a值的大小关系为:I
(4)已知起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等,在240℃时该反应平衡常数K=1,在300℃、340℃时反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图3所示。则300℃时,ω[COS(g)]随时间变化的曲线为

(5)羰基硫在水存在时会缓慢水解生成H2S,会使钢铁设备发生析氢腐蚀,则其正极的电极反应式为
您最近一年使用:0次
名校
2 . 用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。下列说法不正确的是
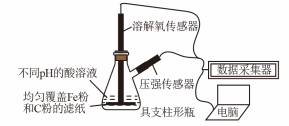
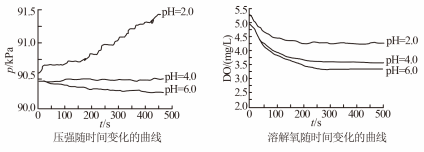


| A.压强增大主要是因为产生了H2 |
| B.整个过程中,负极电极反应式均为:Fe–2e- = Fe2+ |
| C.pH= 4.0时,体系为弱酸性,同时发生析氢腐蚀和吸氧腐蚀 |
| D.pH= 2.0时,体系为强酸性,正极只发生析氢腐蚀,电极方程式为:2H+ + 2e- = H2↑ |
您最近一年使用:0次
2021-11-26更新
|
1446次组卷
|
6卷引用:重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题
重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题湖北省武汉市华中师范大学第一附属中学2021-2022学年高一下学期期中考试化学试题福建省厦门市厦门双十中学2021-2022学年上学期期中考试化学试题(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)周末培优4 新型电池的电化学原理问题-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第四单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)
名校
3 . 按如图所示装置进行下列不同的操作,其中不正确的是
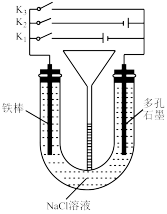

| A.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降 |
| B.只接通K1,一段时间后,U形管中出现白色沉淀 |
| C.只接通K2,U形管左、右两端液面均下降 |
| D.铁腐蚀的速率由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2 |
您最近一年使用:0次
2021-08-26更新
|
701次组卷
|
6卷引用:黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
4 . 某同学做如下实验,下列说法正确的是
| 装置 | 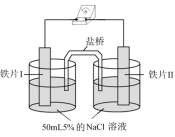 | 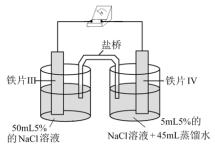 |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
| A.“电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀 |
| B.铁片IV的电极反应式为Fe-3e-=Fe3+ |
| C.铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等 |
| D.用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极 |
您最近一年使用:0次
2021-02-05更新
|
438次组卷
|
3卷引用:江西省师范大学附属中学2021-2022学年高二上学期期末化学试题
名校
解题方法
5 . 青铜器在潮湿环境中发生电化学腐蚀原理如图所示:多孔催化层中的Cl-扩散到孔口,与电极产物作用生成多孔粉状锈Cu2(OH)3Cl,下列说法正确的是( )
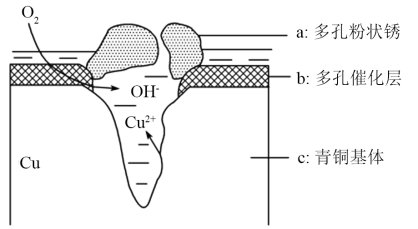

| A.此过程为电化学腐蚀中的析氢腐蚀 |
| B.电极b发生的反应:O2+4e-+2H2O=4OH- |
| C.生成Cu2(OH)3Cl的反应:2Cu2++3H2O+Cl-=Cu2(OH)3Cl↓+3H+ |
| D.若采用牺牲阳极的阴极保护法保护青铜器是利用了电解的原理 |
您最近一年使用:0次
2020-11-19更新
|
1171次组卷
|
4卷引用:黑龙江省友谊县高级中学2022-2023学年高二上学期期末考试(新教材)化学试题
6 . 食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧过程与电化学知识相关。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长食品保质期 |
| B.脱氧过程中炭作原电池正极,电极反应为:4H++O2+4e-=2H2O |
| C.含有0.56 g铁粉的脱氧剂,理论上最多能吸收氧气168 mL(标准状况) |
| D.该过程实现了电能到化学能的转化 |
您最近一年使用:0次
2020-11-18更新
|
731次组卷
|
6卷引用:江苏省丹阳高级中学2021-2022学年高二下学期期初考试化学试题
江苏省丹阳高级中学2021-2022学年高二下学期期初考试化学试题河北省张家口市第一中学2021届高三上学期期中考试(衔接班)化学试题(已下线)练习10 金属的腐蚀与防护-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)广东省广州市第六中学2022届高三第二次月考化学试题江苏省苏州市相城区陆慕高级中学2021-2022学年高二上学期第一次月考化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题1-5)
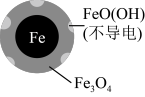
7 . 用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。
(1)Fe还原水体中 的反应原理如图所示。
的反应原理如图所示。

①作负极的物质化学式为___________ 。
②正极的电极反应式是_____________ 。
(2)将足量铁粉投入水体中,经24小时测定 的去除率和pH,结果如下:
的去除率和pH,结果如下:
pH=4.5时, 的去除率低。其原因是
的去除率低。其原因是_________________ 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高 的去除率。对Fe2+的作用提出两种假设:
的去除率。对Fe2+的作用提出两种假设:
I.Fe2+直接还原 ;
;
II.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________ 。
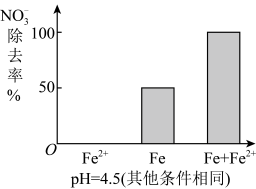
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________ ,解释加入Fe2+提高 去除率的原因:
去除率的原因:___________ 。
 )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。(1)Fe还原水体中
 的反应原理如图所示。
的反应原理如图所示。
①作负极的物质化学式为
②正极的电极反应式是
(2)将足量铁粉投入水体中,经24小时测定
 的去除率和pH,结果如下:
的去除率和pH,结果如下:初始pH | pH=2.5 | pH=4.5 |
| 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
 的去除率低。其原因是
的去除率低。其原因是(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高
 的去除率。对Fe2+的作用提出两种假设:
的去除率。对Fe2+的作用提出两种假设:I.Fe2+直接还原
 ;
;II.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是
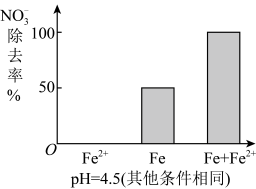
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为
 去除率的原因:
去除率的原因:
您最近一年使用:0次
19-20高二下·北京海淀·期末
名校
8 . 下列图示内容的对应说明正确的是
| 编号 | A | B | C | D |
| 图示 | 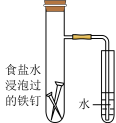 食盐水 |  片刻后在Fe 电极附近滴入K3[Fe(CN)6]溶液 | 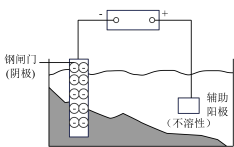 |  |
| 说明 | 验证铁钉发生 吸氧腐蚀 | 验证 Fe 电极被保护 | 该装置是牺牲阳极的阴极保护法 | 该化学反应为放热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-04更新
|
430次组卷
|
4卷引用:专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)北京市八一学校2019-2020学年高二下学期期末考试化学试题模拟卷03(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)
名校
解题方法
9 . 有关下列说法中,正确的是
| A.用标准盐酸滴定未知浓度的NaOH溶液,滴定前酸式滴定管尖嘴有气泡未排出,滴定后气泡消失,会造成测定结果偏低 |
| B.工业废水中的Cu2+、Hg2+等重金属阳离子可以通过加入FeS除去 |
| C.工业上常在铁板表面镀上一层锡(俗称马口铁)来防止铁板表面破损后发生电化学腐蚀 |
| D.等体积的pH均为2的酸HA和HB的溶液分别与足量的铁粉反应,HA放出的H2多,说明HA酸性强 |
您最近一年使用:0次
2020-01-24更新
|
388次组卷
|
4卷引用:山东省淄博市高青县第一中学2021-2022学年高二下学期开学收心考试化学试题
山东省淄博市高青县第一中学2021-2022学年高二下学期开学收心考试化学试题山东省济宁市2019-2020学年高二上学期期末考试化学试题湖北省恩施土家族苗族自治州高级中学2019-2020学年高二下学期第二次双周考试化学试题(已下线)练习10 金属的腐蚀与防护-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)
名校
10 . 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和_______ 。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
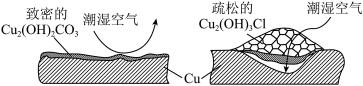
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因_____________ 。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:
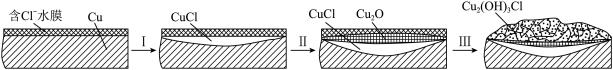
① 过程Ⅰ的正极反应物是___________ 。
② 过程Ⅰ负极的电极反应式是_____________ 。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:
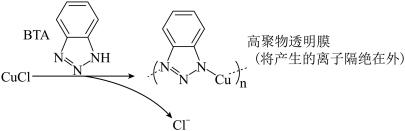
请回答下列问题:
①写出碳酸钠法的离子方程式___________________ 。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________ 。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:

Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:

① 过程Ⅰ的正极反应物是
② 过程Ⅰ负极的电极反应式是
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
您最近一年使用:0次
2019-06-11更新
|
1879次组卷
|
7卷引用:福建省泉州市第六中学2022-2023学年高二上学期期中考化学试题