1 . 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):

已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)B→C的反应类型为___________ ,C中含氧官能团的名称为___________ ,C分子是否为手性分子:___________ (填“是”或“否”)。
(2)已知: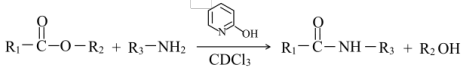 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小 解释原因___________ 。
(3)E→F过程中,反应i的化学方程式为:___________ 。
(4)J的结构简式为___________ ,其中氮原子的杂化轨道类型为___________ 。
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式___________ 。
i.含有3个六元环,其中1个是苯环;
ii.含有 结构,不含
结构,不含 键;
键;
iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①________ ;②_________ ;③___________ 。


已知:无水乙酸钠在碱石灰作用下发生反应:

回答下列问题:
(1)B→C的反应类型为
(2)已知:
 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间| 元素 | H | C | O |
| 电负性 | 2.1 | 2.5 | 3.5 |
(3)E→F过程中,反应i的化学方程式为:
(4)J的结构简式为
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式
i.含有3个六元环,其中1个是苯环;
ii.含有
 结构,不含
结构,不含 键;
键;iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①

您最近一年使用:0次
名校
解题方法
2 . 下列叙述正确的是
| A.第三能层某能级的符号为3f |
| B.同一能层中的不同能级的能量高低相同 |
| C.每个能层最多可容纳的电子数是2n2 |
| D.3d能级最多容纳5个电子 |
您最近一年使用:0次
2024-03-28更新
|
94次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
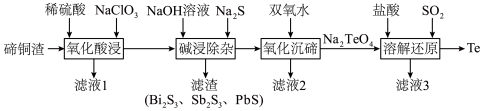
3 . 碲具有独特的理化性质,被广泛应用于军工、航天、石油化工、冶金等领域。从碲铜渣[主要成分为 ,含Bi(Ⅲ)、Sb(Ⅲ)、Pb(Ⅱ)、Se等杂质]中分离提纯碲的一种流程如下图所示。
,含Bi(Ⅲ)、Sb(Ⅲ)、Pb(Ⅱ)、Se等杂质]中分离提纯碲的一种流程如下图所示。
回答下列问题:
(1)“氧化酸浸”时,
 发生反应生成难溶的
发生反应生成难溶的 ,该反应的化学方程式为
,该反应的化学方程式为(2)已知“碱浸除杂”所得浸出液中硒和碲的化合价相同,“氧化沉碲”的目的是利用钠盐的溶解性差异分离硒和碲,推测滤液2中硒的存在形式是
 表面吸附的杂质,将其置于氢氧化钠溶液中进行常温漂洗,漂洗液与滤液2合并,经煮沸后可返回上述流程中的
表面吸附的杂质,将其置于氢氧化钠溶液中进行常温漂洗,漂洗液与滤液2合并,经煮沸后可返回上述流程中的(3)
 在“溶解还原”工序中生成单质Te的总反应的离子方程式为
在“溶解还原”工序中生成单质Te的总反应的离子方程式为(4)滤液1、2、3中,含铜量较高,可用于回收铜的是
(5)碲是第五周期氧族元素,其基态原子的价层电子排布式为
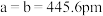 、
、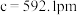 ,
, ,
,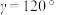 ,碲晶体的密度为
,碲晶体的密度为 (列出计算式即可)。
(列出计算式即可)。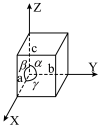
您最近一年使用:0次
4 . 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的电子排布式为_______ 。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是_______ 分子(填“极性”或“非性极”)。
(3) 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
(4)如图所示的化合物,中心离子的配位数为_______ 。
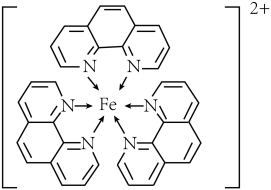
(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:_______ 。
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为_______ ;已知晶胞边长为a pm,阿伏加德罗常数的值为 ,该晶胞密度
,该晶胞密度 为
为_______  (只列出计算式)。
(只列出计算式)。

(1)基态Ge原子的电子排布式为
(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是(3)
 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)如图所示的化合物,中心离子的配位数为

(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为 ,该晶胞密度
,该晶胞密度 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
名校
解题方法
5 . 最近合成的一种铁基超导材料 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
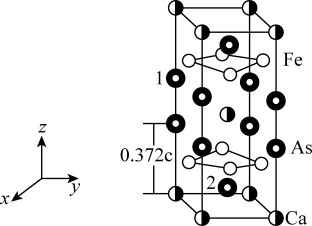
(1)Fe的基态原子共有_______ 种不同能级的电子。
(2) 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是_______ 。
(3)Fe可以与CO、NO、 等多种微粒形成配合物。
等多种微粒形成配合物。
①C、N、O的第一电离能由大到小的顺序为_______ 。
②写出 的一种等电子体分子
的一种等电子体分子_______ 。
(4) 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有_______ ,溶质阴离子的中心原子杂化轨道类型为_______ 。
(5)该材料的化学式为_______ ,已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为a pm、a pm、c pm,晶胞中As原子1分数坐标为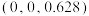 ,则As原子2的分数坐标为
,则As原子2的分数坐标为_______ 。
 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有
(2)
 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是(3)Fe可以与CO、NO、
 等多种微粒形成配合物。
等多种微粒形成配合物。①C、N、O的第一电离能由大到小的顺序为
②写出
 的一种等电子体分子
的一种等电子体分子(4)
 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有(5)该材料的化学式为
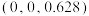 ,则As原子2的分数坐标为
,则As原子2的分数坐标为
您最近一年使用:0次
2022-11-13更新
|
104次组卷
|
2卷引用:福建省宁德市2022-2023学年高三上学期期中区域性学业质量检测化学试题
名校
解题方法
6 . 铜及其合金广泛应用于生活生产中。如黄铜合金可作首饰、镀层等。请回答下列问题:
(1)基态铜原子价电子排布式为___________ 。
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
① 中N原子的杂化类型是
中N原子的杂化类型是___________ ;NH3分子的立体构型是___________ 。
②[Cu(NH3)4]2+中提供孤对电子的基态原子有___________ 个未成对电子。1 mol该阳离子含有的σ键数目为___________
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是___________ ,NH3的沸点比NF3___________ ( 选填“高”或“低”),原因是___________ 。
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:
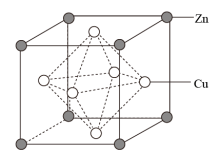
已知:晶胞参数为a nm。
①合金中粒子间作用力类型是___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
③黄铜合金晶体密度为___________ g·cm-3。(设NA为阿伏加德罗常数的值)
(1)基态铜原子价电子排布式为
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
①
 中N原子的杂化类型是
中N原子的杂化类型是②[Cu(NH3)4]2+中提供孤对电子的基态原子有
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

已知:晶胞参数为a nm。
①合金中粒子间作用力类型是
②与Cu原子等距离且最近的Cu原子有
③黄铜合金晶体密度为
您最近一年使用:0次
2021-12-31更新
|
586次组卷
|
3卷引用:云南省景东彝族自治县第一中学2022-2023学年高二下学期期末考试化学试题
名校
解题方法
7 . Fe、Co、Ni是第四周期的重要的金属元素,回答下列问题:
(1)FeCoOx是一种新型光电催化剂,第四电离能大小关系是I4(Fe)_____ I4(Co)(填“>”“<”或“=”),原因是____________________ 。
(2)二茂铁是一种具有芳香族性质的有机过渡金属化合物。其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯可用于制备二茂铁。
①环戊二烯中碳原子的杂化方式为____________
②1mol环戊二烯中有__________ molσ键。
(3)①FeS2晶体的晶胞如图甲所示。已知其晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,晶胞边长__________ nm。
②该晶胞中Fe2+位于S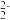 所形成的正八面体的体心,则正八面体的边长为
所形成的正八面体的体心,则正八面体的边长为______ nm
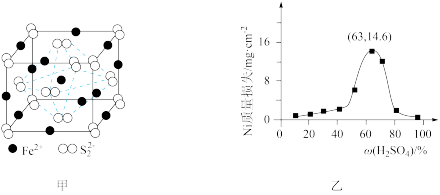
(4)基态Ni2+的价电子排布图为________ 。在一定温度下将Ni片与不同质量分数的硫酸反应,4h后的Ni的质量损失情况如图乙所示,发现当硫酸质量分数大于63%时Ni被腐蚀的速率逐渐降低,其可能原因为__________________ 。
(1)FeCoOx是一种新型光电催化剂,第四电离能大小关系是I4(Fe)
(2)二茂铁是一种具有芳香族性质的有机过渡金属化合物。其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯可用于制备二茂铁。
①环戊二烯中碳原子的杂化方式为
②1mol环戊二烯中有
(3)①FeS2晶体的晶胞如图甲所示。已知其晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,晶胞边长
②该晶胞中Fe2+位于S
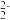 所形成的正八面体的体心,则正八面体的边长为
所形成的正八面体的体心,则正八面体的边长为
(4)基态Ni2+的价电子排布图为
您最近一年使用:0次
名校
解题方法
8 . I.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_________ 。
(2)Li及其周期表中相邻元素的第一电离能(I1),I1(Li)> I1(Na),原因是_________ 。
Ⅱ.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
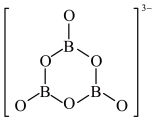
(3)NH3BH3分子中,N—B化学键称为________ 键,其电子对由_______ 提供。氨硼烷在催化剂作用下水解释放氢气: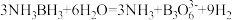 ,
,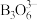 的结构如图所示:
的结构如图所示:
在该反应中,B原子的杂化轨道类型由________ 变为__________ 。
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________ 。
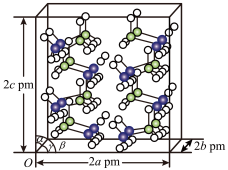
(5)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ=______ g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为
(2)Li及其周期表中相邻元素的第一电离能(I1),I1(Li)> I1(Na),原因是
Ⅱ.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
(3)NH3BH3分子中,N—B化学键称为
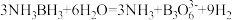 ,
,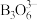 的结构如图所示:
的结构如图所示:
在该反应中,B原子的杂化轨道类型由
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
(5)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ=

您最近一年使用:0次
2020-11-02更新
|
391次组卷
|
2卷引用:云南省红河州2021届高中毕业生第一次复习统一检测理综化学试题
解题方法
9 . 南京大学某科研团队成功预测并首次大面积合成纳米多孔Cu-Al合金催化剂材料,实现高效率和大产率的电催化还原二氧化碳(CO2)生产乙烯(C2H4)。回答下列问题:
(1)Al元素在周期表中位于________ 区,基态Cu原子的价电子排布式为________ 。
(2)CO2和C2H4中C原子杂化方式分别为________ ,物质的量相同的CO2和C2H4所含σ键数之比为________ 。
(3)Cu(OH)2溶于浓氨水形成无色的配离子[Cu(NH3)4]2+,该配离子中配体的立体构型为________ 。
(4)工业冶炼铝需要冰晶石,AlF3或NaF均可用于制备冰晶石,AlF3和NaF两种晶体熔点更高的是________ (填写化学式),从结构的角度解释可能的原因________ 。
(5)Cu与O构成的某种化合物,其晶胞结构如图所示:
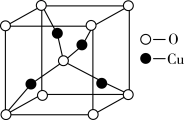
已知该晶胞参数为apm,阿伏加 德罗常数的数值为NA,则该晶体的密度ρ=________ g•cm-3(列出计算式即可)。
(1)Al元素在周期表中位于
(2)CO2和C2H4中C原子杂化方式分别为
(3)Cu(OH)2溶于浓氨水形成无色的配离子[Cu(NH3)4]2+,该配离子中配体的立体构型为
(4)工业冶炼铝需要冰晶石,AlF3或NaF均可用于制备冰晶石,AlF3和NaF两种晶体熔点更高的是
(5)Cu与O构成的某种化合物,其晶胞结构如图所示:

已知该晶胞参数为apm,阿伏加 德罗常数的数值为NA,则该晶体的密度ρ=
您最近一年使用:0次
名校
解题方法
10 . 近日,某科研团队成功合成了Ni—Fe双原子催化剂(Ni/Fe—C—N),并应用于高效催化CO2还原。回答下列问题:
(1)基态铁原子的价电子轨道排布图为__ 。铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+__ Fe3+(填“>”或“<”),原因是__ 。
(2)C、N、O三种元素的第一电离能由大到小的顺序为__ 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与CO提供配位的电子总数之和为18,则n=___ ;该化合物易溶于苯及四氯化碳等有机溶剂,原因是___ 。
(4)二茂铁的结构为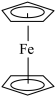 ,由Fe2+和
,由Fe2+和 (环戊二烯基负离子)构成。一个
(环戊二烯基负离子)构成。一个 中σ键总数为
中σ键总数为__ ,C原子的杂化轨道类型为__ 。
(5)某C、Fe合金的晶胞结构如图所示:
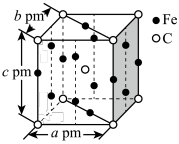
该合金的化学式为__ ,若该晶体的晶胞参数为apm、bpm、cpm,α=β=γ=90o,密度为ρg·cm-3,则NA为__ (写出计算式即可)。
(1)基态铁原子的价电子轨道排布图为
(2)C、N、O三种元素的第一电离能由大到小的顺序为
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与CO提供配位的电子总数之和为18,则n=
(4)二茂铁的结构为
 ,由Fe2+和
,由Fe2+和 (环戊二烯基负离子)构成。一个
(环戊二烯基负离子)构成。一个 中σ键总数为
中σ键总数为(5)某C、Fe合金的晶胞结构如图所示:

该合金的化学式为
您最近一年使用:0次
2020-06-18更新
|
378次组卷
|
2卷引用:云南省昆明市2020届高三“三诊一模”高考模拟考试(三模)理综化学试题



