解题方法
1 . 坦桑石是一种世界公认的新兴宝石,这种宝石于1967年首次在赤道雪山脚下的阿鲁沙地区被发现。坦桑石的主要化学成分为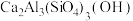 ,还可含有V、Cr、Mn等元素。
,还可含有V、Cr、Mn等元素。
 下列状态的铝中,电离最外层的一个电子所需能量最大的是
下列状态的铝中,电离最外层的一个电子所需能量最大的是________  填序号
填序号 。
。
①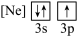 ②
②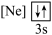 ③
③ ④
④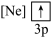
 烟酸铬是铬的一种化合物,其合成过程如下:
烟酸铬是铬的一种化合物,其合成过程如下:
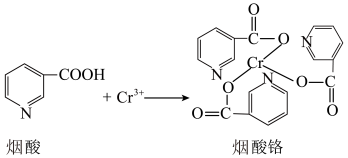
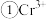 核外电子排布式为
核外电子排布式为________ 。
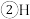 、C、N、O的电负性由大到小的顺序是
、C、N、O的电负性由大到小的顺序是_________ 。
 烟酸中碳、氮原子的杂化方式分别为
烟酸中碳、氮原子的杂化方式分别为________ 、________ 。
 分子中的大
分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数
键的电子数 如二氧化碳分子中的大
如二氧化碳分子中的大 键可表示为
键可表示为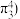 ,则烟酸中的大
,则烟酸中的大 键应表示为
键应表示为___________ 。
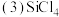 、
、 都极易水解。
都极易水解。 、
、 都属于
都属于______  填“极性”或“非极性”
填“极性”或“非极性” 分子,其熔点的关系为
分子,其熔点的关系为
________  填“
填“ ”“
”“ ”或“
”或“ ”
”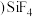 。
。
 将Mn掺入GaAs晶体
将Mn掺入GaAs晶体 图甲
图甲 可得到稀磁性半导体材料
可得到稀磁性半导体材料 图乙
图乙 ,图甲、图乙晶体结构不变。
,图甲、图乙晶体结构不变。
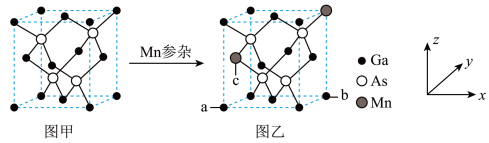
 图乙中a点和b点的原子坐标参数分别为
图乙中a点和b点的原子坐标参数分别为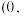 0,
0, 和
和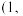 1,
1, ,则c点的原子坐标参数为
,则c点的原子坐标参数为________ 。
 设图甲晶体的密度为
设图甲晶体的密度为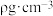 ,用
,用 表示阿伏加 德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为
表示阿伏加 德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________ pm。
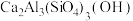 ,还可含有V、Cr、Mn等元素。
,还可含有V、Cr、Mn等元素。  下列状态的铝中,电离最外层的一个电子所需能量最大的是
下列状态的铝中,电离最外层的一个电子所需能量最大的是 填序号
填序号 。
。①
 ②
②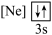 ③
③ ④
④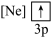
 烟酸铬是铬的一种化合物,其合成过程如下:
烟酸铬是铬的一种化合物,其合成过程如下:
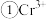 核外电子排布式为
核外电子排布式为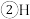 、C、N、O的电负性由大到小的顺序是
、C、N、O的电负性由大到小的顺序是 烟酸中碳、氮原子的杂化方式分别为
烟酸中碳、氮原子的杂化方式分别为 分子中的大
分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数
键的电子数 如二氧化碳分子中的大
如二氧化碳分子中的大 键可表示为
键可表示为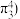 ,则烟酸中的大
,则烟酸中的大 键应表示为
键应表示为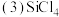 、
、 都极易水解。
都极易水解。 、
、 都属于
都属于 填“极性”或“非极性”
填“极性”或“非极性” 分子,其熔点的关系为
分子,其熔点的关系为
 填“
填“ ”“
”“ ”或“
”或“ ”
”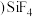 。
。 将Mn掺入GaAs晶体
将Mn掺入GaAs晶体 图甲
图甲 可得到稀磁性半导体材料
可得到稀磁性半导体材料 图乙
图乙 ,图甲、图乙晶体结构不变。
,图甲、图乙晶体结构不变。
 图乙中a点和b点的原子坐标参数分别为
图乙中a点和b点的原子坐标参数分别为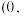 0,
0, 和
和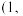 1,
1, ,则c点的原子坐标参数为
,则c点的原子坐标参数为 设图甲晶体的密度为
设图甲晶体的密度为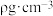 ,用
,用 表示阿伏加 德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为
表示阿伏加 德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为
您最近一年使用:0次
解题方法
2 . 天宫二号空间实验室于2016年9月15 日在酒泉卫星发射中心发射成功。实验室承载了10余项太空实验,其中包含了好比科幻英雄“综合材料”多晶碲化锌(ZnTe)的实验。
(1)电负性Zn___________ Te(填“>”或“<”或“=”)。
(2)O、S、Se与Te元素位于同一主族。基态碲(Te)原子核外电子排布式为[Kr]________ ,有_______ 个未成对电子。
(3)H2O、H2S、H2Se沸点由低到高顺序为______ ,推断的依据是_______ ;SO2分子中S原子采取_____ 杂化;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是____________ 。
(4)向氯化锌溶液中加入过量的氨水,得到[Zn(NH3)4]Cl2,此配位化合物中含有的化学键有共价键、____ 、_______ 。
(5)碲化锌晶体有两种结构,其中一种晶胞结构如下图:
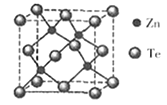
晶胞中含有_____ 个Te原子;与Te原子距离最近的Te原子有______ 个;若两个距离最近的Te原子间距为apm.则晶体密度为_________ g/cm3。
(1)电负性Zn
(2)O、S、Se与Te元素位于同一主族。基态碲(Te)原子核外电子排布式为[Kr]
(3)H2O、H2S、H2Se沸点由低到高顺序为
(4)向氯化锌溶液中加入过量的氨水,得到[Zn(NH3)4]Cl2,此配位化合物中含有的化学键有共价键、
(5)碲化锌晶体有两种结构,其中一种晶胞结构如下图:

晶胞中含有
您最近一年使用:0次
解题方法
3 . (1) 写出镍原子的电子排布式_____________ 。
(2) 丙酮(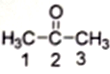 )分子中2号碳原子的杂化方式为
)分子中2号碳原子的杂化方式为__________ ;与CS2互为等电子体的阴离子是__________ (写一种)。
(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成_______ molAgCl沉淀。H2O分子的键角比H2S分子的键角大,原因是_______ 。
(4) 由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
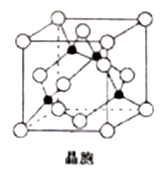
①该晶体的化学式为_______ 。
②将晶胞内的4个黑点相互连接所形成的立体构型是_______ 。
③晶体中与一个氯原子距离最近的氯原子有_______ 个。
④已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为_______ pm(列出计算式即可)。
(2) 丙酮(
 )分子中2号碳原子的杂化方式为
)分子中2号碳原子的杂化方式为(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成
(4) 由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。

①该晶体的化学式为
②将晶胞内的4个黑点相互连接所形成的立体构型是
③晶体中与一个氯原子距离最近的氯原子有
④已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次



