解题方法
1 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(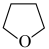 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: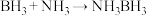 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
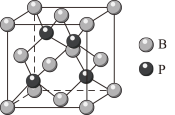
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: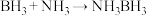 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
名校
解题方法
2 . 自然界中不存在氟的单质,得到单质氟的过程中,不少科学家为此献出了宝费的生命。1886年,法国化学家莫瓦桑发明了莫氏电炉,用电解法成功地制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有_______ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为_______ 。
(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为_______ 。
②S、P、Si的第一电离能由大到小的顺序为_______ 。
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为_______ 。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为_______ ,工业上不用电解AlCl3制取铝的原因为_______ 。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为
②S、P、Si的第一电离能由大到小的顺序为
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为
您最近一年使用:0次
2024-01-11更新
|
87次组卷
|
3卷引用:河北省石家庄市第二十四中学2023-2024学年高二上学期12月月考化学试题
3 . C、N、O、Si、P、Ge、As及其化合物在科研和生产中有许多重要用途。下列相关叙述正确的是


| A.基态氮原子核外电子占据的原子轨道数目为5 |
B.图1表示碳、硅和磷三种元素的四级电离能变化趋势,其中表示磷的曲线是 |
C. 的分子结构如图2所示,则在该化合物中 的分子结构如图2所示,则在该化合物中 的杂化方式是 的杂化方式是 |
D. 的稳定性比 的稳定性比 高,原因是 高,原因是 键能大于 键能大于 键能 键能 |
您最近一年使用:0次
解题方法
4 . 无水氯化镨( )是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、
)是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、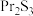 、
、 等)制备氯化镨晶体(
等)制备氯化镨晶体(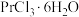 )。
)。
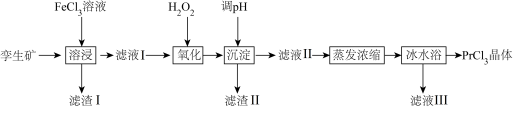
已知:① ;
;
② ;
;
③该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和沉淀完全时的pH如表所示:
④沉淀时加入氨水逐步调节溶液的pH至6.5,此时滤渣Ⅱ中不含Pr的化合物。
回答下列问题:
(1)为了提高镨元素的浸出率,可采取的措施有___________ (填一种即可)。
(2)滤渣Ⅰ的主要成分为 和S:
和S:
①写出 的一种用途:
的一种用途:___________ 。
②S可用来处理体温计破碎时渗出的液态Hg,还可用来制黑火药(由硫黄粉、硝酸钾和木炭混合而成,爆炸时的生成物为硫化钾、氮气和二氧化碳),写出黑火药爆炸时发生反应的化学方程式:___________ 。
(3)加入 的目的是
的目的是___________ ,其发生反应的离子方程式为___________ , 中氧原子的杂化方式为
中氧原子的杂化方式为___________ 。
(4)滤渣Ⅱ的主要成分为___________ (填化学式)。
(5)利用表中的数据求出
___________ 。
(6) 利用电解法可以生产金属错。先将氯化镨与工业纯KCl配成二元电解质体系( ),然后置于槽内熔化,通入直流电进行电解(如图所示,两电极均为惰性电极)。
),然后置于槽内熔化,通入直流电进行电解(如图所示,两电极均为惰性电极)。

①M电极与电源的___________ (填“正极”或“负极”)相连。
②电池工作时,每转移 个电子,此时产生的气体的体积为
个电子,此时产生的气体的体积为___________ L(已换算成标准状况下)。
 )是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、
)是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、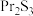 、
、 等)制备氯化镨晶体(
等)制备氯化镨晶体(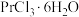 )。
)。
已知:①
 ;
;②
 ;
;③该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和沉淀完全时的pH如表所示:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 5.4 | 2.2 | 7.5 |
沉淀完全( )时的pH )时的pH | 6.4 | 3.2 | 9.0 |
回答下列问题:
(1)为了提高镨元素的浸出率,可采取的措施有
(2)滤渣Ⅰ的主要成分为
 和S:
和S:①写出
 的一种用途:
的一种用途:②S可用来处理体温计破碎时渗出的液态Hg,还可用来制黑火药(由硫黄粉、硝酸钾和木炭混合而成,爆炸时的生成物为硫化钾、氮气和二氧化碳),写出黑火药爆炸时发生反应的化学方程式:
(3)加入
 的目的是
的目的是 中氧原子的杂化方式为
中氧原子的杂化方式为(4)滤渣Ⅱ的主要成分为
(5)利用表中的数据求出

(6) 利用电解法可以生产金属错。先将氯化镨与工业纯KCl配成二元电解质体系(
 ),然后置于槽内熔化,通入直流电进行电解(如图所示,两电极均为惰性电极)。
),然后置于槽内熔化,通入直流电进行电解(如图所示,两电极均为惰性电极)。
①M电极与电源的
②电池工作时,每转移
 个电子,此时产生的气体的体积为
个电子,此时产生的气体的体积为
您最近一年使用:0次
5 . 每谈及CO时总把它与有毒气体并列视之,其实CO也是一种用途相当广泛的化工基础原料。随着化学的日益发展,CO可以合成多种重要的化工产品,如在一定条件:CH2=CH2+CO+H2O→CH3CH2COOH,设NA为阿伏加德罗常数的值,下列说法正确的是
| A.28g由CH2=CH2和CO组成的混合气体中所含原子数可能为4NA |
| B.1molCH3CH2COOH与Na2CO3溶液反应最多产生CO2分子的数目为NA |
| C.标准状况下,22.4LH2O含极性共价键的数目为2NA |
| D.CH3CH2COOH中三个C原子的杂化方式均不相同 |
您最近一年使用:0次
名校
解题方法
6 . 根据所学内容填空:
(1)有下列物质:①HF、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ ,其中属于极性分子的是
,其中属于极性分子的是_______ (填序号,下同),既有 键又有
键又有 键的是
键的是_______ 。
(2)下列分子中,空间构型为正四面体且键角为109°28′的是_______ 。
a. b.
b. c.
c. d.
d. e.
e. f.
f.
(3) 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是_______ 。
(4)丙烯腈分子( )中碳原子杂化轨道类型为
)中碳原子杂化轨道类型为_______ 。
(5)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。
① 的酸性比
的酸性比
_______ (填“强”或“弱”)。 离子的空间构型为
离子的空间构型为_______ 。
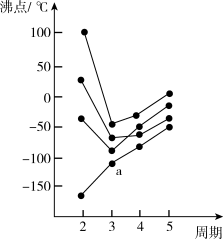
②如图所示,每条折线表示周期表ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ (化学式)。
(1)有下列物质:①HF、②
 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ ,其中属于极性分子的是
,其中属于极性分子的是 键又有
键又有 键的是
键的是(2)下列分子中,空间构型为正四面体且键角为109°28′的是
a.
 b.
b. c.
c. d.
d. e.
e. f.
f.
(3)
 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是(4)丙烯腈分子(
 )中碳原子杂化轨道类型为
)中碳原子杂化轨道类型为(5)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。
①
 的酸性比
的酸性比
 离子的空间构型为
离子的空间构型为②如图所示,每条折线表示周期表ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
您最近一年使用:0次
2022-04-09更新
|
433次组卷
|
3卷引用:河北省衡水市第二中学2021-2022学年高二下学期期中考试化学试题
名校
7 . 2020年11月7日是被誉为“中国稀土之父”的徐光宪院士诞辰100周年纪念日,社会各界举行了各式各样的纪念活动。已知钪(Sc)是17种稀土元素之一,钪单质及其化合物用途广泛。请回答下列问题:
(1)与Sc同周期且其基态原子的未成对电子数与Sc原子相同的元素有___________ 种。
(2)元素呈气态时,从它的阳离子中将一个电子移至无穷远处时所需做的功,称为该元素的电离势,单位为电子伏特(ev)。Sc的三种气态离子Sc+、Sc2+、Sc3+的电离势分别为6.54ev、12.80ev、24.76ev,上述三种气态离子的电离势依次增大的原因为___________ 。
(3)我国科学家首次合成并晶体结构表征了稀土金属末端氮宾配合物-钪末端氮宾配合物,该配合物的分子结构如图所示。

①该配合物分子中碳原子的杂化方式为___________ ;与Sc原子形成配位键的N原子个数为___________ 。
②该配合物中各元素第一电离能从大到小的顺序为___________ 。
(1)与Sc同周期且其基态原子的未成对电子数与Sc原子相同的元素有
(2)元素呈气态时,从它的阳离子中将一个电子移至无穷远处时所需做的功,称为该元素的电离势,单位为电子伏特(ev)。Sc的三种气态离子Sc+、Sc2+、Sc3+的电离势分别为6.54ev、12.80ev、24.76ev,上述三种气态离子的电离势依次增大的原因为
(3)我国科学家首次合成并晶体结构表征了稀土金属末端氮宾配合物-钪末端氮宾配合物,该配合物的分子结构如图所示。

①该配合物分子中碳原子的杂化方式为
②该配合物中各元素第一电离能从大到小的顺序为
您最近一年使用:0次
2021-05-30更新
|
265次组卷
|
2卷引用:河北省正中实验中学2020-2021学年高二第二学期第一次月考化学试题
解题方法
8 . 钴常见的化合价为+2、+3,钴及其化合物在工业上具有重要的用途。请回答下列问题:
(1)钴在元素周期表中属于___________ 区元素,与钴同周期且基态原子与基态钴原子具有相同未成对电子数的元素是___________ (填元素符号)。
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是___________ (填离子符号),原因为___________ 。
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为___________ 。
②NH3中的H-N-H的键角___________ (填“大于”或“小于”)NH 中H-N-H的键角
中H-N-H的键角
③[Co(NH3)6]Cl3中存在的作用力类型有___________ (填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有___________ mol,该螯合物中N的杂化方式有___________ 种。
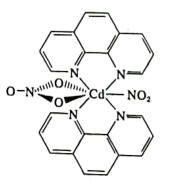
(1)钴在元素周期表中属于
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为
②NH3中的H-N-H的键角
 中H-N-H的键角
中H-N-H的键角③[Co(NH3)6]Cl3中存在的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有

您最近一年使用:0次
9 . 氟及其化合物用途非常广泛。回答下列问题:
(1)氢氟酸需贮存在聚四氟乙烯容器中。聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______ 方法区分晶体、准晶体和非晶体。
(2)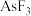 ,
, ,
, ,
,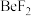 中价层电子对数不同于其他微粒的是
中价层电子对数不同于其他微粒的是_______ (填化学式,下同),立体结构为三角锥形的是_______ 。
(3)室温氟穿梭电池的电解质为氟氢离子液体,含 等离子,画出
等离子,画出 的结构式:
的结构式:_______ 。
(4) 在冶金、化工和建材等行业用途广泛。
在冶金、化工和建材等行业用途广泛。
①基于 设计的Born—Haber循环如图所示。
设计的Born—Haber循环如图所示。
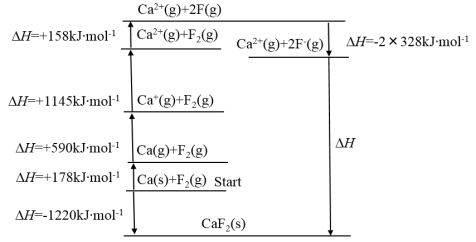
钙的第一电离能为_______  ;
; 键的键能为
键的键能为_______  。
。
② 的晶胞结构如图所示,其边长为
的晶胞结构如图所示,其边长为 。已知1号原子的坐标为
。已知1号原子的坐标为 ,3号原子的坐标为
,3号原子的坐标为 。则2号原子的坐标为
。则2号原子的坐标为_______ ; 与
与 间的最近距离为
间的最近距离为_______  。
。

(1)氢氟酸需贮存在聚四氟乙烯容器中。聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)
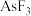 ,
, ,
, ,
,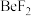 中价层电子对数不同于其他微粒的是
中价层电子对数不同于其他微粒的是(3)室温氟穿梭电池的电解质为氟氢离子液体,含
 等离子,画出
等离子,画出 的结构式:
的结构式:(4)
 在冶金、化工和建材等行业用途广泛。
在冶金、化工和建材等行业用途广泛。①基于
 设计的Born—Haber循环如图所示。
设计的Born—Haber循环如图所示。
钙的第一电离能为
 ;
; 键的键能为
键的键能为 。
。②
 的晶胞结构如图所示,其边长为
的晶胞结构如图所示,其边长为 。已知1号原子的坐标为
。已知1号原子的坐标为 ,3号原子的坐标为
,3号原子的坐标为 。则2号原子的坐标为
。则2号原子的坐标为 与
与 间的最近距离为
间的最近距离为 。
。
您最近一年使用:0次
10 . 铬能形成多种配合物,许多铬的配合物都具有广泛用途。回答下列问题:
(1) 成为阳离子时首先失去的是
成为阳离子时首先失去的是_______ 轨道上的电子。
(2) 、
、 、C三种配合物的化学式和颜色如下:
、C三种配合物的化学式和颜色如下:
A.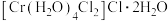 深绿色
深绿色
B. 绿色
绿色
C.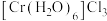 灰蓝色
灰蓝色
① 、
、 、
、 之间的关系是
之间的关系是_____ 。
②化合物 中与
中与 (Ⅲ)形成配位键的原子或离子是
(Ⅲ)形成配位键的原子或离子是_____ ,配位数为_____ 。
③相同物质的量的 、
、 、
、 分别与足量
分别与足量 溶液反应,生成
溶液反应,生成 的物质的量之比为
的物质的量之比为_____ 。
(3)Reineckesalt的结构如图所示。
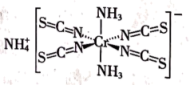
①阳离子的立体结构为_______ ; 的立体结构为
的立体结构为_____ 。
② 中碳原子的杂化方式为
中碳原子的杂化方式为_____ 。
(1)
 成为阳离子时首先失去的是
成为阳离子时首先失去的是(2)
 、
、 、C三种配合物的化学式和颜色如下:
、C三种配合物的化学式和颜色如下:A.
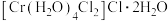 深绿色
深绿色B.
 绿色
绿色C.
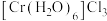 灰蓝色
灰蓝色①
 、
、 、
、 之间的关系是
之间的关系是②化合物
 中与
中与 (Ⅲ)形成配位键的原子或离子是
(Ⅲ)形成配位键的原子或离子是③相同物质的量的
 、
、 、
、 分别与足量
分别与足量 溶液反应,生成
溶液反应,生成 的物质的量之比为
的物质的量之比为(3)Reineckesalt的结构如图所示。

①阳离子的立体结构为
 的立体结构为
的立体结构为②
 中碳原子的杂化方式为
中碳原子的杂化方式为
您最近一年使用:0次



