名校
解题方法
1 . La、Cu、O组成复合氧化物是超导体基体材料,可以做光催化分解水的电极材料,对制备绿色无污染的氢能源意义重大。回答下列问题:
(1)基态Cu原子核外电子排布式为___ 。
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
计算5f能级的值为___ 。
(3)已知铜的某些化合物的熔点:
则CuSe为___ 晶体,CuSe的熔点大于CuS的熔点的原因是___ 。
(4)一种Cu2+的配合离子结构简式为: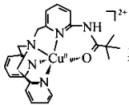 其中,N原子的杂化方式为
其中,N原子的杂化方式为___ ,Cu2+的配位数为___ 。
(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为___ (任写一种)。
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为___ 。
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为___ g·cm-3。
(1)基态Cu原子核外电子排布式为
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
| I | 0 | 1 | 2 | 3 |
| 亚层符号 | s | p | d | f |
计算5f能级的值为
(3)已知铜的某些化合物的熔点:
| CuO | CuS | CuSe | |
| 熔点(℃) | 1326 | 103 | 387 |
则CuSe为
(4)一种Cu2+的配合离子结构简式为:
 其中,N原子的杂化方式为
其中,N原子的杂化方式为(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为
您最近一年使用:0次
2021-09-10更新
|
107次组卷
|
2卷引用:河北省石家庄市第二中学2022届高三10月第三次考试化学试卷
名校
2 . 晶体世界丰富多彩、复杂多样,各类晶体具有的不同结构特点,决定着它们具有不同的性质和用途。氢化铝钠 是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为
是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为 下列说法错误的是
下列说法错误的是
 是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为
是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为 下列说法错误的是
下列说法错误的是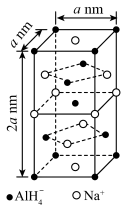
A. 中中心原子 中中心原子 的杂化方式为 的杂化方式为 杂化 杂化 |
B. 晶体中,与 晶体中,与 紧邻且等距的 紧邻且等距的 有4个 有4个 |
C. 晶体的密度为 晶体的密度为 |
D.若 晶胞上下面心处的 晶胞上下面心处的 被 被 取代,得到的晶体的化学式为 取代,得到的晶体的化学式为 |
您最近一年使用:0次
2024-05-30更新
|
225次组卷
|
2卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
解题方法
3 . 硫酸钴可用于电镀、碱性电池、生产含钴颜料,有着较为广泛的用途.由含钴矿(主要成分为 ,含有少量
,含有少量 的氧化物及有机物等)制备硫酸钴,并实现
的氧化物及有机物等)制备硫酸钴,并实现 元素的回收流程如图:
元素的回收流程如图:
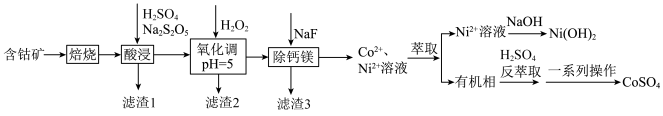
已知:① ;
;
②焦亚硫酸钠 常用作食品抗氧化剂;
常用作食品抗氧化剂;
③氧化性: .
.
回答下列问题:
(1)滤渣1的成分为___________________________ .
(2)酸浸工序发生的主要反应的化学方程式是_______________________ .
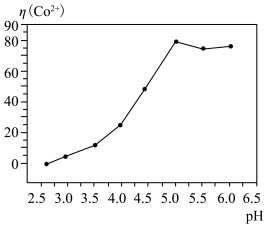
(3)氧化调 工序中,
工序中, 的作用是
的作用是__________________ (用离子方程式表示);调 时,最好选择
时,最好选择____________ .
a. b.
b. c.
c.
(4)萃取后, 浓度为
浓度为 ,当沉镍率达到99%时,溶液中
,当沉镍率达到99%时,溶液中 浓度为
浓度为____________  .
.
(5)向除杂后的溶液中,加入有机酸萃取剂 ,发生反应:
,发生反应: ,实验发现,随着
,实验发现,随着 的增大,萃取率逐渐升高,这是由于
的增大,萃取率逐渐升高,这是由于______________________ ,当 时,萃取率最高.
时,萃取率最高.
(6)硫酸钴可用于生产钴酞菁,酞菁和钴酞菁的分子结构如图所示.酞菁分子中所有原子共平面,则氮原子的杂化方式为____________ .钴酞菁分子中,氮原子与钴离子形成____________ 键.

 ,含有少量
,含有少量 的氧化物及有机物等)制备硫酸钴,并实现
的氧化物及有机物等)制备硫酸钴,并实现 元素的回收流程如图:
元素的回收流程如图:
已知:①
 ;
;②焦亚硫酸钠
 常用作食品抗氧化剂;
常用作食品抗氧化剂;③氧化性:
 .
.回答下列问题:
(1)滤渣1的成分为
(2)酸浸工序发生的主要反应的化学方程式是
(3)氧化调
 工序中,
工序中, 的作用是
的作用是 时,最好选择
时,最好选择a.
 b.
b. c.
c.
(4)萃取后,
 浓度为
浓度为 ,当沉镍率达到99%时,溶液中
,当沉镍率达到99%时,溶液中 浓度为
浓度为 .
.(5)向除杂后的溶液中,加入有机酸萃取剂
 ,发生反应:
,发生反应: ,实验发现,随着
,实验发现,随着 的增大,萃取率逐渐升高,这是由于
的增大,萃取率逐渐升高,这是由于 时,萃取率最高.
时,萃取率最高.
(6)硫酸钴可用于生产钴酞菁,酞菁和钴酞菁的分子结构如图所示.酞菁分子中所有原子共平面,则氮原子的杂化方式为

您最近一年使用:0次
2024-03-18更新
|
288次组卷
|
3卷引用:河北省保定市部分高中2023-2024学年高三下学期开学化学试题
名校
解题方法
4 . 钴的化合物在工业中有重要用途。请回答下列问题:
(1) 中配体NH3为
中配体NH3为___________ (填“极性”或“非极性”)分子,NH3分子中N-H键的键角___________ (填“>”、“<”或“=”) 中N-H键的键角,原因为
中N-H键的键角,原因为___________ 。
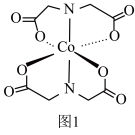
(2)Co的一种配合物结构如图1,其配位数为___________ ,C、N、O的第一电离能由大到小的顺序为___________ (填元素符号),其中C原子的杂化方式为___________ 。 )的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。
)的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。___________ 。
②与O原子最近且等距离的O原子有___________ 个。
③该晶体的密度为___________ g·cm-3。
(1)
 中配体NH3为
中配体NH3为 中N-H键的键角,原因为
中N-H键的键角,原因为(2)Co的一种配合物结构如图1,其配位数为
 )的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。
)的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。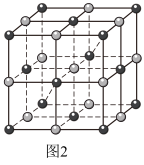
②与O原子最近且等距离的O原子有
③该晶体的密度为
您最近一年使用:0次
2023-10-27更新
|
236次组卷
|
4卷引用:河北省邢台市五岳联盟2023-2024学年高三上学期10月期中考试化学试题
5 . 水合肼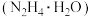 是一种用途广泛的化工原料,是具有较强还原性的碱性液体,在空气中会与
是一种用途广泛的化工原料,是具有较强还原性的碱性液体,在空气中会与 反应产生烟雾。制备
反应产生烟雾。制备 的实验流程如下图所示:
的实验流程如下图所示:

回答下列问题:
Ⅰ.步骤Ⅰ制备 的装置如图1所示。
的装置如图1所示。

已知:①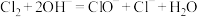 是放热反应;
是放热反应;
② 。
。
(1)装置D中盛装的试剂是_______ ,通入空气的作用是_______ 。若通入的空气没有经过装置A处理的不利影响是_______ 。
(2)为了提高 的产率,防止副反应发生,装置E需要采用冰水浴,实验中除控制温度外还需采取的措施是
的产率,防止副反应发生,装置E需要采用冰水浴,实验中除控制温度外还需采取的措施是_______ 。
Ⅱ.由步骤Ⅱ和步骤Ⅲ获得 的装置如图2所示,利用
的装置如图2所示,利用 与的
与的 溶液在三颈烧瓶中合成
溶液在三颈烧瓶中合成 ,再通过减压蒸馏在锥形瓶H中收集。
,再通过减压蒸馏在锥形瓶H中收集。

(3) 的C、N原子杂化方式分别为
的C、N原子杂化方式分别为_______ 、_______ 。
(4)仪器d的名称为_______ ,干燥管e中盛装的试剂为_______ ,实验中通过仪器c缓慢滴加的溶液是_______ (填“尿素溶液”或“ 溶液”),原因是
溶液”),原因是_______ 。
(5)三颈烧瓶中合成 的化学方程式是
的化学方程式是_______ 。
(6)产品水合肼含量的测定:称取样品液体 ,加入适量
,加入适量 固体,配成溶液,滴入几滴淀粉溶液,用
固体,配成溶液,滴入几滴淀粉溶液,用 的标准
的标准 溶液滴定。实验测得消耗标准
溶液滴定。实验测得消耗标准 溶液的体积为
溶液的体积为 ,则样品中
,则样品中 的质量分数为
的质量分数为_______ (已知: 。
。
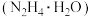 是一种用途广泛的化工原料,是具有较强还原性的碱性液体,在空气中会与
是一种用途广泛的化工原料,是具有较强还原性的碱性液体,在空气中会与 反应产生烟雾。制备
反应产生烟雾。制备 的实验流程如下图所示:
的实验流程如下图所示:
回答下列问题:
Ⅰ.步骤Ⅰ制备
 的装置如图1所示。
的装置如图1所示。
已知:①
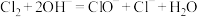 是放热反应;
是放热反应;②
 。
。(1)装置D中盛装的试剂是
(2)为了提高
 的产率,防止副反应发生,装置E需要采用冰水浴,实验中除控制温度外还需采取的措施是
的产率,防止副反应发生,装置E需要采用冰水浴,实验中除控制温度外还需采取的措施是Ⅱ.由步骤Ⅱ和步骤Ⅲ获得
 的装置如图2所示,利用
的装置如图2所示,利用 与的
与的 溶液在三颈烧瓶中合成
溶液在三颈烧瓶中合成 ,再通过减压蒸馏在锥形瓶H中收集。
,再通过减压蒸馏在锥形瓶H中收集。
(3)
 的C、N原子杂化方式分别为
的C、N原子杂化方式分别为(4)仪器d的名称为
 溶液”),原因是
溶液”),原因是(5)三颈烧瓶中合成
 的化学方程式是
的化学方程式是(6)产品水合肼含量的测定:称取样品液体
 ,加入适量
,加入适量 固体,配成溶液,滴入几滴淀粉溶液,用
固体,配成溶液,滴入几滴淀粉溶液,用 的标准
的标准 溶液滴定。实验测得消耗标准
溶液滴定。实验测得消耗标准 溶液的体积为
溶液的体积为 ,则样品中
,则样品中 的质量分数为
的质量分数为 。
。
您最近一年使用:0次
名校
解题方法
6 . Ⅰ、由CO2、甲醇为原料合成绿色化学品碳酸二甲酯(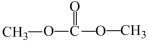 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
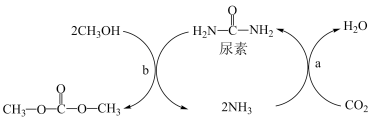
(1)下列说法不正确的是___________ (填字母)。
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
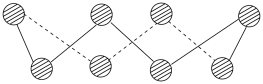
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是___________ 。
(3) 的电子式是
的电子式是___________ ,依据 理论推测
理论推测 的空间构型为
的空间构型为___________ ,常温下 是气体而
是气体而 是液体的原因是
是液体的原因是___________ 。
(4) 的键角
的键角___________  的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是___________ 。
(5) 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
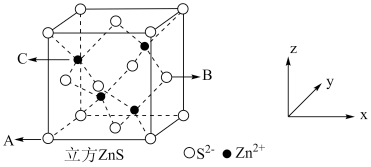
①已知A、B点的原子坐标分别为 和
和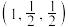 ,则C点的原子坐标为
,则C点的原子坐标为___________ ;
②若晶胞棱长为 ,密度为
,密度为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
(1)下列说法不正确的是
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)
 的电子式是
的电子式是 理论推测
理论推测 的空间构型为
的空间构型为 是气体而
是气体而 是液体的原因是
是液体的原因是(4)
 的键角
的键角 的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是(5)
 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
①已知A、B点的原子坐标分别为
 和
和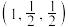 ,则C点的原子坐标为
,则C点的原子坐标为②若晶胞棱长为
 ,密度为
,密度为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
2022-09-05更新
|
351次组卷
|
6卷引用:河北省昌黎第一中学2023届高三下学期第五次调研考试化学试题
名校
解题方法
7 . NH3与甲醛CH2O反应可以制备乌洛托品(六亚甲基四胺,分子结构为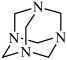 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
(1)基态氮原子的价电子轨道表达式为___________ ,第三电离能I3(C)___________ I3(N)(填“>”或“<)。
(2)NH3的空间构型为___________ ,CH2O中C采取的杂化类型为___________ 。CH2O中碳氢键与NH3中氮氢键相比,键长较长的是___________ 。
(3)乌洛托品为___________ (填“极性”或“非极性”)分子,分子中的所有N原子呈正四面体分布,所有C原子呈___________ 几何体分布,该分子可与H+形成配位键,电子对给予体为___________ 原子。
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为___________ 。乌洛托品比金刚烷(C10H16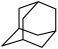 )水溶性更高,理由是
)水溶性更高,理由是___________ 。
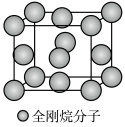
(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为___________ g/cm3。
 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:(1)基态氮原子的价电子轨道表达式为
(2)NH3的空间构型为
(3)乌洛托品为
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为
 )水溶性更高,理由是
)水溶性更高,理由是(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为

您最近一年使用:0次
2022-03-27更新
|
625次组卷
|
5卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)
(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)四川省南充市2022届高三 适应性考试(二模)理综化学试题贵州省贵阳市五校2021-2022学年高三下学期联考理科综合化学试题(七)湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题
2022·河北·模拟预测
解题方法
8 . 卤族元素及其化合物用途非常广泛。回答下列问题:
(1) 可以与一定量的水形成
可以与一定量的水形成 晶体,基态B原子核外电子的空间运动状态有
晶体,基态B原子核外电子的空间运动状态有_______ 种, 中B原子采用的是
中B原子采用的是_______ 杂化。
(2)氯的化合物很多,常见的有 、
、 等.其中
等.其中 常温常压下为无色液体,则
常温常压下为无色液体,则 的空间构型为
的空间构型为_______ ,其固体的晶体类型为_______ 。无水 不能干燥
不能干燥 是因为形成了
是因为形成了 ,形成的配位离子中提供空轨道的是
,形成的配位离子中提供空轨道的是_______ ,提供孤对电子的是_______ 。
(3)某化合物 由
由 和
和 层交替堆叠构成.该化合物的所有组成元素位于元素周期表的
层交替堆叠构成.该化合物的所有组成元素位于元素周期表的_______ (填“s”“d”或“p”)区。O、S、N,3种元素的第一电离能由大到小的顺序是_______ 。
(4) 为直线形分子,属四方晶系,
为直线形分子,属四方晶系, 晶体结构如图所示.晶胞棱边夹角均为
晶体结构如图所示.晶胞棱边夹角均为 ,1个
,1个 晶胞中有
晶胞中有_______ 个 分子。若
分子。若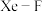 键的键长为190pm,设阿伏加德罗常数的值为
键的键长为190pm,设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  (结果保留两位小数)。
(结果保留两位小数)。

(1)
 可以与一定量的水形成
可以与一定量的水形成 晶体,基态B原子核外电子的空间运动状态有
晶体,基态B原子核外电子的空间运动状态有 中B原子采用的是
中B原子采用的是(2)氯的化合物很多,常见的有
 、
、 等.其中
等.其中 常温常压下为无色液体,则
常温常压下为无色液体,则 的空间构型为
的空间构型为 不能干燥
不能干燥 是因为形成了
是因为形成了 ,形成的配位离子中提供空轨道的是
,形成的配位离子中提供空轨道的是(3)某化合物
 由
由 和
和 层交替堆叠构成.该化合物的所有组成元素位于元素周期表的
层交替堆叠构成.该化合物的所有组成元素位于元素周期表的(4)
 为直线形分子,属四方晶系,
为直线形分子,属四方晶系, 晶体结构如图所示.晶胞棱边夹角均为
晶体结构如图所示.晶胞棱边夹角均为 ,1个
,1个 晶胞中有
晶胞中有 分子。若
分子。若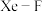 键的键长为190pm,设阿伏加德罗常数的值为
键的键长为190pm,设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为 (结果保留两位小数)。
(结果保留两位小数)。
您最近一年使用:0次
名校
9 . 由于钒的化合物颜色鲜艳而多彩,因此以神话中斯堪的纳维亚女神“Vanadis"的名字命名。钒有多种化合价,如:+2、+3、+4、+5等,其化合物具有广泛的用途。请回答下列问题:
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ ,表示,与之相反的用 -
,表示,与之相反的用 - 表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为
表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为___________ 。
(2)钒的一种配合物的结构简式为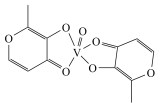 ,该配合物的组成元素的电负性由大到小的顺序是
,该配合物的组成元素的电负性由大到小的顺序是_______ (用元素符号表示),氧原子的杂化轨道类型为__________ ,该配合物分子中含有的化学键类型有________ (填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键
(3)钒的含氧酸有正钒酸(H3VO4)、偏钒酸(HVO3)等,正钒酸、偏钒酸的酸性由强到弱的顺序是_____________ (用分子式表示),原因为________ 。
(4)钒的多种含氧酸根离子的结构如图所示,图3为一种无限长单链结构的多聚钒酸根,其化学式为__ 。
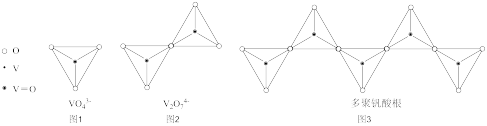
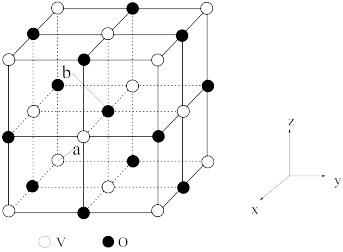
(5)钒的某种氧化物的立方晶胞如图所示,该氧化物的化学式为________________________ ;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,若a点原子的分数坐标为(0,0,0),则b点原子的分数坐标为____________________ ;钒原子构成的八面体空隙与氧原子构成的八 面体空隙的数量比为_________________________ ;已知该氧化物晶体的密度为ρg·cm-3。则晶胞中距离最近的两个氧原子的核间距为_________________ pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 ,表示,与之相反的用 -
,表示,与之相反的用 - 表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为
表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为(2)钒的一种配合物的结构简式为
 ,该配合物的组成元素的电负性由大到小的顺序是
,该配合物的组成元素的电负性由大到小的顺序是A.离子键 B.极性键 C.非极性键 D.配位键
(3)钒的含氧酸有正钒酸(H3VO4)、偏钒酸(HVO3)等,正钒酸、偏钒酸的酸性由强到弱的顺序是
(4)钒的多种含氧酸根离子的结构如图所示,图3为一种无限长单链结构的多聚钒酸根,其化学式为

(5)钒的某种氧化物的立方晶胞如图所示,该氧化物的化学式为

您最近一年使用:0次
名校
解题方法
10 . 单质硼是一种用途广泛的化工原料,可以应用于新型材料的制备,可用作良好的还原剂等。
(1)晶体硼为黑色,硬度仅次于金刚石,质地较脆,熔点为2573K,沸点为2823K。晶体硼的晶体类型属于___ 晶体。
(2)晶体硼单质的基本结构单元为正二十面体(如图甲所示),其能自发地呈现多面体外形,这种性质称为晶体的___ 。晶体中有20个等边三角形和一定数目的顶点,每个顶点各有一个B原子。通过观察图形及推算,可知此结构单元是由___ 个B原子构成。

(3)基态硼原子的价电子轨道表达式是___ 。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___ 。
(4)B与H形成的化合物很多,其中最简单的氢化物为B2H6 (分子结构如图乙),则B原子的杂化方式为___ 。氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是__ 。硼氢化钠(NaBH4),它是有机合成的重要还原剂,其中BH 的立体构型为
的立体构型为___ 。
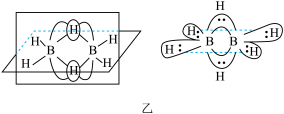
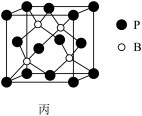
(5)磷化硼是一种超硬耐磨涂层材料,如图丙为其晶胞结构,阿伏加德罗常数的值为NA,磷化硼晶体的密度为ρg•cm-3,B与P最近的距离为___ cm(列出计算式即可)。
(1)晶体硼为黑色,硬度仅次于金刚石,质地较脆,熔点为2573K,沸点为2823K。晶体硼的晶体类型属于
(2)晶体硼单质的基本结构单元为正二十面体(如图甲所示),其能自发地呈现多面体外形,这种性质称为晶体的

(3)基态硼原子的价电子轨道表达式是
(4)B与H形成的化合物很多,其中最简单的氢化物为B2H6 (分子结构如图乙),则B原子的杂化方式为
 的立体构型为
的立体构型为
(5)磷化硼是一种超硬耐磨涂层材料,如图丙为其晶胞结构,阿伏加德罗常数的值为NA,磷化硼晶体的密度为ρg•cm-3,B与P最近的距离为

您最近一年使用:0次



