解题方法
1 . 氮族元素包括氮(N)、磷(P)、砷( )、锑(
)、锑(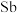 )、铋(
)、铋( )和镆(
)和镆(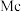 )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
(1) 基态原子核外电子排布式为
基态原子核外电子排布式为___________ ,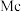 基态原子核外有
基态原子核外有___________ 个未成对电子。
(2) 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是___________ 。
(4) 离子中P的杂化类型为
离子中P的杂化类型为___________ , 分子的空间构型均为
分子的空间构型均为___________ ,其键角依次减小的原因是___________ 。
(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为___________ ,该晶体密度为___________  (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。
 )、锑(
)、锑(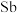 )、铋(
)、铋( )和镆(
)和镆(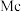 )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:(1)
 基态原子核外电子排布式为
基态原子核外电子排布式为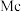 基态原子核外有
基态原子核外有(2)
 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、
 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是(4)
 离子中P的杂化类型为
离子中P的杂化类型为 分子的空间构型均为
分子的空间构型均为(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为
 (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。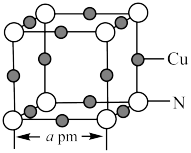
您最近一年使用:0次
2024-04-19更新
|
136次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学
解题方法
2 . 硫酸亚铁铵是一种蓝绿色的复盐,俗名为摩尔盐,化学式为(NH4)2Fe(SO4)2•6H2O。它在空气中稳定,是重要的化工原料,用途十分广泛。该物质隔绝空气加强热会发生分解,一种分解方式可表示为:(NH4)2Fe(SO4)2•6H2O=2NH3↑+FeO+2SO3↑+7H2O↑。请回答下列问题:
(1)基态铁原子的价电子排布式为___________ ,s电子的电子云形状为___________ 。
(2)摩尔盐中的组成元素N、O的电负性大小顺序是___________ 。
(3)SO2、SO3、SO 是三种常见含硫微粒。
是三种常见含硫微粒。
①SO 微粒的立体构型为
微粒的立体构型为___________ ,SO2中心原子的杂化方式为___________ 。
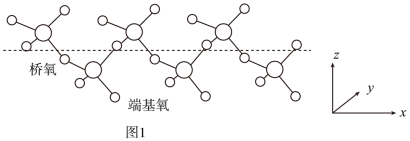
②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是___________ (填“桥氧”或“端基氧”),理由是___________ 。
(4)噻吩( )、吡咯(
)、吡咯(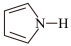 )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩___________ 吡咯(填“<”、“>”或“=”),理由是___________ 。
(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。
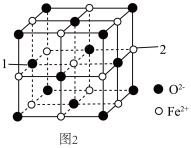
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0, ,
, ),则原子2的坐标为
),则原子2的坐标为___________ 。
②Fe2+处于O2﹣围成的___________ 空隙中。(填“正四面体”或“正八面体”)
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为___________ pm。
(1)基态铁原子的价电子排布式为
(2)摩尔盐中的组成元素N、O的电负性大小顺序是
(3)SO2、SO3、SO
 是三种常见含硫微粒。
是三种常见含硫微粒。①SO
 微粒的立体构型为
微粒的立体构型为②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是

(4)噻吩(
 )、吡咯(
)、吡咯( )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0,
 ,
, ),则原子2的坐标为
),则原子2的坐标为②Fe2+处于O2﹣围成的
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为
您最近一年使用:0次
2022-04-15更新
|
333次组卷
|
2卷引用:青海省西宁市2023届高三一模理科综合化学试题
名校
解题方法
3 . N、P、As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
(1)意大利罗马大学的Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为______________________ ,N—N键的键角为______________________ ;
(2)基态砷原子的价电子排布图为______________________ ,砷与同周期相邻元素的第一电离能由大到小的顺序为______________________ ;
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是____________________ (填“PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是____________________ ;S—Cl键键长 ______ P-Cl键键长(填“>”、“=”或“<”),原因是____________________ 。
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为____________________ 。若该晶体的密度为ρg/cm3,设NA为阿伏伽德罗常数的值,则a、b的距离为_________ pm(用含ρ和NA的代数式表示)。

(1)意大利罗马大学的Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为
(2)基态砷原子的价电子排布图为
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为

您最近一年使用:0次
2018-11-04更新
|
329次组卷
|
8卷引用:青海省西宁市第四高级中学、第五中学、第十四中学三校2017届高三4月联考化学试题
4 . 铁、钴、铜是重要的过渡元素,其化合物具有广泛的用途。
(1)钴位于元素周期表中第____ 族,基态Cu的核外电子排布式是_________ 。元素铁与铜的第二电离能分别为:ICu=1958kJ/mol、IFe=1561kJ/mol,ICu>IFe的原因是______________ 。
(2)有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为:[Fe(H2NCONH2)6](NO3)3.
①尿素分子中C原子的杂化方式是_______ ,所含非金属元素的电负性由大到小的顺序是_____ 。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是_______ 。根据价层电子对互斥理论推测NO3-的空间构型为_________ 。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是________________ ,原因是________________ 。
(4)FeCl3晶体易溶于水喝乙醇,用酒精灯加热即可气化,由此可知FeCl3的晶体类型为_____ ;S和Fe形成的某化合物,其晶胞如图一所示,则该物质的化学式为_______ 。
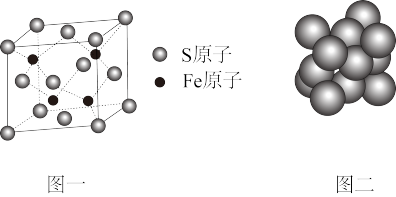
(5)Cu晶体的堆积方式如图二所示,晶体中Cu原子的配位数为_______ ;设Cu原子半径为a,晶体空间利用率为_______ (用含a的式子表达,不化简)。
(1)钴位于元素周期表中第
(2)有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为:[Fe(H2NCONH2)6](NO3)3.
①尿素分子中C原子的杂化方式是
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是
(4)FeCl3晶体易溶于水喝乙醇,用酒精灯加热即可气化,由此可知FeCl3的晶体类型为

(5)Cu晶体的堆积方式如图二所示,晶体中Cu原子的配位数为
您最近一年使用:0次



