1 . 卤族元素的单质和化合物在生产生活中有重要的用途。请回答:
(1)卤族元素位于元素周期表的___________ 区,溴原子的M能层电子排布式为___________ 。
(2) 的VSEPR模型如图,中心I原子的杂化方式是___________。
的VSEPR模型如图,中心I原子的杂化方式是___________。
(3) 与囟素性质相似,与
与囟素性质相似,与 反应生成
反应生成 和
和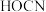 ,反应中所涉及元素的电负性由大到小的顺序为
,反应中所涉及元素的电负性由大到小的顺序为___________  的酸性
的酸性___________ (填“大于”或“小于”) 的酸性。
的酸性。
(4)一定条件下 与
与 以物质的量之比为1:1混合得到一种固态离子化合物,其结构组成可能为:(a)
以物质的量之比为1:1混合得到一种固态离子化合物,其结构组成可能为:(a)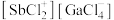 或(b)
或(b) ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为___________ (填“a”或“b”),理由是___________ 。
(5)我国科研小组在全无机铅钙钛矿薄膜制备和光伏电池研究方面取得新进展。研究人员采用 和二甲基碘化铵(DMAI)作为前驱体,通过真空辅助热退火的方法制备了钙钛矿薄膜,其晶胞结构如图一,沿x、y、z轴方向的投影均为图二。
和二甲基碘化铵(DMAI)作为前驱体,通过真空辅助热退火的方法制备了钙钛矿薄膜,其晶胞结构如图一,沿x、y、z轴方向的投影均为图二。 的配位数为
的配位数为___________ 。
②设 为阿伏加德罗常数的值,晶体中相邻
为阿伏加德罗常数的值,晶体中相邻 之间的最短距离为anm,则晶体密度为
之间的最短距离为anm,则晶体密度为___________  。
。
(1)卤族元素位于元素周期表的
(2)
 的VSEPR模型如图,中心I原子的杂化方式是___________。
的VSEPR模型如图,中心I原子的杂化方式是___________。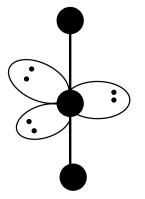
A. | B. | C. | D. |
(3)
 与囟素性质相似,与
与囟素性质相似,与 反应生成
反应生成 和
和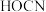 ,反应中所涉及元素的电负性由大到小的顺序为
,反应中所涉及元素的电负性由大到小的顺序为 的酸性
的酸性 的酸性。
的酸性。(4)一定条件下
 与
与 以物质的量之比为1:1混合得到一种固态离子化合物,其结构组成可能为:(a)
以物质的量之比为1:1混合得到一种固态离子化合物,其结构组成可能为:(a)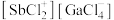 或(b)
或(b) ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为(5)我国科研小组在全无机铅钙钛矿薄膜制备和光伏电池研究方面取得新进展。研究人员采用
 和二甲基碘化铵(DMAI)作为前驱体,通过真空辅助热退火的方法制备了钙钛矿薄膜,其晶胞结构如图一,沿x、y、z轴方向的投影均为图二。
和二甲基碘化铵(DMAI)作为前驱体,通过真空辅助热退火的方法制备了钙钛矿薄膜,其晶胞结构如图一,沿x、y、z轴方向的投影均为图二。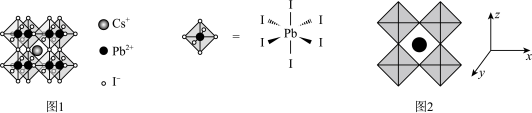
 的配位数为
的配位数为②设
 为阿伏加德罗常数的值,晶体中相邻
为阿伏加德罗常数的值,晶体中相邻 之间的最短距离为anm,则晶体密度为
之间的最短距离为anm,则晶体密度为 。
。
您最近一年使用:0次
解题方法
2 . 硼及其化合物在材料制造、有机合成等方面用途非常广泛,硼的一些化合物表现出缺电子特征。回答下列问题:
(1)基态硼原子的电子排布式为_______ ;B和Al的第一电离能I1(B)_______ I1(Al)(填“>”或“=”或“<”)。
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是_______ ,层内存在的作用力有_______ 。硼酸显弱酸性与[B(OH)4]-配离子有关,硼酸的电离方程式:_______ 。

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是_______ 。
(4)已知晶体硼的熔、沸点及硬度数据和基本结构单元(由硼原子组成的正二十面体如图1所示,每个三角形均为正三角形,每个顶点为一个硼原子)如下:

①晶体硼属于原子(共价)晶体,其理由是_______ 。
②每一个硼基本单元由_______ 个原子组成;
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为_______ ;
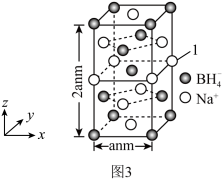
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为_______ 。已知NA代表阿伏加德罗常数的值,则硼氢化钠晶体的密度为ρ=_______ g·cm-3(用含NA的代数式表示)。
(1)基态硼原子的电子排布式为
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是
| 化学键 | B-H | B-O | B-B |
| 键能(kJ·mol-1) | 389 | 561 | 293 |
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
| 熔点(K) | 3832 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 3823 |
| 硬度 | 10 | 7.0 | 9.6 |

①晶体硼属于原子(共价)晶体,其理由是
②每一个硼基本单元由
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为

您最近一年使用:0次
2023-03-12更新
|
754次组卷
|
3卷引用:内蒙古呼和浩特市2023届高三第一次质量数据监测理科综合化学试题
解题方法
3 . (NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布式为_______ 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是_______ 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_______ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(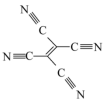 )。
)。
①CH3CN中碳原子的杂化方式是_______ 。
②TCNE中第一电离能较大的是_______ (填元素符号),分子中所有原子_______ (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是_______ 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成,Fe3C的晶胞结构如图所示(NA代表阿伏加德罗常数的数值):

Fe3C的密度为_______ (列出计算式)g·cm-3(1Å=10-8 cm)。
(1)基态Fe原子价层电子的电子排布式为
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(
 )。
)。①CH3CN中碳原子的杂化方式是
②TCNE中第一电离能较大的是
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成,Fe3C的晶胞结构如图所示(NA代表阿伏加德罗常数的数值):

Fe3C的密度为
您最近一年使用:0次
名校
解题方法
4 . 第VA族元素氮、磷、砷的化合物用途广泛。回答下列问题:
(1)实验中常用 检验
检验 ,
, 中
中 的配位数为
的配位数为_______ ,其中碳原子的杂化轨道类型为_______ 杂化。1mol 中含有
中含有 键的数目为
键的数目为_______ 。
(2)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:_______ 。

(3)阿伏加德罗常数的值为 ,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为
,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为_______  (写出表达式即可)。
(写出表达式即可)。
(4)用铬原子代替部分铜原子,可以形成一系列铜—铬合金。其中两种铜—铬合金的晶体结构如图所示。

①晶体a中铬原子的配位数为_______ 。
②晶体b中铬原子填充在由铜原子构成的_______ (填“四面体”“六面体”或“八面体”)空隙中, 表示阿伏加德罗常数的值,铜原子半径为
表示阿伏加德罗常数的值,铜原子半径为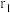 cm,铬原子半径为
cm,铬原子半径为 cm,则晶体b的空间利用率为
cm,则晶体b的空间利用率为_______ 。(写出表达式即可)
(1)实验中常用
 检验
检验 ,
, 中
中 的配位数为
的配位数为 中含有
中含有 键的数目为
键的数目为(2)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:

(3)阿伏加德罗常数的值为
 ,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为
,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为 (写出表达式即可)。
(写出表达式即可)。(4)用铬原子代替部分铜原子,可以形成一系列铜—铬合金。其中两种铜—铬合金的晶体结构如图所示。

①晶体a中铬原子的配位数为
②晶体b中铬原子填充在由铜原子构成的
 表示阿伏加德罗常数的值,铜原子半径为
表示阿伏加德罗常数的值,铜原子半径为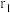 cm,铬原子半径为
cm,铬原子半径为 cm,则晶体b的空间利用率为
cm,则晶体b的空间利用率为
您最近一年使用:0次
名校
解题方法
5 . 铁、钴、镍都属于第VIII族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_______________________________ 。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是____________ 。(已知 的结构式为
的结构式为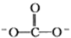 )
)
②NaNT可以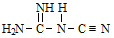 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________ ,1mol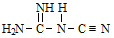 中含有σ键的物质的量为
中含有σ键的物质的量为___________ 。
③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_________________ 。
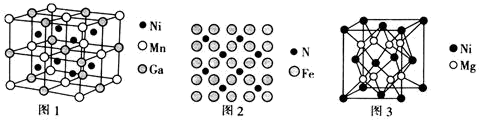
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为________ 。晶胞中离1个Mn原子最近的Ni原子有________ 个。
(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为________ 。
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________ g/cm3(列出计算表达式,NA表示阿伏加 德罗常数的数值).
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是
 的结构式为
的结构式为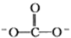 )
)②NaNT可以
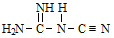 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为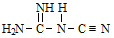 中含有σ键的物质的量为
中含有σ键的物质的量为③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为

(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为
您最近一年使用:0次
解题方法
6 . 硫及其化合物有许多用途。相关物质的物理常数如表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____ 。
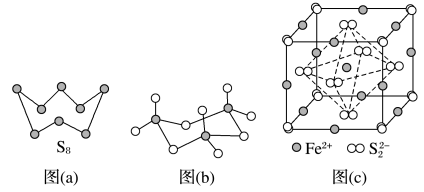
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______ 。
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________ ,晶胞边长为anm,FeS2相对式量为M、阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为_____ g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______ nm。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数
您最近一年使用:0次
名校
7 . 砷(As)元素及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态As原子的核外电子排布式为_____ ,砷与硒的第一电离能较大的是_____ 。
(2)传统中药的砷剂俗称“砒霜”,其分子结构如图所示,该化合物中As、O原子的杂化方式分别为____ 、_____ 。

(3)Na3AsO4可作杀虫剂。 的立体构型为
的立体构型为____ ,与其互为等电子体的分子的化学式为_____ (任写一种)。
(4)H3AsO4和H3AsO3是砷的两种含氧酸,请根据物质结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因_____ 。
(1)基态As原子的核外电子排布式为
(2)传统中药的砷剂俗称“砒霜”,其分子结构如图所示,该化合物中As、O原子的杂化方式分别为

(3)Na3AsO4可作杀虫剂。
 的立体构型为
的立体构型为(4)H3AsO4和H3AsO3是砷的两种含氧酸,请根据物质结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因
您最近一年使用:0次
2019-04-21更新
|
99次组卷
|
3卷引用:内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题
内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题吉林省乾安县第七中学2018-2019学年高二下学期第一次质量检测化学试题(已下线)第36讲 分子结构与性质(精练)-2021年高考化学一轮复习讲练测
8 . 第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________ ,TiCl4沸点136℃,熔点-25℃,晶体类型为___________ 晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________ 。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________ ;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________ ,理由是______________________ 。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________ 堆积;该晶胞中原子的体积占晶胞体积的百分率为___________ 。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏伽德罗常数的值,则钴原子半径为___________ mm,钴的相对原子质量可表示为___________ 。
(1)钛原子的价电子排布式为
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏伽德罗常数的值,则钴原子半径为
您最近一年使用:0次
2019-02-05更新
|
600次组卷
|
2卷引用:内蒙古开鲁县第一中学2019-2020学年高二下学期期中考试化学试题
名校
9 . 硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________ ,第四电离能I4(Co) < I4(Fe),其原因是______________________________ ;Co 与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是___________________________________________________ .
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______ ,中心原子杂化方式是_______ ,与其互为等电子体的分子是_______ (举1例)。
(3)K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是___________________________________________________________________ 。
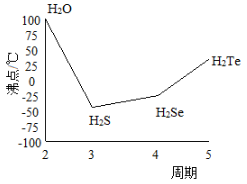
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图象所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。
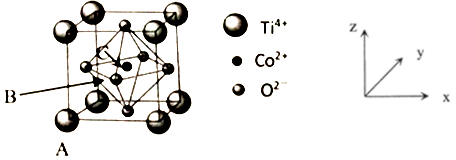
①已知A点的原子坐标参数为为(0,0,0),B点为(1/2,0,1/2),则C点的原子坐标参数为_____ 。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____ g/cm3(列出计算表达式即可)。
(1)基态Co原子价电子轨道排布式为
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是
(3)K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图象所示变为的原因是

(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(1/2,0,1/2),则C点的原子坐标参数为
②已知晶胞参数为a=0.5485nm,则该晶体的密度为
您最近一年使用:0次
2018-12-19更新
|
202次组卷
|
2卷引用:【全国百强校】内蒙古第一机械制造(集团)有限公司第一中学2019届高三上学期12月月考理科综合化学试题
解题方法
10 . 铂(Pt)可以和很多化合物形成配合物,生产生活中有重要的用途。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序___ 。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为_______ 。
②吡啶分子是大体积平面配体,其结构简式为 ,吡啶分子中氮原子的轨道杂化方式是
,吡啶分子中氮原子的轨道杂化方式是_____ ,分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡啶中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡啶中的大π键应表示为_____ ;1mol吡啶中含有σ键的数目为________
③二氯二吡啶合铂分子中存在的微粒间作用力有_____ (填字母)。
a.离子键b.配位键c.金属键d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由_____________ 。
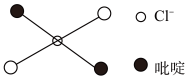
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是_____ 分子(其“极性”或“非极性”)。
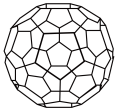
(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于____ 晶体;C60分子中五元环与六元环的数目比为__________ 。
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
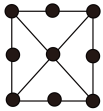
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=___ nm(列出计算式即可)。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为
②吡啶分子是大体积平面配体,其结构简式为
 ,吡啶分子中氮原子的轨道杂化方式是
,吡啶分子中氮原子的轨道杂化方式是 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡啶中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡啶中的大π键应表示为③二氯二吡啶合铂分子中存在的微粒间作用力有
a.离子键b.配位键c.金属键d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是

(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于

(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=

您最近一年使用:0次



