1 . 氮、磷、硫、氯等非金属元素的单质和化合物在工农业生产中有重要应用。回答下列问题:
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为___________ 。某厂废液中含有2%∼5%的 ,直接排放会造成污染,下列物质能使
,直接排放会造成污染,下列物质能使 转化为
转化为 的是
的是___________ (填标号)。
A. B.
B. C.
C.
(2) 及正盐
及正盐 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。
① 为
为___________ 元酸(填“一”二”或“三”),磷原子的杂化方式为___________ 。
②利用 进行化学镀银,反应中氧化剂与还原剂的物质的量之比为
进行化学镀银,反应中氧化剂与还原剂的物质的量之比为 ,则氧化产物为
,则氧化产物为___________ (填化学式)。
(3)硫代硫酸钠晶体( ),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:
),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:___________ 。
(4)氯气与氢氧化钠在70℃时反应,生成物中 和
和 的物质的量之比为
的物质的量之比为 ,其离子方程式为
,其离子方程式为___________ 。
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为
 ,直接排放会造成污染,下列物质能使
,直接排放会造成污染,下列物质能使 转化为
转化为 的是
的是A.
 B.
B. C.
C.
(2)
 及正盐
及正盐 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。①
 为
为②利用
 进行化学镀银,反应中氧化剂与还原剂的物质的量之比为
进行化学镀银,反应中氧化剂与还原剂的物质的量之比为 ,则氧化产物为
,则氧化产物为(3)硫代硫酸钠晶体(
 ),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:
),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:(4)氯气与氢氧化钠在70℃时反应,生成物中
 和
和 的物质的量之比为
的物质的量之比为 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2 . 氮的许多重要化合物在半导体材料及炸药等方面用途非常广泛。回答下列问题:
(1)Cu3N是一种半导体材料。基态Cu原子的核外电子排布式为______ ;基态N原子电子占据的最高能级符号为______ ,其电子云轮廓图为______ 形。
(2)NH4NO3是一种炸药,可通过下列方法合成:HNO3+NH3=NH4NO3。
①NH4NO3属于______ 晶体,其中阴离子中氮原子的杂化方式是______ ,该阴离子的空间构型为______ 。
②NH3和NH 中
中 原子的杂化方式
原子的杂化方式______ (填“相同”或“不同”);键角:NH3______ (填“大于”“小于”或“等于”)NH 。
。
(1)Cu3N是一种半导体材料。基态Cu原子的核外电子排布式为
(2)NH4NO3是一种炸药,可通过下列方法合成:HNO3+NH3=NH4NO3。
①NH4NO3属于
②NH3和NH
 中
中 原子的杂化方式
原子的杂化方式 。
。
您最近一年使用:0次
2023-06-05更新
|
56次组卷
|
2卷引用:湖北省恩施土家族苗族自治州巴东县2022-2023学年高二下学期6月月考化学试题
解题方法
3 . 甲醇(CH3OH)是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_______ ,其核外电子共占据_______ 个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_______ ,其组成元素的电负性由小到大的顺序为_______ 。
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为_______ 。
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为_______ 。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为
②甲醇和甲醛中碳原子的杂化方式分别为
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为
您最近一年使用:0次
名校
4 . 许多元素及其化合物在科学研究和工业生产中具有广泛用途。下列说法错误的是
| A.基态N原子核外电子的运动状态有7种 |
| B.第二周期第一电离能介于B和N之间的元素有3种 |
C.金属盐 中心离子的配位数为6 中心离子的配位数为6 |
D.储氢材料 分子内存在的作用力有极性键、非极性键和配位键 分子内存在的作用力有极性键、非极性键和配位键 |
您最近一年使用:0次
解题方法
5 . 碳、铜、锡及其化合物有许多用途。回答下列问题。
(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为______ 。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的热稳定性比NH3__________ (填“强”或“弱”);P、S的第二电离能(I2)的大小关系为I2(P) __________ I2(S)(填“>”“<”或“=”),原因是_______________ 。
(3)CH3CH2COOH中C的杂化方式有_________ ;1mol苯中含σ键的数目为________ 。
(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为a nm,则晶体密度为__________ g·cm−3(用含NA的代数式表示);该晶体中P原子位于由铜原子形成的正八面体的空隙中,则该正八面体的边长为________ nm。
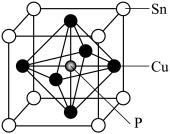
(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的热稳定性比NH3
(3)CH3CH2COOH中C的杂化方式有
(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为a nm,则晶体密度为

您最近一年使用:0次
名校
解题方法
6 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________ 。
②Fe的基态原子共有________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是____________________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ ,中心原子的杂化方式为________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO________ (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
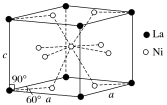
①该晶体的化学式为________________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________ 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为
②Fe的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2020-11-12更新
|
346次组卷
|
13卷引用:2016届湖北省襄阳五中高三5月模拟三理综化学试卷
2016届湖北省襄阳五中高三5月模拟三理综化学试卷湖北省孝感市八校2018届高三上学期期末考试理综化学试题2016届河北省晋州一中高三上学期期末理综化学试卷2016届安徽省安庆一中高三热身考试理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷四川省内江市2017届高三第五次模拟考试理综化学试题陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题苏教版2017届高三单元精练检测十一化学试题(已下线)2018年6月1日 押高考化学第35题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密(已下线)2019年5月31日《每日一题》四轮复习—— 押高考化学第35题(2)四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
名校
解题方法
7 . 由P、S、Cl、Mg、Ni、Sn等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子排布式为____________ ,P、S、Cl的第一电离能由大到小顺序为___________ 。
(2)SCl2分子中的中心原子杂化轨道类型是_________ ,该分子构型为_______ 。
(3)Ni与CO能形成配合物Ni(CO)4,1mol该分子中配位键个数为_______ 。
(4)已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO________ NiO(填“>”、“<”或“=”),理由是________ 。
(5)一个金刚石晶胞含有_______ 个碳原子。已知灰锡的晶体结构和金刚石相似,灰锡的相对原子质量为M,晶胞边长为apm,则其晶体的密度ρ=________ g·cm-3
(1)基态Cl原子核外电子排布式为
(2)SCl2分子中的中心原子杂化轨道类型是
(3)Ni与CO能形成配合物Ni(CO)4,1mol该分子中配位键个数为
(4)已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO
(5)一个金刚石晶胞含有
您最近一年使用:0次
解题方法
8 . 含Ni、As元素的物质在生产生活中有重要的用途。回答下列问题:
(1)基态Ni2+核外电子排布式为________ 。
(2)AsCl3分子的立体构型为________ 。
(3)某个Ni(Ⅱ)有机配合物的结构如图所示:
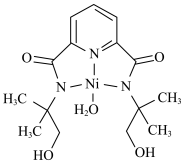
①该分子中N原子的杂化方式为________ 、________ 。
②请在图中用“→”标出Ni2+的配位键______ 。
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为________ 。
(5) 的酸性强于
的酸性强于 的原因是
的原因是______ ,AsH3的键角小于NH3的原因是________ 。
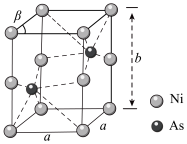
(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为________ ,已知晶胞参数分别为apm、apm、bpm和β=60°,则该晶胞的密度为________  (设阿伏加 德罗常数的值为NA)
(设阿伏加 德罗常数的值为NA)
(1)基态Ni2+核外电子排布式为
(2)AsCl3分子的立体构型为
(3)某个Ni(Ⅱ)有机配合物的结构如图所示:

①该分子中N原子的杂化方式为
②请在图中用“→”标出Ni2+的配位键
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为
(5)
 的酸性强于
的酸性强于 的原因是
的原因是(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为
 (设阿伏加 德罗常数的值为NA)
(设阿伏加 德罗常数的值为NA)
您最近一年使用:0次
名校
9 . 结合所学知识回答问题:
(1)碳和硅及其化合物具有广泛的用途
①下列碳原子最外层电子排布图表示的状态中,能量最低的是____ ;
A.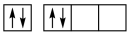 B.
B.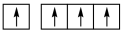 C.
C.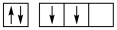 D.
D.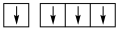
②60克SiO2晶体中含有的Si-O键数目为____ (用NA表示);
③有机物M(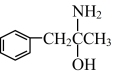 )中碳的杂化类型有
)中碳的杂化类型有____ 杂化。
(2)某一元素的逐级电离能(kJ/mol)数据如下:
该元素原子最外层电子数是____ 。
(3)氮元素能能形成多种化合物。
①肼( )分子中孤电子对数与σ键的数目之比为
)分子中孤电子对数与σ键的数目之比为____
②正硝酸钠( )为白色晶体,是一种重要的化工原料,其中
)为白色晶体,是一种重要的化工原料,其中 离子的空间构型为
离子的空间构型为_____ ,写出一种与其互为等电子体的分子____ (填化学式)。
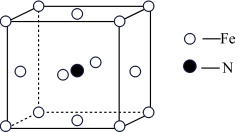
③铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,其化学式为____ 。若两个最近的 原子间的距离为
原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是___  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )。
)。
(1)碳和硅及其化合物具有广泛的用途
①下列碳原子最外层电子排布图表示的状态中,能量最低的是
A.
 B.
B. C.
C. D.
D.
②60克SiO2晶体中含有的Si-O键数目为
③有机物M(
 )中碳的杂化类型有
)中碳的杂化类型有(2)某一元素的逐级电离能(kJ/mol)数据如下:
| 第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 |
800 6 6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
该元素原子最外层电子数是
(3)氮元素能能形成多种化合物。
①肼(
 )分子中孤电子对数与σ键的数目之比为
)分子中孤电子对数与σ键的数目之比为②正硝酸钠(
 )为白色晶体,是一种重要的化工原料,其中
)为白色晶体,是一种重要的化工原料,其中 离子的空间构型为
离子的空间构型为③铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,其化学式为
 原子间的距离为
原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
10 . 镁及其化合物在制药、材料及航空等行业中用途广泛,请回答下列问题:
(1)下列 原子的核外电子排布式中,能量最高的是
原子的核外电子排布式中,能量最高的是________ (填字母,下同),能量最低的是________ 。
a.
b.
c.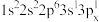
d.
(2)氧化镁是一种传统的耐火材料,熔点为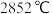 ,其熔融物中有自由移动的
,其熔融物中有自由移动的 和
和 ,上述两种离子半径的大小关系为
,上述两种离子半径的大小关系为___________ 。
(3)叶绿素是自然界中常见的含镁有机化合物,其结构示意图如下所示:

由叶绿素分子的结构可知,其中有 、
、 两种杂化方式的原子有
两种杂化方式的原子有_______ ,分子中存在________ (填字母)。
a.配位键 b. 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键
(4)已知 与部分卤化钠的晶格能及离子间距如下表所示:
与部分卤化钠的晶格能及离子间距如下表所示:
通过玻恩—哈伯循环计算 晶格能的过程如下图所示(能量数据单位均为kJ/mol)。
晶格能的过程如下图所示(能量数据单位均为kJ/mol)。

晶格能的大小与_______ 有关, 的第一电离能为
的第一电离能为_______ kJ/mol。
(5)尖晶石是由镁铝氧化物组成的矿物,有些尖晶石透明且颜色漂亮,可作为宝石。尖晶石的某种立方晶胞结构如图甲所示,晶胞中含有A型和B型两种结构单元。

则该尖晶石的化学式为________ ,若晶胞边长为 ,阿伏加 德罗常数的值为
,阿伏加 德罗常数的值为 ,则该尖晶石的密度为
,则该尖晶石的密度为_______  (用含有a、
(用含有a、 的代数式表示)
的代数式表示)
(1)下列
 原子的核外电子排布式中,能量最高的是
原子的核外电子排布式中,能量最高的是a.

b.

c.
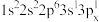
d.

(2)氧化镁是一种传统的耐火材料,熔点为
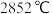 ,其熔融物中有自由移动的
,其熔融物中有自由移动的 和
和 ,上述两种离子半径的大小关系为
,上述两种离子半径的大小关系为(3)叶绿素是自然界中常见的含镁有机化合物,其结构示意图如下所示:

由叶绿素分子的结构可知,其中有
 、
、 两种杂化方式的原子有
两种杂化方式的原子有a.配位键 b.
 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键(4)已知
 与部分卤化钠的晶格能及离子间距如下表所示:
与部分卤化钠的晶格能及离子间距如下表所示:| 化合物 |  |  |  |  |
晶格能 | 3890 | 686 | 736 | 787 |
离子间距 | 205 | 311 | 290 | 276 |
通过玻恩—哈伯循环计算
 晶格能的过程如下图所示(能量数据单位均为kJ/mol)。
晶格能的过程如下图所示(能量数据单位均为kJ/mol)。
晶格能的大小与
 的第一电离能为
的第一电离能为(5)尖晶石是由镁铝氧化物组成的矿物,有些尖晶石透明且颜色漂亮,可作为宝石。尖晶石的某种立方晶胞结构如图甲所示,晶胞中含有A型和B型两种结构单元。

则该尖晶石的化学式为
 ,阿伏加 德罗常数的值为
,阿伏加 德罗常数的值为 ,则该尖晶石的密度为
,则该尖晶石的密度为 (用含有a、
(用含有a、 的代数式表示)
的代数式表示)
您最近一年使用:0次



