名校
1 . 卤族元素的单质和化合物在生产生活中有重要的用途。请回答:
(1)卤素元素位于元素周期表的___________ 区,溴原子的原子核外有___________ 种不同运动状态的电子,其M能层电子排布式为___________ 。
(2) 中心原子的杂化类型为
中心原子的杂化类型为___________ , 的空间构型为
的空间构型为___________ 。
(3)一定条件下 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)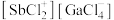 或(b)
或(b)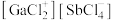 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为___________ (填“a”或“b”),理由是___________ 。
(4)在离子晶体中,当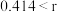 (阳离子)
(阳离子)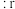 (阴离子)
(阴离子)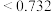 时,
时, 型化合物往往采用和
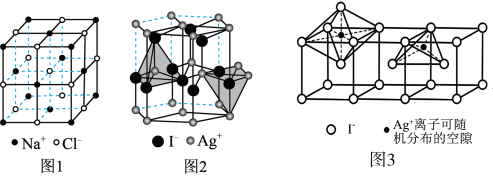
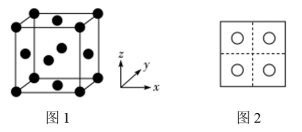
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为___________ ,造成 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是___________ 。
a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为 ,高为
,高为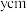 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为___________ 列出计算式。
(5)当温度处于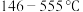 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=___________ 。
(1)卤素元素位于元素周期表的
(2)
 中心原子的杂化类型为
中心原子的杂化类型为 的空间构型为
的空间构型为(3)一定条件下
 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)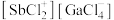 或(b)
或(b)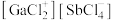 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为(4)在离子晶体中,当
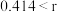 (阳离子)
(阳离子)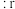 (阴离子)
(阴离子)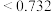 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为
 ,高为
,高为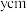 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为
(5)当温度处于
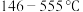 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=
您最近一年使用:0次
名校
解题方法
2 . 铜是常见的、用途广泛的金属元素之一、
(1)基态Cu原子核外未成对电子所在的原子轨道是_______ 。
(2)一价铜离子某配合物的结构如图所示:_______ 。
②上述配合物中所含元素电负性由大到小的顺序为_______ (用元素符号表示)。
(3)常见的铜的氧化物有CuO和 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是 。
。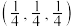 、
、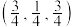 、
、_______ 和_______ 。
② 晶体的密度是
晶体的密度是_______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态Cu原子核外未成对电子所在的原子轨道是
(2)一价铜离子某配合物的结构如图所示:

②上述配合物中所含元素电负性由大到小的顺序为
(3)常见的铜的氧化物有CuO和
 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是 。
。
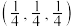 、
、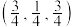 、
、②
 晶体的密度是
晶体的密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
3 . 晶体世界丰富多彩、复杂多样,各类晶体具有的不同结构特点,决定着它们具有不同的性质和用途。氢化铝钠 是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为
是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为 。下列说法错误的是
。下列说法错误的是
 是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为
是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为 。下列说法错误的是
。下列说法错误的是
A. 中中心原子 中中心原子 的杂化方式为 的杂化方式为 杂化 杂化 |
B. 晶体中,与 晶体中,与 紧邻且等距的 紧邻且等距的 有4个 有4个 |
C.若 的分数坐标为 的分数坐标为 ,则 ,则 的分数坐标为 的分数坐标为 |
D. 晶体的密度为 晶体的密度为 |
您最近一年使用:0次
名校
解题方法
4 . 由 、
、 、
、 、
、 等元素组成的新型材料有着广泛的用途,回答下列问题。
等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)与 相邻的铜基态原子核外电子排布式是
相邻的铜基态原子核外电子排布式是_________ , 、
、 、
、 的第一电离能由大到小顺序为
的第一电离能由大到小顺序为_________ 。
(2) 分子中的中心原子杂化轨道类型是
分子中的中心原子杂化轨道类型是_________ ,该分子构型为_________ 。
(3)已知 与
与 的晶体结构(如图1)相同,其中
的晶体结构(如图1)相同,其中 和
和 的离子半径分别为
的离子半径分别为 和
和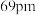 。则熔点:
。则熔点:
_________  (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是_________ 。

(4)若 晶胞中离子坐标参数
晶胞中离子坐标参数 为
为 ,
, 为
为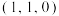 ,则
,则 离子坐标参数为
离子坐标参数为_________ 。
(5)若 晶胞边长为
晶胞边长为 ,试计算
,试计算 晶体的密度
晶体的密度_________  (列出计算式即可)。
(列出计算式即可)。
 、
、 、
、 、
、 等元素组成的新型材料有着广泛的用途,回答下列问题。
等元素组成的新型材料有着广泛的用途,回答下列问题。(1)与
 相邻的铜基态原子核外电子排布式是
相邻的铜基态原子核外电子排布式是 、
、 、
、 的第一电离能由大到小顺序为
的第一电离能由大到小顺序为(2)
 分子中的中心原子杂化轨道类型是
分子中的中心原子杂化轨道类型是(3)已知
 与
与 的晶体结构(如图1)相同,其中
的晶体结构(如图1)相同,其中 和
和 的离子半径分别为
的离子半径分别为 和
和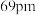 。则熔点:
。则熔点:
 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是
(4)若
 晶胞中离子坐标参数
晶胞中离子坐标参数 为
为 ,
, 为
为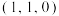 ,则
,则 离子坐标参数为
离子坐标参数为(5)若
 晶胞边长为
晶胞边长为 ,试计算
,试计算 晶体的密度
晶体的密度 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
5 . 碳族元素及其化合物在国家工业领域有非常重要用途。回答下列问题:
(1)基态锗原子价层电子排布式为_______ 。
(2)干冰晶胞如图,顶点和面心是 分子。在干冰晶体中每个
分子。在干冰晶体中每个  分子周围有
分子周围有_______ 个  分子相邻。
分子相邻。
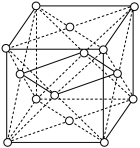
(3)关于C、Si及其化合物的结构和性质, 下列叙述正确的是_______
(4)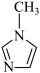 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有_______ 。
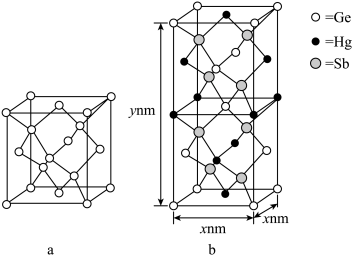
(5)理论计算预测, 由汞(Hg) 、锗 (Ge) 、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图 a 所示)中部分Ge原子被Hg和Sb取代后形成,设X的最简式的式量Mr, 则X晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)基态锗原子价层电子排布式为
(2)干冰晶胞如图,顶点和面心是
 分子。在干冰晶体中每个
分子。在干冰晶体中每个  分子周围有
分子周围有 分子相邻。
分子相邻。
(3)关于C、Si及其化合物的结构和性质, 下列叙述正确的是_______
| A.分子稳定性: C2H6<Si2H6 |
B. 是原子晶体, 硬度:SiC>C(金刚石) 是原子晶体, 硬度:SiC>C(金刚石) |
| C.还原性: SiH4<CH4 |
D.Si的原子半径大于C原子半径, 难以形成 键 键 |
 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有(5)理论计算预测, 由汞(Hg) 、锗 (Ge) 、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图 a 所示)中部分Ge原子被Hg和Sb取代后形成,设X的最简式的式量Mr, 则X晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
6 . 卟啉锌超分子在现代农业、科技和国防建设中有着许多独特的用途,其分子结构如图所示。下列关于卟啉锌超分子的说法正确的是
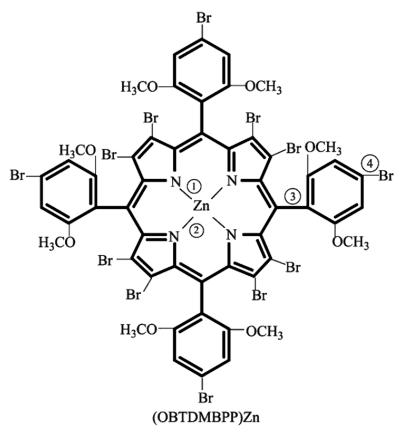

A.基态 原子的核外有7种不同空间运动状态的电子 原子的核外有7种不同空间运动状态的电子 |
| B.图中①②③④处的化学键属于配位键的是①② |
C.该超分子中的碳原子采取的杂化方式为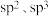 |
| D.该超分子含有的第二周期元素中,第一电离能最大的是O元素 |
您最近一年使用:0次
名校
7 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1) 溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(
溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根( )简写成
)简写成 ],反应的化学方程式为:
],反应的化学方程式为: 。
。
①基态 的核外电子排布式为
的核外电子排布式为___________ 。
② 中C原子的杂化轨道类型为
中C原子的杂化轨道类型为___________ 。
③ 中所含非金属元素的电负性由大到小的顺序是
中所含非金属元素的电负性由大到小的顺序是___________ (用元素符号表示)。
④ 中N原子形成的H—N—H键角
中N原子形成的H—N—H键角___________ (填“大于”“小于”或“等于”)气态 中的键角,原因是
中的键角,原因是___________ 。
⑤1个 中含有的共价键数为
中含有的共价键数为___________ 。
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为___________ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为___________ 。
③已知该合金晶体的边长为a cm,则最近的两个Al原子间的距离为___________ nm
(1)
 溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(
溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根( )简写成
)简写成 ],反应的化学方程式为:
],反应的化学方程式为: 。
。①基态
 的核外电子排布式为
的核外电子排布式为②
 中C原子的杂化轨道类型为
中C原子的杂化轨道类型为③
 中所含非金属元素的电负性由大到小的顺序是
中所含非金属元素的电负性由大到小的顺序是④
 中N原子形成的H—N—H键角
中N原子形成的H—N—H键角 中的键角,原因是
中的键角,原因是⑤1个
 中含有的共价键数为
中含有的共价键数为(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的边长为a cm,则最近的两个Al原子间的距离为
您最近一年使用:0次
8 . 铜及其化合物有许多特殊用途,最近科研人员用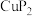 作电极电催化
作电极电催化 ,
, 经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为
经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为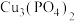 和
和 。回答下列问题:。
。回答下列问题:。
(1)基态磷原子的价电子排布图为_______ ,基态Cu原子电子占据最高能级的电子云轮廓图为_______ 形。
(2)Cu、O、P三种元素中,电负性由大到小的顺序为_______ 。
(3) 的空间构型为
的空间构型为_______ ,其中P采取_______ 杂化方式。
(4)1-丁醇、1-氯丁烷的沸点依次为118℃、78.2℃,前者沸点较高的原因是_______ 。
(5)Cu、Mn、Al形成的一种金属间化合物的晶体结构如图所示。已知晶胞参数为apm,内部正方形的边长为bpm,NA表示阿伏加德罗常数。

该晶体的密度为_______ (用含a、NA的代数式表示,不用化简);P、Q间的距离为_______ pm(要求同上)。
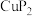 作电极电催化
作电极电催化 ,
, 经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为
经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为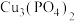 和
和 。回答下列问题:。
。回答下列问题:。(1)基态磷原子的价电子排布图为
(2)Cu、O、P三种元素中,电负性由大到小的顺序为
(3)
 的空间构型为
的空间构型为(4)1-丁醇、1-氯丁烷的沸点依次为118℃、78.2℃,前者沸点较高的原因是
(5)Cu、Mn、Al形成的一种金属间化合物的晶体结构如图所示。已知晶胞参数为apm,内部正方形的边长为bpm,NA表示阿伏加德罗常数。

该晶体的密度为
您最近一年使用:0次
名校
解题方法
9 . 氮的相关化合物在材料等方面有重要用途。回答下列问题:
(1)基态N原子的核外电子排布式为_______ ,第一电离能
_______  (填“大于”或“小于)。
(填“大于”或“小于)。
(2)①N及其同族的P、As均可形成类似的氢化物, 的沸点由高到低的顺序为
的沸点由高到低的顺序为_______ (填化学式)。
② 的键角
的键角_______ 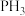 的键角(填“大于”或“小于),原因为
的键角(填“大于”或“小于),原因为_______ 。
(3)写出 溶于氨水形成配合物的离子方程式
溶于氨水形成配合物的离子方程式_______ 。
(4) 是一种全氮阳离子形成的高能物质,其阳离子结构如图所示,其中N原子的杂化轨道类型为
是一种全氮阳离子形成的高能物质,其阳离子结构如图所示,其中N原子的杂化轨道类型为_______ 。

(5)科学家近期首次合成了具有极性对称性的氮化物钙钛矿材料-LaWN₃,其立方晶胞结构如图所示,晶胞中La、W、N分别处于顶角、体心、面心位置,晶胞参数为a nm。

①与La紧邻的N个数为_______ 。
②在 ,晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于
,晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于_______ 位置,N处于_______ 位置。
③设La、W、N的式量分别为 阿伏加德罗常数的值为
阿伏加德罗常数的值为 则该晶体的密度为
则该晶体的密度为_______  (列出计算表达式)。
(列出计算表达式)。
(1)基态N原子的核外电子排布式为

 (填“大于”或“小于)。
(填“大于”或“小于)。(2)①N及其同族的P、As均可形成类似的氢化物,
 的沸点由高到低的顺序为
的沸点由高到低的顺序为②
 的键角
的键角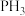 的键角(填“大于”或“小于),原因为
的键角(填“大于”或“小于),原因为(3)写出
 溶于氨水形成配合物的离子方程式
溶于氨水形成配合物的离子方程式(4)
 是一种全氮阳离子形成的高能物质,其阳离子结构如图所示,其中N原子的杂化轨道类型为
是一种全氮阳离子形成的高能物质,其阳离子结构如图所示,其中N原子的杂化轨道类型为
(5)科学家近期首次合成了具有极性对称性的氮化物钙钛矿材料-LaWN₃,其立方晶胞结构如图所示,晶胞中La、W、N分别处于顶角、体心、面心位置,晶胞参数为a nm。

①与La紧邻的N个数为
②在
 ,晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于
,晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于③设La、W、N的式量分别为
 阿伏加德罗常数的值为
阿伏加德罗常数的值为 则该晶体的密度为
则该晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
名校
解题方法
10 . 碳族元素及其化合物在国家工业领域有非常重要用途。回答下列问题:
(1)基态锗原子价层电子排布式为_______ 。
(2)我国提出力争在2030年前实现碳达峰、2060年前实现碳中和,我国科学家研发的“液态阳光”项目利用了太阳能产生的电能电解水制氢,再选择高效催化剂将二氧化碳加氢合成甲醇等液体燃料,这将为实现碳达峰、碳中和提供了科学的方法,其中CO2分子中有_______ σ键和_______ π键,在干冰晶体中每个CO2分子周围有_______ 个CO2分子相邻。

(3)关于C、Si及其化合物的结构和性质,下列叙述正确的是_______(填序号)。
(4) 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有_______ 。
(5)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①b为X的晶胞,该晶胞中粒子个数比Hg:Ge:Sb=_______ 。
②设X的最简式的式量为Mr,则X晶体的密度为_______ g/cm3(列出计算式)。
(1)基态锗原子价层电子排布式为
(2)我国提出力争在2030年前实现碳达峰、2060年前实现碳中和,我国科学家研发的“液态阳光”项目利用了太阳能产生的电能电解水制氢,再选择高效催化剂将二氧化碳加氢合成甲醇等液体燃料,这将为实现碳达峰、碳中和提供了科学的方法,其中CO2分子中有

(3)关于C、Si及其化合物的结构和性质,下列叙述正确的是_______(填序号)。
| A.分子稳定性:C2H6<Si2H6 |
| B.SiC是原子晶体,硬度:SiC>C(金刚石) |
| C.还原性:SiH4<CH4 |
| D.Si的原子半径大于C原子半径,难以形成π键 |
 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有(5)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①b为X的晶胞,该晶胞中粒子个数比Hg:Ge:Sb=
②设X的最简式的式量为Mr,则X晶体的密度为
您最近一年使用:0次
2022-06-06更新
|
320次组卷
|
2卷引用:黑龙江省牡丹江市第二高级中学2022-2023学年高三上学期第二次阶段测试化学试题



