名校
1 . 氮元素及其化合物在生产、生活中用途广泛。回答下列问题
(1)基态氮原子的价电子排布式为___________ 。
(2)三硝基胺 (
( )是一种新型的火箭燃料,由于硝基吸电子能力强,使中心N原子上无孤对电子,则中心N原子的杂化方式为
)是一种新型的火箭燃料,由于硝基吸电子能力强,使中心N原子上无孤对电子,则中心N原子的杂化方式为___________ 。
(3)过渡金属氮化物因其优异的催化性能(加氢处理、光和电化学催化等)受到了广泛关注。贵金属钼(Mo)的氮化物可作将 还原为氨的反应的催化剂。钼的氮化物的某立方晶体结构如图所示。晶体结构的棱长为anm,该晶体的化学式为
还原为氨的反应的催化剂。钼的氮化物的某立方晶体结构如图所示。晶体结构的棱长为anm,该晶体的化学式为___________ ,晶体密度为___________  (列出计算式)。
(列出计算式)。

(4)氮化硼(BN)晶体有多种相结构,其中六方相氮化硼具有石墨样片层结构(如图所示,N、B交替)俗称白石墨,但白石墨不能导电,其原因是___________ 。

(5)肼( )分子可视为
)分子可视为 分子中的一个氢原子被氨基(
分子中的一个氢原子被氨基( )取代形成的另一种氮的氢化物。肼分子中的所有原子
)取代形成的另一种氮的氢化物。肼分子中的所有原子___________ (填“在”或“不在”)同一平面。肼与氨一样具有碱性,能与硫酸反应生成盐,其酸式盐化学式为___________ 。
(6)白磷在氯气中燃烧可以得到 和
和 ,研究发现固态
,研究发现固态 和
和 均为离子晶体,固态
均为离子晶体,固态 由两种含磷离子构成,其阴离子为
由两种含磷离子构成,其阴离子为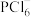 ,则其阳离子的空间结构为
,则其阳离子的空间结构为___________ 形。固态 的阴离子则为
的阴离子则为 ,固态
,固态 和
和 结构存在差异的原因是
结构存在差异的原因是___________ 。
(1)基态氮原子的价电子排布式为
(2)三硝基胺
 (
( )是一种新型的火箭燃料,由于硝基吸电子能力强,使中心N原子上无孤对电子,则中心N原子的杂化方式为
)是一种新型的火箭燃料,由于硝基吸电子能力强,使中心N原子上无孤对电子,则中心N原子的杂化方式为(3)过渡金属氮化物因其优异的催化性能(加氢处理、光和电化学催化等)受到了广泛关注。贵金属钼(Mo)的氮化物可作将
 还原为氨的反应的催化剂。钼的氮化物的某立方晶体结构如图所示。晶体结构的棱长为anm,该晶体的化学式为
还原为氨的反应的催化剂。钼的氮化物的某立方晶体结构如图所示。晶体结构的棱长为anm,该晶体的化学式为 (列出计算式)。
(列出计算式)。
(4)氮化硼(BN)晶体有多种相结构,其中六方相氮化硼具有石墨样片层结构(如图所示,N、B交替)俗称白石墨,但白石墨不能导电,其原因是

(5)肼(
 )分子可视为
)分子可视为 分子中的一个氢原子被氨基(
分子中的一个氢原子被氨基( )取代形成的另一种氮的氢化物。肼分子中的所有原子
)取代形成的另一种氮的氢化物。肼分子中的所有原子(6)白磷在氯气中燃烧可以得到
 和
和 ,研究发现固态
,研究发现固态 和
和 均为离子晶体,固态
均为离子晶体,固态 由两种含磷离子构成,其阴离子为
由两种含磷离子构成,其阴离子为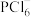 ,则其阳离子的空间结构为
,则其阳离子的空间结构为 的阴离子则为
的阴离子则为 ,固态
,固态 和
和 结构存在差异的原因是
结构存在差异的原因是
您最近一年使用:0次
名校
解题方法
2 . 铝及铝的化合物是当前用途十分广泛的、最经济适用的材料之一。回答下列问题:
(1)基态Al原子的核外电子排布式________ ;Al3+的最高能级电子云轮廓形状为________ ;铝的第一电离能低于镁的原因是________ 。
(2)氧炔焰的温度可以达到3200℃左右,用于焊接金属铝、不锈钢、铜等金属。乙炔中心C原子的轨道杂化类型为________ 。铝的熔点660℃、沸点2327℃,高于镁的熔点648℃、沸点1107℃,原因是________ 。
(3)冰晶石(Na3AlF6)是炼铝的助熔剂,由两种微粒构成,冰晶石的晶胞结构如下图所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心以及大立方体的体心,那么大立方体的●所代表的微粒是________ (填微粒符号)。________ ,配位数为________ 。若已知Al的原子半径为rnm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则Al晶体的密度为________ g/cm3(用字母表示)。
(1)基态Al原子的核外电子排布式
(2)氧炔焰的温度可以达到3200℃左右,用于焊接金属铝、不锈钢、铜等金属。乙炔中心C原子的轨道杂化类型为
(3)冰晶石(Na3AlF6)是炼铝的助熔剂,由两种微粒构成,冰晶石的晶胞结构如下图所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心以及大立方体的体心,那么大立方体的●所代表的微粒是
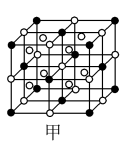

您最近一年使用:0次
3 . 氮的许多重要化合物在半导体材料及炸药等方面用途非常广泛。回答下列问题:
(1)Cu3N是一种半导体材料。基态Cu原子的核外电子排布式为______ ;基态N原子电子占据的最高能级符号为______ ,其电子云轮廓图为______ 形。
(2)NH4NO3是一种炸药,可通过下列方法合成:HNO3+NH3=NH4NO3。
①NH4NO3属于______ 晶体,其中阴离子中氮原子的杂化方式是______ ,该阴离子的空间构型为______ 。
②NH3和NH 中
中 原子的杂化方式
原子的杂化方式______ (填“相同”或“不同”);键角:NH3______ (填“大于”“小于”或“等于”)NH 。
。
(1)Cu3N是一种半导体材料。基态Cu原子的核外电子排布式为
(2)NH4NO3是一种炸药,可通过下列方法合成:HNO3+NH3=NH4NO3。
①NH4NO3属于
②NH3和NH
 中
中 原子的杂化方式
原子的杂化方式 。
。
您最近一年使用:0次
2023-06-05更新
|
56次组卷
|
2卷引用:辽宁省凌源市普通高中2022-2023学年高二下学期6月月考化学试题
4 . 第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)基态Se原子的价层电子轨道表示式为______ ,O3分子内的共价键类型为______ (填“极性共价键”或“非极性共价键”)。
(2)水丰富而独特的性质与其结构密切相关。
①下列事实可用“水分子间存在氢键”解释的是______ (填标号)。
a.冰的密度比水的小
b.水的沸点比硫化氢的沸点高
c.水的热稳定性比硫化氢强
d.水分子为极性分子
②酸溶于水可形成 ,
, 的电子式为
的电子式为______ 。判断 和
和 的键角大小;
的键角大小;
______ (填“>”或“<”) 。
。
(3)硫元素形成的化合物 广泛应用于医药、印染等行业,隔绝空气加热后可分解生成
广泛应用于医药、印染等行业,隔绝空气加热后可分解生成 、
、 、
、 、
、 及
及 。
。 中心原子
中心原子 的轨道杂化类型为
的轨道杂化类型为______ , 极易溶于水的原因是
极易溶于水的原因是____________ (任答一点)。
(4) 的空间结枃为
的空间结枃为______ 。
(1)基态Se原子的价层电子轨道表示式为
(2)水丰富而独特的性质与其结构密切相关。
①下列事实可用“水分子间存在氢键”解释的是
a.冰的密度比水的小
b.水的沸点比硫化氢的沸点高
c.水的热稳定性比硫化氢强
d.水分子为极性分子
②酸溶于水可形成
 ,
, 的电子式为
的电子式为 和
和 的键角大小;
的键角大小;
 。
。(3)硫元素形成的化合物
 广泛应用于医药、印染等行业,隔绝空气加热后可分解生成
广泛应用于医药、印染等行业,隔绝空气加热后可分解生成 、
、 、
、 、
、 及
及 。
。 中心原子
中心原子 的轨道杂化类型为
的轨道杂化类型为 极易溶于水的原因是
极易溶于水的原因是(4)
 的空间结枃为
的空间结枃为
您最近一年使用:0次
名校
解题方法
5 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)①将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解的离子方程式:_______ 。
②向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体 。该晶体中含有的化学键类型为
。该晶体中含有的化学键类型为_______ 。在该晶体中 含有
含有 键的数目为
键的数目为_______ 。
③ 中各元素电负性由大到小的顺序为
中各元素电负性由大到小的顺序为_______ ,其中N原子的杂化轨道类型为_______ 。
④ 中
中 的键角比独立存在的
的键角比独立存在的 分子结构中的键角
分子结构中的键角_______ 。(填“大”“小”或“相等”)
(2)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示

①合金的化学式为_______ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为_______ 。
③已知该合金晶体的密度为 ,则最近的两个Al原子间的距离为
,则最近的两个Al原子间的距离为_______ nm(阿伏加德罗常数的值用NA表示)。
(1)①将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解的离子方程式:
②向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体
 。该晶体中含有的化学键类型为
。该晶体中含有的化学键类型为 含有
含有 键的数目为
键的数目为③
 中各元素电负性由大到小的顺序为
中各元素电负性由大到小的顺序为④
 中
中 的键角比独立存在的
的键角比独立存在的 分子结构中的键角
分子结构中的键角(2)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的密度为
 ,则最近的两个Al原子间的距离为
,则最近的两个Al原子间的距离为
您最近一年使用:0次
6 . 碳和磷的单质和化合物在科研与生产中有许多重要用途。石墨烯是碳原子排列成一种正六边形的单层平面网状结构(如下图),熔点约为4125K,强度高,韧性好,几乎透明。石墨烯材料是目前最薄、导电性最好的材料之一、

请回答下列问题:
(1)石墨烯中每个碳原子均采取___________ 杂化。
(2)石墨烯具有良好导电性的原因是___________ 。
(3)石墨烯和金刚石互为___________ 金刚石的晶体类型为___________ 。
(4)石墨烯可作锂离子电池的负极材料,正极材料可是Li3V2(PO4)3,在Li3V2(PO4)3中PO 的空间构型为
的空间构型为___________ ,Li、O、P三种元素第一电离能由大到小的顺序为___________ 。
(5)V2+能与乙二胺形成配离子如图所示,该配离子中含有的化学键类型有___________ (填字母)。

a.配位键 b.共价键 c.离子键 d.金属键

请回答下列问题:
(1)石墨烯中每个碳原子均采取
(2)石墨烯具有良好导电性的原因是
(3)石墨烯和金刚石互为
(4)石墨烯可作锂离子电池的负极材料,正极材料可是Li3V2(PO4)3,在Li3V2(PO4)3中PO
 的空间构型为
的空间构型为(5)V2+能与乙二胺形成配离子如图所示,该配离子中含有的化学键类型有

a.配位键 b.共价键 c.离子键 d.金属键
您最近一年使用:0次
解题方法
7 . 水杨酸配合物在医药、农业等方面有重要的用途,一种水杨酸铜配合物(E) 的合成如下:
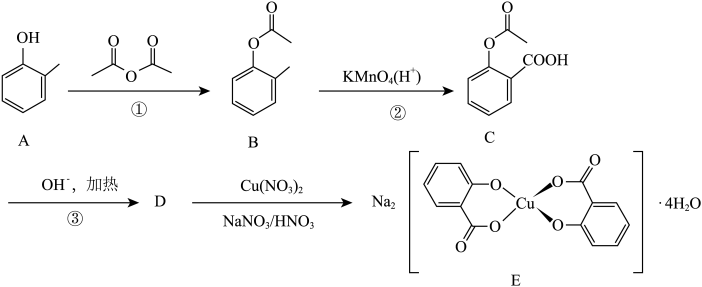
回答下列问题:
(1)同周期第一电离能比氧大的元素有_______ 种。
(2)圈出如图醋酸酐分子中采取 sp3杂化的原子_______ 。
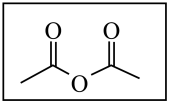
(3)邻甲基苯酚(A)在热水中的溶解度比冷水显著增大的主要原因是:_______ 。
(4)Cu(NO3)2中的化学键,除了σ键外,还存在_______ 。
(5)配离子中,Cu2+的配位数为_______ ,价电子的电子排布式为_______ 。
(6)写出反应③的离子方程式:_______ 。

回答下列问题:
(1)同周期第一电离能比氧大的元素有
(2)圈出如图醋酸酐分子中采取 sp3杂化的原子

(3)邻甲基苯酚(A)在热水中的溶解度比冷水显著增大的主要原因是:
(4)Cu(NO3)2中的化学键,除了σ键外,还存在
(5)配离子中,Cu2+的配位数为
(6)写出反应③的离子方程式:
您最近一年使用:0次
2020-07-23更新
|
94次组卷
|
2卷引用:辽宁省大连市旅顺口区2019-2020学年高二下学期期末考试化学试题
8 . 氟及锗其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______ 方法区分晶体、准晶体和非晶体。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为_______ ;
(3)NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4含有_______ mol配位键。
(4)向[Cu(H2O)4]2+溶液(天蓝色)中加入过量氨水将生成更稳定的[Cu(NH3)4]2+溶液(深蓝色),原因是_______ ;向深蓝色溶液中逐滴加入足量的稀硫酸,观察到的现象是_______ 。
(5)Ge 单晶具有金刚石型的结构,如图为晶胞结构,其中原子坐标参数 A 为(0,0,0),B 为( ,0,
,0, ),C 为(
),C 为( ,
, ,0),D 原子的坐标参数为
,0),D 原子的坐标参数为_______ ;晶体 Ge 的半径为 r,则计算其空间利用率的表达式为_______ (用含有 r 的表达式表示,不必化简)。若晶胞参数为 a nm,Ge 的相对原子质量为 M,NA表示阿伏加 德罗常数,则其晶胞密度为_______ g/cm3(列出计算式即可)。

(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为
(3)NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4含有
(4)向[Cu(H2O)4]2+溶液(天蓝色)中加入过量氨水将生成更稳定的[Cu(NH3)4]2+溶液(深蓝色),原因是
(5)Ge 单晶具有金刚石型的结构,如图为晶胞结构,其中原子坐标参数 A 为(0,0,0),B 为(
 ,0,
,0, ),C 为(
),C 为( ,
, ,0),D 原子的坐标参数为
,0),D 原子的坐标参数为
您最近一年使用:0次
2020-07-23更新
|
109次组卷
|
2卷引用:辽宁省大连市旅顺口区2019-2020学年高二下学期期末考试化学试题
9 . 黑色金属是指铁、铬、锰及其合金,在生产生活中有广泛的用途。请回答下列问题:
(1)基态铬原子的核外电子排布式____________ ,能量最高的原子轨道有____________ 种空间伸展方向。
(2)[Cr(H2O)3(NH3)3]3+中,与Cr3+形成配位键的原子是____________ ,NH3的VSEPR模型为____________ ,H2O中氧原子的杂化类型为____________ 。
(3)H2O的稳定性____________ (填大于或小于)NH3的稳定性,请用共价键知识解释原因:____________ 。
(4)元素铁和锰的逐级电离能如图所示,

元素X是____________ (填元素符号),判断理由是____________ 。
(5)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ和π键个数比为____________ ,C、O元素的第一电离能是C____________ O。(填“>”“<”或“=”)
(6)Fe3+可用SCN-检验,类卤素(SCN)2对应的酸有两种,分别为硫氰酸(H—S—C N))和异硫氰酸(H—N=C=S),这两种酸中沸点较高的是
N))和异硫氰酸(H—N=C=S),这两种酸中沸点较高的是____________ (填名称),原因是____________ 。
(1)基态铬原子的核外电子排布式
(2)[Cr(H2O)3(NH3)3]3+中,与Cr3+形成配位键的原子是
(3)H2O的稳定性
(4)元素铁和锰的逐级电离能如图所示,

元素X是
(5)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ和π键个数比为
(6)Fe3+可用SCN-检验,类卤素(SCN)2对应的酸有两种,分别为硫氰酸(H—S—C
 N))和异硫氰酸(H—N=C=S),这两种酸中沸点较高的是
N))和异硫氰酸(H—N=C=S),这两种酸中沸点较高的是
您最近一年使用:0次
解题方法
10 . 铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__ 。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__ 。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__ 。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__ 。(已知CO32-的结构式为 )
)
③NaNT可以 (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__ ,1mol 中含有σ键的物质的量为
中含有σ键的物质的量为__ 。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__ 。
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___ 。晶胞中离1个Mn原子最近的Ni原子有__ 个。

(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__ (列出计算表达式,NA表示阿伏加 德罗常数的数值)g•cm-3。

(1)基态Fe2+的核外电子排布式为
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是
 )
)③NaNT可以
 (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为 中含有σ键的物质的量为
中含有σ键的物质的量为④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为

(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为

您最近一年使用:0次



