名校
解题方法
1 . 氨是重要的化工原料,用途广泛。
(1)合成氨工厂常用醋酸二氨合铜(由 和
和 构成)溶液吸收对氨合成催化剂有毒害的CO气体。
构成)溶液吸收对氨合成催化剂有毒害的CO气体。
①醋酸二氨合铜所含的元素中,第一电离能最大的是________ 。(填元素符号)
②醋酸二氨合铜所含元素的单质,所属的晶体类型有________ (填序号)。
a.离子晶体 b.分子晶体 c.共价晶体 d.金属晶体
③第4周期中,基态原子与基态Cu原子未成对电子数目相同的元素有________ 种(不含Cu)。
④铜单质为面心立方晶体,其晶胞边长anm。列式表示铜单质的密度________  。
。
(2) 气体与
气体与 相遇立即生成一种白色晶体:
相遇立即生成一种白色晶体: 。
。
①晶体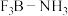 中,B原子的杂化轨道类型为
中,B原子的杂化轨道类型为________ 。
②写出一种与 具有相同空间构型的分子
具有相同空间构型的分子________ 。
(1)合成氨工厂常用醋酸二氨合铜(由
 和
和 构成)溶液吸收对氨合成催化剂有毒害的CO气体。
构成)溶液吸收对氨合成催化剂有毒害的CO气体。①醋酸二氨合铜所含的元素中,第一电离能最大的是
②醋酸二氨合铜所含元素的单质,所属的晶体类型有
a.离子晶体 b.分子晶体 c.共价晶体 d.金属晶体
③第4周期中,基态原子与基态Cu原子未成对电子数目相同的元素有
④铜单质为面心立方晶体,其晶胞边长anm。列式表示铜单质的密度
 。
。(2)
 气体与
气体与 相遇立即生成一种白色晶体:
相遇立即生成一种白色晶体: 。
。①晶体
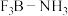 中,B原子的杂化轨道类型为
中,B原子的杂化轨道类型为②写出一种与
 具有相同空间构型的分子
具有相同空间构型的分子
您最近一年使用:0次
名校
解题方法
2 . 离子液体被认为是21世纪最有希望的绿色溶液和功能材料之一,在诸多领域的用途已被研究开发。有几种离子液体由原子序数依次增大的短周期主族元素X、Y、Z、W、R、Q组成。请回答:
(1)基态Z原子的价电子排布式为________ ,基态Y原子占据最高能级的电子云轮廓图为________ 形。
(2)下列说法正确的是____。
(3)试解释 分子中X-W-X键角比
分子中X-W-X键角比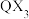 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因________ 。
(4)化合物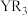 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。
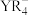 中Y原子的杂化方式为
中Y原子的杂化方式为________ , 晶体中含有
晶体中含有________  氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因________ 。 ,该晶体密度表达式为
,该晶体密度表达式为________  (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
| 元素 | 元素性质或原子结构 |
| X | 电子只有一种自旋取向 |
| Y | 2p能级上有1个电子 |
| Z | 有6个不同运动状态的电子 |
| W | 2p轨道处于半充满状态,简单氢化物易液化,可用作制冷剂 |
| R | 仅有一个未成对电子,简单阴离子含10个电子 |
| Q | 与W位于同一主族 |
(1)基态Z原子的价电子排布式为
(2)下列说法正确的是____。
| A.氢化物的沸点:R>Z | B.分子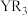 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.元素的电负性:R>X>Z | D.最高价含氧酸的酸性:W>Q |
(3)试解释
 分子中X-W-X键角比
分子中X-W-X键角比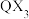 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因(4)化合物
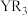 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。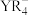 中Y原子的杂化方式为
中Y原子的杂化方式为 晶体中含有
晶体中含有 氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因 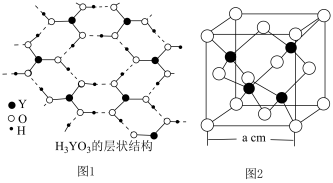
 ,该晶体密度表达式为
,该晶体密度表达式为 (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
您最近一年使用:0次
名校
3 . 锑白( ,性质类似
,性质类似 )可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是
)可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是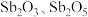 ,含有CuO、
,含有CuO、 和
和 等杂质)中制取
等杂质)中制取 的工业流程如下图所示:
的工业流程如下图所示:
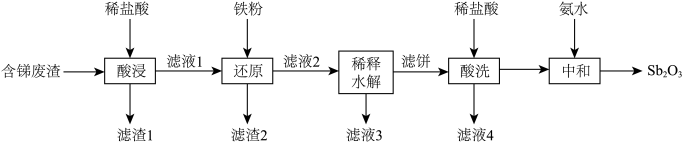
回答下列问题:
(1)锑元素原子序数为51,基态锑原子的价电子轨道表示式为___________ 。
(2)“还原”加入过量铁粉的目的是___________ (填序号)。
a.将 转化为
转化为 b.将
b.将 转化为
转化为 c.将铜离子转化为铜单质
c.将铜离子转化为铜单质
(3)“滤饼”的成分是SbOCl,“稀释水解”主要反应的离子方程式为___________ ;该操作中需要搅拌的原因是___________ 。
(4)“酸洗”后检验沉淀是否洗净的试剂是___________ (填名称)。
(5)“中和”时生成 的化学方程式为
的化学方程式为___________ ,“中和”时不宜将氨水换成氢氧化钠溶液,原因是___________ 。
(6)我国锑的蕴藏量占世界第一位,而锑的化合物也用途广泛。
氟锑酸化学式为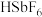 ,酸性比纯硫酸强
,酸性比纯硫酸强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成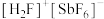 ,则其阳离子的空间结构为
,则其阳离子的空间结构为___________ ,阴离子中心原子的杂化方式合理的是___________ 。
a. b.
b. c.
c. d.
d.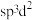
 ,性质类似
,性质类似 )可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是
)可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是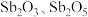 ,含有CuO、
,含有CuO、 和
和 等杂质)中制取
等杂质)中制取 的工业流程如下图所示:
的工业流程如下图所示:
回答下列问题:
(1)锑元素原子序数为51,基态锑原子的价电子轨道表示式为
(2)“还原”加入过量铁粉的目的是
a.将
 转化为
转化为 b.将
b.将 转化为
转化为 c.将铜离子转化为铜单质
c.将铜离子转化为铜单质(3)“滤饼”的成分是SbOCl,“稀释水解”主要反应的离子方程式为
(4)“酸洗”后检验沉淀是否洗净的试剂是
(5)“中和”时生成
 的化学方程式为
的化学方程式为(6)我国锑的蕴藏量占世界第一位,而锑的化合物也用途广泛。
氟锑酸化学式为
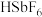 ,酸性比纯硫酸强
,酸性比纯硫酸强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成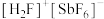 ,则其阳离子的空间结构为
,则其阳离子的空间结构为a.
 b.
b. c.
c. d.
d.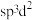
您最近一年使用:0次
名校
解题方法
4 . 明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载。锌及其化合物在生产、生活中有着重要的用途。锌是生命体必需的微量元素,被称为“生命之花”。
(1)基态Zn原子核外电子共有____ 种空间运动状态。
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是____ (填字母)。
(3)锌在潮湿的空气中极易生成一层紧密的碱式碳酸锌[ZnCO3·3Zn(OH)2]薄膜,使其具有抗腐蚀性。其中CO 的空间构型为
的空间构型为____ (用文字描述)。与CO 互为等电子体的分子是
互为等电子体的分子是____ (写一种即可)。
(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为____ ,其中C原子的杂化方式为____ 。
②1mol葡萄糖酸分子中含有____ molσ键。葡萄糖酸的熔点小于葡萄糖酸锌的熔点原因是____ 。
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的____ 空隙中;
②六方ZnS的晶体密度为____ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)基态Zn原子核外电子共有
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是
| A.④②①③ | B.④②③① | C.①②④③ | D.①④③② |
 的空间构型为
的空间构型为 互为等电子体的分子是
互为等电子体的分子是(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为
②1mol葡萄糖酸分子中含有
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的
②六方ZnS的晶体密度为
您最近一年使用:0次
2022-05-24更新
|
547次组卷
|
2卷引用:广西壮族自治区南宁市第三中学2022届高三一模理综化学试题
名校
解题方法
5 . 硫及其化合物有许多用途,请回答下列问题。
(1)基态硫原子的价电子排布式为_______ ,其电子占据最高能级的电子云轮廓图形状为_______ ;
(2)炼铜原料黄铜矿中铜的主要存在形式是CuFeS2,煅烧黄铜矿生成SO2,SO2中心原子的价层电子对数为_______ ,其VSEPR模型为_______ ,请写出与SO2互为等电子体的一种阴离子_______ 。
(3)方铅矿(主要成分为PbS)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于_______ (填“极性”或“非极性”)分子,其中心原子的杂化方式为_______ 。下列分子的空间构型与H2S相同的有_______ ;
A.H2O B.CO2 C.SO2 D.CH4
(4)常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点最高的是_______ ,原因是_______ 。
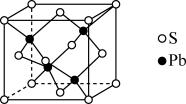
(5)PbS的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的正四面体空隙中。已知晶体密度为 g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为
g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为_______ nm。(已知PbS的摩尔质量为239g/mol)
(1)基态硫原子的价电子排布式为
(2)炼铜原料黄铜矿中铜的主要存在形式是CuFeS2,煅烧黄铜矿生成SO2,SO2中心原子的价层电子对数为
(3)方铅矿(主要成分为PbS)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于
A.H2O B.CO2 C.SO2 D.CH4
(4)常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点最高的是
(5)PbS的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的正四面体空隙中。已知晶体密度为
 g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为
g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为
您最近一年使用:0次
解题方法
6 . 硫及其化合物有许多用途。请回答下列问题。
(1)基态硫原子的价电子排布式为___________ ,其电子占据最高能级的电子云轮廓图形状为___________
(2)常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为___________ ,原因是___________ 。
(3)炼铜原料黄铜矿中铜的主要存在形式是CuFeS2,煅烧黄铜矿生成SO2,CuFeS2中存在的化学键类型是___________ ,SO2中心原子的价层电子对数为___________ 。
(4)方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于___________ (填“极性”或“非极性”)分子,其中心原子的杂化方式为___________ 。下列分子的空间构型与H2S相同的有___________
A. H2O B. CO2 C. SO2 D. CH4
(5)方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的___________ 空隙中。已知晶体密度为 g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为
g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为___________ nm

(1)基态硫原子的价电子排布式为
(2)常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为
(3)炼铜原料黄铜矿中铜的主要存在形式是CuFeS2,煅烧黄铜矿生成SO2,CuFeS2中存在的化学键类型是
(4)方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于
A. H2O B. CO2 C. SO2 D. CH4
(5)方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的
 g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为
g•cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为
您最近一年使用:0次
解题方法
7 . 氮及其化合物在工、农业生产中用途广泛。
(1)基态氮原子的核外电子排布式为__________ ;与N同周期的主族元素中,电负性大于N的有_______ 种。
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与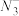 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:____________ ,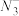 的空间构型为
的空间构型为_________ 。
(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为_______________ 。该氮化硼晶体具有良好的润滑性,其原因是___________________ 。

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为_____________ ;已知晶体的密度为d g·cm-3,NA为阿伏加 德罗常数的值,则晶胞边长为__________ pm(用含d、NA的代数式表示)。
(1)基态氮原子的核外电子排布式为
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与
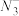 互为等电子体的分子的化学式:
互为等电子体的分子的化学式: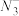 的空间构型为
的空间构型为(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为
您最近一年使用:0次
2020-09-25更新
|
421次组卷
|
3卷引用:广西壮族自治区玉林市2021届高三上学期11月教学质量监测理科综合化学试题
广西壮族自治区玉林市2021届高三上学期11月教学质量监测理科综合化学试题云南、四川、贵州、西藏四省名校2021届高三第一次大联考化学试题(已下线)第32讲 晶体结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
解题方法
8 . 钴元素的用途广泛,据古文献记载:宜德时期青花瓷使用的颜料“苏勃泥青"是从一种进口钴毒矿[主要成分:(FeCo)xAsS]中提取出来的。
(1)Co的价电子排布式为_______
(2)无水CoCl2的熔点是735°C ,沸点1049°C ,CoCl2属于_______ 晶体;砷酸(H3AsO4)分子中As原子的杂化方式为_______ 杂化;砷酸根离子的空间构型为_______ ;第一电离能I1(As)_______ I1(Se)(填“大于”或“小于")。
(3)[Co(NH3)4(H2O)2]Cl3是一种特殊的配合物,其中心离子的配位数是_______ ,每个[Co(NH3)4(H2O)2]3+所含共价键的数目是_______ ,配体NH3的熔沸点大于同族元素氢化物AsH3的原因是_______ 。
(4)钴氰化钾K3[Co(CN)6]是一种浅黄色单斜棱晶体,与配体CN-原子总数相等的等电子体是_______ 。
(5)金属钴晶体的晶胞结构如图所示,其中正六边形的面积为apm2,棱长为bpm;每个Co距离最近且相等的Co原子数目为_______ ; 设阿伏加德罗常数的值为NA,则该晶体的密度为_______ (用含a、b、NA的代数式表示) g·cm-3。

(1)Co的价电子排布式为
(2)无水CoCl2的熔点是735°C ,沸点1049°C ,CoCl2属于
(3)[Co(NH3)4(H2O)2]Cl3是一种特殊的配合物,其中心离子的配位数是
(4)钴氰化钾K3[Co(CN)6]是一种浅黄色单斜棱晶体,与配体CN-原子总数相等的等电子体是
(5)金属钴晶体的晶胞结构如图所示,其中正六边形的面积为apm2,棱长为bpm;每个Co距离最近且相等的Co原子数目为

您最近一年使用:0次
解题方法
9 . 含铬化合物及铬合金用途非常广泛。回答下列问题:
⑴基态Cr原子价电子排布式为___ ;第三电离能I3(Cr)=2987kJ·mol-1,I3(Mn)=3248kJ·mol-1,I3(Cr)<I3(Mn),其原因是___ 。
⑵Cr-Ni-Si是具有八边形相的准晶体,准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___ 法区分晶体、准晶体和非晶体。
⑶已知反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+6NO2↑+16K2SO4+55H2O。
①根据价层电子对互斥理论,SO2、CO2、H2O的气态分子中,中心原子价层电子对数目依次为___ 、___ 、___ 。
②写出一种与SCN-互为等电子体的分子:___ (填化学式)。
③KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为___ ,两个配体NH3、SCN-中,中心原子杂化类型依次为___ 、___ 。
⑷一种具有萤石结构的CrO2的晶胞结构如图所示,晶胞参数为apm。则两个氧原子间的距离为___ pm,Cr-O键的键长为___ pm;设NA为阿伏加 德罗常数的值,则CrO2的密度为___ g·cm-3(列出计算式)。

⑴基态Cr原子价电子排布式为
⑵Cr-Ni-Si是具有八边形相的准晶体,准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
⑶已知反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+6NO2↑+16K2SO4+55H2O。
①根据价层电子对互斥理论,SO2、CO2、H2O的气态分子中,中心原子价层电子对数目依次为
②写出一种与SCN-互为等电子体的分子:
③KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为
⑷一种具有萤石结构的CrO2的晶胞结构如图所示,晶胞参数为apm。则两个氧原子间的距离为

您最近一年使用:0次
名校
解题方法
10 . 氮气、羟基乙胺(HOCH2CH2NH2)和氮化镓都含氮元素,其用途非常广泛。回答下列问题:
(1)基态氮原子价层电子排布图为___ ,其中电子能量最高的能级是___ 。
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为___ ,其中C和N的杂化方式均为___ HOCH2CH2NH2中∠HOC小于∠HNC,其原因是___ 。
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中___ 区,该环状配离子的配位原子为___ 。
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的___ (选填:八面体空隙、正四面体空隙、立方体空隙或三角形空隙);已知该晶胞底边边长为apm,高为cpm,阿伏加 德罗常数的值为NA,则该晶体的密度为___ g•cm-3(列出计算式即可)。

(1)基态氮原子价层电子排布图为
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的

您最近一年使用:0次
2020-06-05更新
|
412次组卷
|
4卷引用:广西南宁市2020届高三第二次适应性测试理科综合化学试题
广西南宁市2020届高三第二次适应性测试理科综合化学试题甘肃省兰州市第一中学2020届高三冲刺模拟考试(二)理科综合化学试题新疆喀什莎车县第一中学2020-2021学年高三下学期第一次月考化学试题(已下线)第32讲 晶体结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)



