名校
1 . 随着科学的发展,氟及其化合物的用途日益广泛。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。 是制备此离子液体的原料。
是制备此离子液体的原料。
(1)微粒中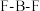 键角:
键角:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 可以与
可以与 反应生成
反应生成 的原因是
的原因是___________ 。
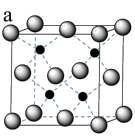
Ⅱ.氟化镁钾( )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。 晶体中,每个
晶体中,每个 周围有
周围有___________ 个距离最近的F。
(4) 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态 价电子的轨道表示式为
价电子的轨道表示式为___________ 。
②某实验室合成新型催化剂材料 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为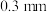 、面积为
、面积为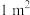 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为___________  (
(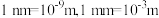 ,阿伏加德罗常数约为
,阿伏加德罗常数约为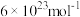 )。
)。
(5)我国科研工作者以 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
的结构简式如下: 中N原子的杂化方式为
中N原子的杂化方式为___________ , 中心N原子的杂化方式为
中心N原子的杂化方式为___________ 。
② 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着___________ ,上述相互作用不会随 的转动改变。
的转动改变。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。
 是制备此离子液体的原料。
是制备此离子液体的原料。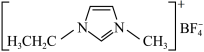
(1)微粒中
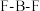 键角:
键角:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 可以与
可以与 反应生成
反应生成 的原因是
的原因是Ⅱ.氟化镁钾(
 )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。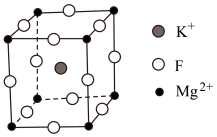
 晶体中,每个
晶体中,每个 周围有
周围有(4)
 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。①基态
 价电子的轨道表示式为
价电子的轨道表示式为②某实验室合成新型催化剂材料
 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为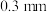 、面积为
、面积为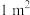 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为 (
(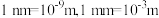 ,阿伏加德罗常数约为
,阿伏加德罗常数约为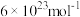 )。
)。(5)我国科研工作者以
 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
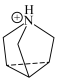
的结构简式如下: :
:
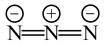
 :
:
 中N原子的杂化方式为
中N原子的杂化方式为 中心N原子的杂化方式为
中心N原子的杂化方式为②
 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着 的转动改变。
的转动改变。
您最近一年使用:0次
名校
解题方法
2 . 铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)①铁元素在周期表中的位置是___________ ,铜的基态原子核外电子排布式为___________ 。
②元素铁与铜的第二电离能分别为: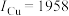 kJ⋅mol
kJ⋅mol 、
、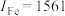 kJ⋅mol
kJ⋅mol ,
,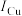 比
比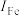 大的原因是
大的原因是___________ 。
(2) 的合成及应用一直是科学研究的重要课题,以
的合成及应用一直是科学研究的重要课题,以 、
、 合成
合成 ,活性铁是常用的催化剂,铁的两种晶胞(所示图形为正方体)结构示意如图:
,活性铁是常用的催化剂,铁的两种晶胞(所示图形为正方体)结构示意如图:
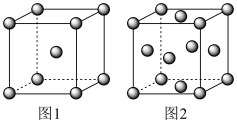
①两种晶胞所含铁原子个数比为___________ 。
②图1晶胞的棱长为a pm(1pm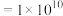 cm),则其密度
cm),则其密度
___________ g·cm (用含
(用含 的代数式表示)。
的代数式表示)。
(3)二茂铁 ,橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为
,橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为___________ 。
(4)蓝矾( )的结构如下图所示:
)的结构如下图所示:
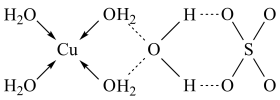
图中虚线表示___________ , 的空间结构是
的空间结构是___________ ,其中S原子的杂化轨道类型是___________ ;O原子的价电子轨道表示式为___________ 。
(5)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为___________ 。

(6)某种具有储氢功能的铜合金晶体具有立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是___________ 。

氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待:该晶体储氢后的晶胞结构与 的结构(晶胞结构如图)相似,该晶体储氢后的化学式为
的结构(晶胞结构如图)相似,该晶体储氢后的化学式为___________ 。
(1)①铁元素在周期表中的位置是
②元素铁与铜的第二电离能分别为:
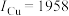 kJ⋅mol
kJ⋅mol 、
、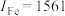 kJ⋅mol
kJ⋅mol ,
,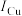 比
比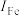 大的原因是
大的原因是(2)
 的合成及应用一直是科学研究的重要课题,以
的合成及应用一直是科学研究的重要课题,以 、
、 合成
合成 ,活性铁是常用的催化剂,铁的两种晶胞(所示图形为正方体)结构示意如图:
,活性铁是常用的催化剂,铁的两种晶胞(所示图形为正方体)结构示意如图:
①两种晶胞所含铁原子个数比为
②图1晶胞的棱长为a pm(1pm
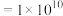 cm),则其密度
cm),则其密度
 (用含
(用含 的代数式表示)。
的代数式表示)。(3)二茂铁
 ,橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为
,橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为(4)蓝矾(
 )的结构如下图所示:
)的结构如下图所示:
图中虚线表示
 的空间结构是
的空间结构是(5)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为

(6)某种具有储氢功能的铜合金晶体具有立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是

氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待:该晶体储氢后的晶胞结构与
 的结构(晶胞结构如图)相似,该晶体储氢后的化学式为
的结构(晶胞结构如图)相似,该晶体储氢后的化学式为
您最近一年使用:0次
名校
3 . 随着科学的发展,氟及其化合物的用途日益广泛。
Ⅰ、离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。
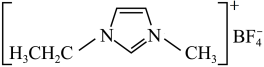
1−乙基−3−甲基咪唑四氟硼酸盐(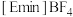 )
)
(1)写出基态铜原子的价电子排布式___________ 。
(2) 是制备此离子液体的原料。
是制备此离子液体的原料。
①微粒中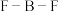 键角:
键角:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 可以与
可以与 反应生成
反应生成 的原因是
的原因是___________ 。
(3)以 和
和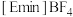 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为___________ ,电解质溶液中 向
向___________ 极移动(填“阴”或“阳”)。
Ⅱ、 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个。
(5) 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
Ⅰ、离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。

1−乙基−3−甲基咪唑四氟硼酸盐(
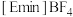 )
)(1)写出基态铜原子的价电子排布式
(2)
 是制备此离子液体的原料。
是制备此离子液体的原料。①微粒中
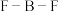 键角:
键角:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 可以与
可以与 反应生成
反应生成 的原因是
的原因是(3)以
 和
和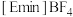 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为 向
向Ⅱ、
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有(5)
 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)
您最近一年使用:0次
2023-04-29更新
|
441次组卷
|
4卷引用:北京市丰台区2023届高三下学期二模考试化学试题
北京市丰台区2023届高三下学期二模考试化学试题北京师范大学第二附属中学2023-2024学年高三上学期10月月考化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
解题方法
4 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)铜副族位于周期表_______ 区,基态Cu原子的价电子排布式为 _______ 。
(2)向 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为_______ 。继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式_______ 。 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
(3) 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ , 中三种元素电负性由大到小排序为
中三种元素电负性由大到小排序为_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知 ,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.键性因素 c.电荷因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,如下图所示,该晶体储氢后的化学式为_______ 。

(1)铜副族位于周期表
(2)向
 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为 的空间构型为
的空间构型为(3)
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是 中三种元素电负性由大到小排序为
中三种元素电负性由大到小排序为(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知 ,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为a.几何因素 b.键性因素 c.电荷因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,如下图所示,该晶体储氢后的化学式为

您最近一年使用:0次
5 . 金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
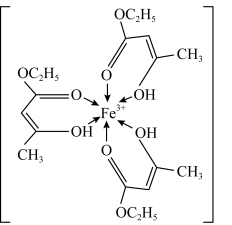
①基态铁离子的核外电子填充在___________ 个原子轨道中;
②此配离子中碳原子的杂化轨道类型为___________ ;
③此配离子中含有的化学键类型为___________ 。
A.离子键 B.金属键 C.共价键 D.配位键 E.σ键 F.π键
(2) 与钴盐形成的配离子
与钴盐形成的配离子 可用于检验
可用于检验 的存在。
的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为___________ 。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物 和
和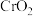 ,其中适合作录音带磁粉原料的是
,其中适合作录音带磁粉原料的是___________ 。
(4)锰的一种配合物的化学式为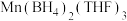 。已知:原子个数和价电子总数分别对应相等的分子、离子或基团称为等电子体。请写出两种与
。已知:原子个数和价电子总数分别对应相等的分子、离子或基团称为等电子体。请写出两种与 互为等电子体的微粒
互为等电子体的微粒___________ (请写出一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为___________ ,已知晶胞密度为ρg/cm ,用
,用 表示阿伏加德罗常数的值,则晶胞的边长为
表示阿伏加德罗常数的值,则晶胞的边长为___________ cm(列计算式)。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

①基态铁离子的核外电子填充在
②此配离子中碳原子的杂化轨道类型为
③此配离子中含有的化学键类型为
A.离子键 B.金属键 C.共价键 D.配位键 E.σ键 F.π键
(2)
 与钴盐形成的配离子
与钴盐形成的配离子 可用于检验
可用于检验 的存在。
的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物
 和
和 ,其中适合作录音带磁粉原料的是
,其中适合作录音带磁粉原料的是(4)锰的一种配合物的化学式为
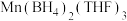 。已知:原子个数和价电子总数分别对应相等的分子、离子或基团称为等电子体。请写出两种与
。已知:原子个数和价电子总数分别对应相等的分子、离子或基团称为等电子体。请写出两种与 互为等电子体的微粒
互为等电子体的微粒(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为
 ,用
,用 表示阿伏加德罗常数的值,则晶胞的边长为
表示阿伏加德罗常数的值,则晶胞的边长为
您最近一年使用:0次
6 . 镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为_______ 。
(2)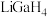 是一种温和的还原剂,其可由
是一种温和的还原剂,其可由 和过量的LiH反应制得:
和过量的LiH反应制得: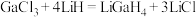 。
。
①已知 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为_______ 。
② 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:_______ 。
③ 的立体构型为
的立体构型为_______ 。
(3)一种含镓的药物合成方法如图所示:_______ ,1 mol化合物I中含有的 键的物质的量为
键的物质的量为_______ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_______ (用元素符号表示)。
②化合物Ⅱ中Ga的配位数为_______ ,x=_______ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:_______ (填选项字母)。 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为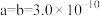 m,
m,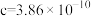 m,则其密度为
m,则其密度为_______  (列出计算式即可)。
(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)
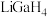 是一种温和的还原剂,其可由
是一种温和的还原剂,其可由 和过量的LiH反应制得:
和过量的LiH反应制得: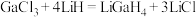 。
。①已知
 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为②
 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:③
 的立体构型为
的立体构型为(3)一种含镓的药物合成方法如图所示:

 键的物质的量为
键的物质的量为②化合物Ⅱ中Ga的配位数为
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

A. B.
B.  C.
C. 
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为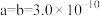 m,
m,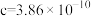 m,则其密度为
m,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2023-02-27更新
|
957次组卷
|
5卷引用:结构与性质
(已下线)结构与性质广东省广州市等3地东莞市东华松山湖高级中学有限公司等2校2023届高三下学期一模化学试题(已下线)2022年重庆高考真题化学试题变式题(结构与性质)(已下线)专题20 结构与性质陕西省商洛市2023-2024学年高三下学期第四次模拟考试理综试题-高中化学
解题方法
7 . 砷化铟(InAs)是一种优良的半导体化合物,有广泛用途。
(1)基态In的价层电子排布式为5s25p1,In在周期表中的位置是____ 。
(2)在Ar保护下分别将InCl3和AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的InAs晶体。
已知:AsCl3和InCl3均为分子晶体,AsCl3气化室的温度为130℃,InCl3气化室的温度为500℃。
①AsCl3分子的空间结构为____ ,中心原子As的杂化轨道类型为____ 。
②AsCl3气化室温度低于InCl3气化室温度的原因是____ 。
③InCl3晶体中分子间存在配位键,配位原子是____ 。
(3)InAs为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如图所示。

①一个晶胞中所含As的个数为____ 。
②已知该晶胞棱长为apm(1pm=1×10-10cm),阿伏加德罗常数为NA,InAs的摩尔质量为Mg•mol-1,则该晶体的密度ρ=____ g•cm-3。
(1)基态In的价层电子排布式为5s25p1,In在周期表中的位置是
(2)在Ar保护下分别将InCl3和AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的InAs晶体。
已知:AsCl3和InCl3均为分子晶体,AsCl3气化室的温度为130℃,InCl3气化室的温度为500℃。
①AsCl3分子的空间结构为
②AsCl3气化室温度低于InCl3气化室温度的原因是
③InCl3晶体中分子间存在配位键,配位原子是
(3)InAs为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如图所示。

①一个晶胞中所含As的个数为
②已知该晶胞棱长为apm(1pm=1×10-10cm),阿伏加德罗常数为NA,InAs的摩尔质量为Mg•mol-1,则该晶体的密度ρ=
您最近一年使用:0次
名校
解题方法
8 . 钒(V)是一种重要的金属,有金属“维生素”之称,用途涵盖了航空航天、电池、光学、医药等众多领域,主要由五氧化二钒冶炼得到。某种由钒精矿(含 V2O5及少量 MgO、SiO2 等杂质)提取五氧化二钒的工艺流程如下图所示。

[资料]+5 价钒在溶液中的主要存在形式与溶液 pH 的关系:
(1)钒精矿磨细的目的是_______ ,浸出液中含有钒酸钠(Na3VO4)。VO 与 PO
与 PO 的空间构型相同,均为
的空间构型相同,均为_______ 构型。
(2)用硫酸缓慢调节浸出液的 pH 为 7,得到净化液中主要的阴离子是_______ 。
(3)净化液中加入氯化铵溶液进行氨化沉钒,过滤得到的固体经煅烧后得到V2O5,煅烧过程中发生反应的化学方程式是_______ 。
(4)五氧化二钒的结构简式如图所示,该结构中 σ 键与 π 键个数之比是_______ 。

(5)钒在周期表中的位置是_______ ,单质钒的晶胞结构如图所示,若晶胞的棱长为 anm,密度为 ρ g•cm-3,钒的相对原子质量为_______ 。(设阿伏加德罗常数的值为 NA)


[资料]+5 价钒在溶液中的主要存在形式与溶液 pH 的关系:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | V2O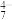 | VO |
 与 PO
与 PO 的空间构型相同,均为
的空间构型相同,均为(2)用硫酸缓慢调节浸出液的 pH 为 7,得到净化液中主要的阴离子是
(3)净化液中加入氯化铵溶液进行氨化沉钒,过滤得到的固体经煅烧后得到V2O5,煅烧过程中发生反应的化学方程式是
(4)五氧化二钒的结构简式如图所示,该结构中 σ 键与 π 键个数之比是

(5)钒在周期表中的位置是

您最近一年使用:0次
2022-06-11更新
|
367次组卷
|
3卷引用:北京市顺义区杨镇第一中学2022-2023学年高三第零次模拟考试化学试题
名校
解题方法
9 . 碳族中的碳、硅、锗及其化合物在多领域有重要用途。
(1)基态 的电子排布式为
的电子排布式为___________ 。
(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。 分子中存在
分子中存在___________ 个 键和
键和___________ 个 键,
键, 分子是
分子是___________ 分子(填“极性”或“非极性”)。
(3)关于 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述不正确 的是___________。
(4) 与
与 -甲基咪唑(
-甲基咪唑(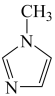 )反应可以得到
)反应可以得到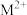 ,其结构如下图所示:
,其结构如下图所示:

 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有___________ 。
(5)汞( )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
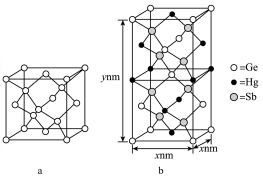
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为___________  (列出计算式)。注:
(列出计算式)。注:
(1)基态
 的电子排布式为
的电子排布式为(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
 分子中存在
分子中存在 键和
键和 键,
键, 分子是
分子是(3)关于
 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述A.键能 、 、 ,因此 ,因此 稳定性小于 稳定性小于 |
B. 是与金刚石结构相似的共价晶体,因此 是与金刚石结构相似的共价晶体,因此 具有较高的硬度 具有较高的硬度 |
C. 中 中 的化合价为 的化合价为 , , 中 中 的化合价为 的化合价为 ,因此 ,因此 还原性小于 还原性小于 |
D. 原子间难形成双键和三键而 原子间难形成双键和三键而 原子间可以,是因为 原子间可以,是因为 的原子半径大于 的原子半径大于 ,因此难以形成 ,因此难以形成 键 键 |
 与
与 -甲基咪唑(
-甲基咪唑( )反应可以得到
)反应可以得到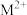 ,其结构如下图所示:
,其结构如下图所示:
 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有(5)汞(
 )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。注:
(列出计算式)。注:
您最近一年使用:0次
10 . 硼及其化合物在新材料、工农业生产等方面用途广泛。
(1)氮化硼存在不同的变体,如六方氮化硼、立方氮化硼等,其结构如图。

①六方氮化硼的晶体结构类似石墨,则六方氮化硼的晶体类型属于_______ 。
②高温高压下,六方氮化硼可转化为立方氮化硼,立方氮化硼的结构与金刚石类似,每个立方氮化硼晶胞中硼原子和氮原子的个数比为_______ 。
(2)氨硼烷( )是极具潜力的高性能储氢材料,其晶体结构之一如图。(已知电负性:H 2.1,B 2.0,N 3.0)
)是极具潜力的高性能储氢材料,其晶体结构之一如图。(已知电负性:H 2.1,B 2.0,N 3.0)

①氨硼烷分子为_______ (填“极性”或“非极性”)分子。
②氨硼烷分子中,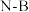 键为配位键,由原子的价层电子排布特点分析该配位键的形成过程:
键为配位键,由原子的价层电子排布特点分析该配位键的形成过程:_______ 。
③氨硼烷常温下为固态,它的熔点比乙烷的熔点高近300℃,是由于其分子间除了分子间作用力,还存在正电性H和负电性H的相互作用,这种作用称为“双氢键”。仿照氢键的表示方法:“ ”,上述双氢键可表示为
”,上述双氢键可表示为_______ (式中用“ ”及“
”及“ ”表示氢的带电情况)。
”表示氢的带电情况)。
④氨硼烷常温下稳定,加热到90℃左右分解产生 ,若该反应中只有氢元素的化合价发生变化,则每产生
,若该反应中只有氢元素的化合价发生变化,则每产生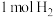 ,反应转移的电子的物质的量是
,反应转移的电子的物质的量是_______  。
。
⑤由氨硼:烷的组成或性质分析,氨硼烷作为储氢材料的优势有_______ 。
(1)氮化硼存在不同的变体,如六方氮化硼、立方氮化硼等,其结构如图。

①六方氮化硼的晶体结构类似石墨,则六方氮化硼的晶体类型属于
②高温高压下,六方氮化硼可转化为立方氮化硼,立方氮化硼的结构与金刚石类似,每个立方氮化硼晶胞中硼原子和氮原子的个数比为
(2)氨硼烷(
 )是极具潜力的高性能储氢材料,其晶体结构之一如图。(已知电负性:H 2.1,B 2.0,N 3.0)
)是极具潜力的高性能储氢材料,其晶体结构之一如图。(已知电负性:H 2.1,B 2.0,N 3.0)
①氨硼烷分子为
②氨硼烷分子中,
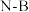 键为配位键,由原子的价层电子排布特点分析该配位键的形成过程:
键为配位键,由原子的价层电子排布特点分析该配位键的形成过程:③氨硼烷常温下为固态,它的熔点比乙烷的熔点高近300℃,是由于其分子间除了分子间作用力,还存在正电性H和负电性H的相互作用,这种作用称为“双氢键”。仿照氢键的表示方法:“
 ”,上述双氢键可表示为
”,上述双氢键可表示为 ”及“
”及“ ”表示氢的带电情况)。
”表示氢的带电情况)。④氨硼烷常温下稳定,加热到90℃左右分解产生
 ,若该反应中只有氢元素的化合价发生变化,则每产生
,若该反应中只有氢元素的化合价发生变化,则每产生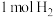 ,反应转移的电子的物质的量是
,反应转移的电子的物质的量是 。
。⑤由氨硼:烷的组成或性质分析,氨硼烷作为储氢材料的优势有
您最近一年使用:0次
2021-07-12更新
|
283次组卷
|
2卷引用:北京市东城区2020-2021学年高二下学期期末考试化学试题



