名校
解题方法
1 . 氮元素及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态氮原子的核外共有_________ 种不同运动状态的电子,氮元素的第一电离能在同周期中从大到小排第_________ 位。
(2)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH3的键角大的原因:______________
(3)乙二胺(H2N—CH2—CH2—NH2)分子中氮原子轨道的杂化类型为_________ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是___________ 。
(1)基态氮原子的核外共有
(2)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH3的键角大的原因:
(3)乙二胺(H2N—CH2—CH2—NH2)分子中氮原子轨道的杂化类型为
您最近一年使用:0次
名校
2 . 铁及其化合物在国民生产、生活中用途广泛。
(1)向 溶液中加入少量的KSCN溶液,生成红色的
溶液中加入少量的KSCN溶液,生成红色的 。N、C、O元素的第一电离能由大到小的顺序为
。N、C、O元素的第一电离能由大到小的顺序为_______ ,O、N、C、H四种元素电负性最大的是_______ (填元素符号)。
(2) 与
与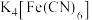 溶液混合生成
溶液混合生成 沉淀。配体
沉淀。配体 中C原子的杂化方式为
中C原子的杂化方式为_______ ,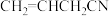 分子中
分子中 键与
键与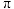 键的数目之比为
键的数目之比为_______ 。
(3)用邻二氮菲(phen,结构为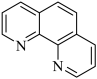 )与琥珀酸亚铁生成稳定的橙色配合物,可测定
)与琥珀酸亚铁生成稳定的橙色配合物,可测定 的浓度,发生反应:
的浓度,发生反应: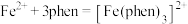 。
。
① 中,存在的化学键有
中,存在的化学键有_______ (填字母)。
a.配位键 b.离子键 c.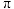 键 d.氢键
键 d.氢键
②用邻二氮菲测定 浓度时应控制pH为2~9的适宜范围,请解释原因:
浓度时应控制pH为2~9的适宜范围,请解释原因:_______ 。
(1)向
 溶液中加入少量的KSCN溶液,生成红色的
溶液中加入少量的KSCN溶液,生成红色的 。N、C、O元素的第一电离能由大到小的顺序为
。N、C、O元素的第一电离能由大到小的顺序为(2)
 与
与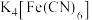 溶液混合生成
溶液混合生成 沉淀。配体
沉淀。配体 中C原子的杂化方式为
中C原子的杂化方式为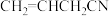 分子中
分子中 键与
键与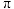 键的数目之比为
键的数目之比为(3)用邻二氮菲(phen,结构为
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定
)与琥珀酸亚铁生成稳定的橙色配合物,可测定 的浓度,发生反应:
的浓度,发生反应: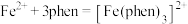 。
。①
 中,存在的化学键有
中,存在的化学键有a.配位键 b.离子键 c.
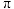 键 d.氢键
键 d.氢键②用邻二氮菲测定
 浓度时应控制pH为2~9的适宜范围,请解释原因:
浓度时应控制pH为2~9的适宜范围,请解释原因:
您最近一年使用:0次
解题方法
3 . 氮是一种典型的非金属元素,其单质及化合物在生活和生产中具有广泛的用途。请回答下列问题:
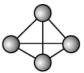
(1)科学家目前合成了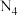 分子,其结构如图所示。
分子,其结构如图所示。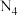 分子中氮原子的杂化轨道类型是
分子中氮原子的杂化轨道类型是_______ ,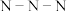 键角为
键角为_______ ;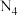 分解后能产生
分解后能产生 并释放出大量能量,推测其用途可为
并释放出大量能量,推测其用途可为_______ 。
(2)①维生素 可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
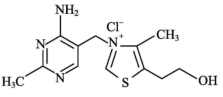
以下关于维生素 的说法正确的是
的说法正确的是_______ 。
a.只含σ键和π键
b.既有共价键又有离子键
c.既含有极性键又含有非极性键
②维生素 燃烧可生成
燃烧可生成 、
、 、
、 、
、 、
、 、
、 等物质,这些物质中属于非极性分子的化合物有
等物质,这些物质中属于非极性分子的化合物有_______ 。
(3)液氨常被用作制冷剂,若不断地升高温度,实现“液氨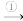 氨气
氨气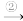 氮气和氢气
氮气和氢气 氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①_______ ;②极性键;③_______ 。
(1)科学家目前合成了
 分子,其结构如图所示。
分子,其结构如图所示。 分子中氮原子的杂化轨道类型是
分子中氮原子的杂化轨道类型是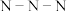 键角为
键角为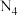 分解后能产生
分解后能产生 并释放出大量能量,推测其用途可为
并释放出大量能量,推测其用途可为
(2)①维生素
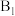 可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
以下关于维生素
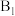 的说法正确的是
的说法正确的是a.只含σ键和π键
b.既有共价键又有离子键
c.既含有极性键又含有非极性键
②维生素
 燃烧可生成
燃烧可生成 、
、 、
、 、
、 、
、 、
、 等物质,这些物质中属于非极性分子的化合物有
等物质,这些物质中属于非极性分子的化合物有(3)液氨常被用作制冷剂,若不断地升高温度,实现“液氨
 氨气
氨气 氮气和氢气
氮气和氢气 氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
您最近一年使用:0次
名校
解题方法
4 . 硫及其化合物有许多用途,相关物质的物理常数如表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____ 。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___ 。
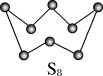
(3)如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____ 。S原子的杂化轨道类型为___ 。
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为___ 形,固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为____ 。

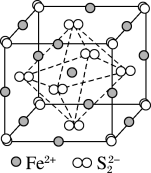
(5)FeS2晶体的晶胞如图所示,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____ g•cm-3;晶胞中Fe2+位于S 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为___ nm。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(3)如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为

(5)FeS2晶体的晶胞如图所示,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为
 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
名校
解题方法
5 . 完成下列问题。
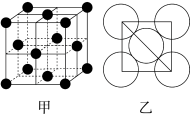
(1)金属铝的晶胞结构如图甲所示,原子之间相互位置关系的平面图如图乙所示。若已知Al的原子半径为rcm,NA代表阿伏加德罗常数的值,该晶体的密度为_______  (用含NA、r的最简式表示)。
(用含NA、r的最简式表示)。
(2)2022年北京冬季奥运会场馆建设使用了大量不锈钢材质,不锈钢属于铁碳合金,常含铬、镍等元素。
①碳的一种单质石墨是单层二维蜂窝状晶格结构的新材料(如图1),其中碳原子采取_______ 杂化,在层中每个碳原子周围等距且紧邻的碳原子个数为_______ 。

②铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图2所示。晶体中每个镁原子周围等距且紧邻的镁原子有_______ 个,该铁镁合金中原子个数比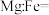
_______ ;原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),C为( ,
, ,0),B点坐标参数为
,0),B点坐标参数为_______ 。

(1)金属铝的晶胞结构如图甲所示,原子之间相互位置关系的平面图如图乙所示。若已知Al的原子半径为rcm,NA代表阿伏加德罗常数的值,该晶体的密度为
 (用含NA、r的最简式表示)。
(用含NA、r的最简式表示)。
(2)2022年北京冬季奥运会场馆建设使用了大量不锈钢材质,不锈钢属于铁碳合金,常含铬、镍等元素。
①碳的一种单质石墨是单层二维蜂窝状晶格结构的新材料(如图1),其中碳原子采取

②铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图2所示。晶体中每个镁原子周围等距且紧邻的镁原子有
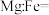
 ,
, ,0),B点坐标参数为
,0),B点坐标参数为
您最近一年使用:0次
解题方法
6 . 卤族元素是重要的非金属元素,用途广泛。回答下列问题:
(1)卤族元素位于元素周期表___________ 区,其中电负性最大的是___________ (填元素符号)。
(2)基态氟原子核外有___________ 种运动状态不同的电子,其中含有单电子的轨道形状为___________ 。
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性___________ (填“强”或“弱”),原因是___________ 。
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I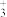 )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。该晶体中不含有的化学键类型为___________ (填选项字母)。
a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为___________ ,晶胞中位置与 K+紧邻的 O 的个数为___________ 。
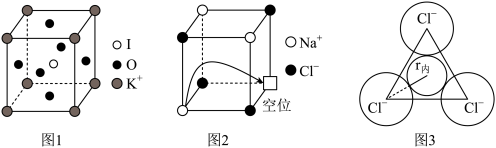
(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确___________ 。(已知: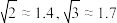 )
)
(1)卤族元素位于元素周期表
(2)基态氟原子核外有
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I
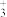 )中心原子的杂化方式为
)中心原子的杂化方式为a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为

(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确
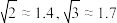 )
)
您最近一年使用:0次
名校
解题方法
7 . 碳(C)、铜(Cu)、锡(Sn)及其化合物有许多用途。回答下列问题。
(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为_______ 。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,P、S的第二电离能(I2)的大小关系为I2(P)___ I2(S)(填“>”、“<”或“=”),原因是_ 。PH3分子的热稳定性比NH3______ (填“强”或“弱”)。
(3)1mol苯中含 键的数目为
键的数目为______ 。CH3CH2COOH中C的杂化方式有______ ;
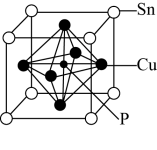
(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为anm,该晶体中P原子位于由铜原子形成的正八面体的空隙中,则该正八面体的边长为__________ nm,该晶体密度为______ g cm-3(用含NA的代数式表示)。
cm-3(用含NA的代数式表示)。

(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,P、S的第二电离能(I2)的大小关系为I2(P)
(3)1mol苯中含
 键的数目为
键的数目为(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为anm,该晶体中P原子位于由铜原子形成的正八面体的空隙中,则该正八面体的边长为
 cm-3(用含NA的代数式表示)。
cm-3(用含NA的代数式表示)。
您最近一年使用:0次
2021-04-14更新
|
210次组卷
|
3卷引用:吉林省白山市抚松县第一中学2021-2022学年高二下学期第二次月考化学试题
名校
解题方法
8 . 由S、Cl及Fe、Co、Ni等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的价电子排布式为____ ,P、S、Cl的第一电离能由大到小顺序为_____ 。
(2)SCl2分子中的中心原子杂化轨道类型是____ ,该分子空间构型为____ 。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_____ 。
(4)已知NiO的晶体结构如图1所示。

①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的_______ 体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO_______ NiO(填“>”、“<"或“=”)
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2,已知O2-的半径为a米,每平方米面积上分散的NiO的质量为_______ g。(用a、NA表示)
(1)钴元素基态原子的价电子排布式为
(2)SCl2分子中的中心原子杂化轨道类型是
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为
(4)已知NiO的晶体结构如图1所示。

①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2,已知O2-的半径为a米,每平方米面积上分散的NiO的质量为
您最近一年使用:0次
解题方法
9 . 人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为___ 。
(2)CuSO4和Cu(NO3)2是自然界中重要的铜盐, 的立体构型是
的立体构型是___ ,S、O、N三种元素的第一电离能由大到小为___ 。
(3)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___ ,反应的离子方程式为___ 。
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有
OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有___ 。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为( ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为___ ,它代表__ 原子。
②若Cu2O晶体密度为dg·cm-3,晶胞参数为apm,则阿伏加德罗常数值NA=___ 。
(1)Cu+的核外电子排布式为
(2)CuSO4和Cu(NO3)2是自然界中重要的铜盐,
 的立体构型是
的立体构型是(3)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO
 OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有
OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(
 ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为②若Cu2O晶体密度为dg·cm-3,晶胞参数为apm,则阿伏加德罗常数值NA=
您最近一年使用:0次
名校
解题方法
10 . 过渡金属钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态Ti原子价层电子排布式为__ 。
②Fe元素在元素周期表中的位置是__ 。
(2)制备CrO2Cl2的反应为K2CrO4+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序为__ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子稳定结构,COCl2分子中π键和σ键的个数比为__ ,中心原子的杂化方式为__ 。
(3)Ni和La的合金是目前广泛使用的储氢材料,具有容量大、寿命高、耐低温等特点,在我国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为__ 。
②已知该晶体的摩尔质量为Mg•mol-1,密度为dg•cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积为__ cm3(用含M、d、NA的代数式表示)。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态Ti原子价层电子排布式为
②Fe元素在元素周期表中的位置是
(2)制备CrO2Cl2的反应为K2CrO4+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序为
②COCl2分子中所有原子均满足8电子稳定结构,COCl2分子中π键和σ键的个数比为
(3)Ni和La的合金是目前广泛使用的储氢材料,具有容量大、寿命高、耐低温等特点,在我国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶体的摩尔质量为Mg•mol-1,密度为dg•cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积为
您最近一年使用:0次



