名校
解题方法
1 . La、Cu、O组成复合氧化物是超导体基体材料,可以做光催化分解水的电极材料,对制备绿色无污染的氢能源意义重大。回答下列问题:
(1)基态Cu原子核外电子排布式为___ 。
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
计算5f能级的值为___ 。
(3)已知铜的某些化合物的熔点:
则CuSe为___ 晶体,CuSe的熔点大于CuS的熔点的原因是___ 。
(4)一种Cu2+的配合离子结构简式为: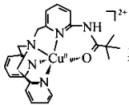 其中,N原子的杂化方式为
其中,N原子的杂化方式为___ ,Cu2+的配位数为___ 。
(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为___ (任写一种)。
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为___ 。
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为___ g·cm-3。
(1)基态Cu原子核外电子排布式为
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
| I | 0 | 1 | 2 | 3 |
| 亚层符号 | s | p | d | f |
计算5f能级的值为
(3)已知铜的某些化合物的熔点:
| CuO | CuS | CuSe | |
| 熔点(℃) | 1326 | 103 | 387 |
则CuSe为
(4)一种Cu2+的配合离子结构简式为:
 其中,N原子的杂化方式为
其中,N原子的杂化方式为(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为
您最近一年使用:0次
2021-09-10更新
|
107次组卷
|
2卷引用:湖南省天壹名校联盟 2022届高三入学摸底考试化学试题
名校
2 . 磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1) 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。

①第一电离能:磷___________ 硫(填“>”或“<”),
② 分子中硫原子的杂化轨道类型为
分子中硫原子的杂化轨道类型为___________ 。
③每个 分子中含孤电子对的数目为
分子中含孤电子对的数目为___________ 。
(2)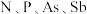 均是第
均是第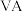 族的元素。
族的元素。
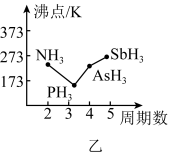
①上述元素的氢化物的沸点关系如图乙所示,沸点: ,其原因是
,其原因是___________
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为___________ 。

(3)磷化铝熔点为2000℃,磷化铝晶胞结构如图丁所示。

①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为___________ 。
②磷化铝晶体的密度为 ,用
,用 表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为
表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为___________ cm。
(1)
 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。
①第一电离能:磷
②
 分子中硫原子的杂化轨道类型为
分子中硫原子的杂化轨道类型为③每个
 分子中含孤电子对的数目为
分子中含孤电子对的数目为(2)
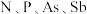 均是第
均是第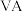 族的元素。
族的元素。①上述元素的氢化物的沸点关系如图乙所示,沸点:
 ,其原因是
,其原因是
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为

(3)磷化铝熔点为2000℃,磷化铝晶胞结构如图丁所示。

①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为
②磷化铝晶体的密度为
 ,用
,用 表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为
表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为
您最近一年使用:0次
3 . 过渡金属元素及其化合物制成的材料有着广泛的用途。
(1)第四电离能I4(Co)<I4(Fe),其原因是____ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4到TiI4熔点依次升高,原因是____ 。
(3)某镍配合物结构如图所示,分子内含有的作用力有____ (填字母)。
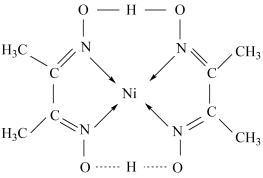
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)甲基呋喃与氨在高温下反应得到甲基吡咯:
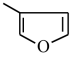 (甲基呋喃)+NH3
(甲基呋喃)+NH3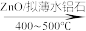
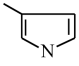 (甲基吡咯)
(甲基吡咯)
1mol甲基呋喃分子中含有σ键为____ mol,甲基吡咯分子中碳原子轨道的杂化方式是___ ;甲基吡咯分子中含有一个平面五元环,则氮原子轨道的杂化方式是____ 。
(1)第四电离能I4(Co)<I4(Fe),其原因是
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4到TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)某镍配合物结构如图所示,分子内含有的作用力有

A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)甲基呋喃与氨在高温下反应得到甲基吡咯:
 (甲基呋喃)+NH3
(甲基呋喃)+NH3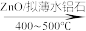
 (甲基吡咯)
(甲基吡咯)1mol甲基呋喃分子中含有σ键为
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被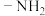 (氨基取代形成的另一种氮的氢化物。
(氨基取代形成的另一种氮的氢化物。
① 分子中中心原子的价层电子对数为
分子中中心原子的价层电子对数为___________ ; 分子中氮原子轨道的杂化类型是
分子中氮原子轨道的杂化类型是___________ 。
②肼可用作火箭燃料,燃烧时发生的反应是

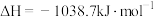
若该反应中有4mol 键断裂,则形成的
键断裂,则形成的 键有
键有___________ mol。
(2)第VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①基态Se原子的价电子轨道表示式为___________ 。
②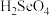 的酸性比
的酸性比
___________ (填“强”或“弱”)。气态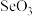 为
为___________ 分子(填“极性”或“非极性”), 的空间结构为
的空间结构为___________ 。
(1)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被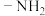 (氨基取代形成的另一种氮的氢化物。
(氨基取代形成的另一种氮的氢化物。①
 分子中中心原子的价层电子对数为
分子中中心原子的价层电子对数为 分子中氮原子轨道的杂化类型是
分子中氮原子轨道的杂化类型是②肼可用作火箭燃料,燃烧时发生的反应是

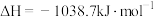
若该反应中有4mol
 键断裂,则形成的
键断裂,则形成的 键有
键有(2)第VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①基态Se原子的价电子轨道表示式为
②
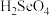 的酸性比
的酸性比
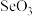 为
为 的空间结构为
的空间结构为
您最近一年使用:0次
2022-10-21更新
|
243次组卷
|
2卷引用:湖南省邵东市第一中学2022-2023学年高二上学期第三次月考化学试题
名校
解题方法
5 . NH3与甲醛CH2O反应可以制备乌洛托品(六亚甲基四胺,分子结构为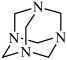 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
(1)基态氮原子的价电子轨道表达式为___________ ,第三电离能I3(C)___________ I3(N)(填“>”或“<)。
(2)NH3的空间构型为___________ ,CH2O中C采取的杂化类型为___________ 。CH2O中碳氢键与NH3中氮氢键相比,键长较长的是___________ 。
(3)乌洛托品为___________ (填“极性”或“非极性”)分子,分子中的所有N原子呈正四面体分布,所有C原子呈___________ 几何体分布,该分子可与H+形成配位键,电子对给予体为___________ 原子。
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为___________ 。乌洛托品比金刚烷(C10H16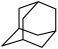 )水溶性更高,理由是
)水溶性更高,理由是___________ 。
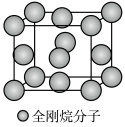
(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为___________ g/cm3。
 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:(1)基态氮原子的价电子轨道表达式为
(2)NH3的空间构型为
(3)乌洛托品为
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为
 )水溶性更高,理由是
)水溶性更高,理由是(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为

您最近一年使用:0次
2022-03-27更新
|
625次组卷
|
5卷引用:湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题
湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题四川省南充市2022届高三 适应性考试(二模)理综化学试题贵州省贵阳市五校2021-2022学年高三下学期联考理科综合化学试题(七)(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)
名校
解题方法
6 . 铜是重要的金属,广泛应用于电气、机械制造和国防等领域。铜的化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1) 原子的价层电子排布式为
原子的价层电子排布式为___________ 。
(2) 晶体中S原子的杂化方式为
晶体中S原子的杂化方式为___________ , 的立体构型为
的立体构型为___________ 。
(3)向 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 。下列说法正确的是___________(填标号)。
。下列说法正确的是___________(填标号)。
(4)葡萄糖与新制 的碱性溶液反应生成红色
的碱性溶液反应生成红色 沉淀。在1个
沉淀。在1个 晶胞中(结构如图所示),所包含的
晶胞中(结构如图所示),所包含的 原子的数目为
原子的数目为___________ ;每个氧原子与___________ 个铜原子配位。氧化亚铜在稀硫酸中很不稳定,得到蓝色溶液和一种固体,试写出其变化的离子方程式:___________ 。

(5)已知铜和氧的原子半径分别为a和b,试用a、b、 等表示
等表示 的密度(只要求写出计算式)
的密度(只要求写出计算式)___________ 。
(1)
 原子的价层电子排布式为
原子的价层电子排布式为(2)
 晶体中S原子的杂化方式为
晶体中S原子的杂化方式为 的立体构型为
的立体构型为(3)向
 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 。下列说法正确的是___________(填标号)。
。下列说法正确的是___________(填标号)。A.氨气极易溶于水,是因为 分子和 分子和 分子之间形成了3种不同的氢键 分子之间形成了3种不同的氢键 |
B. 分子和 分子和 分子的分子空间构型不同,氨气分子的键角大于水分子的键角 分子的分子空间构型不同,氨气分子的键角大于水分子的键角 |
C. 所含有的化学键有离子键、极性共价键和配位键 所含有的化学键有离子键、极性共价键和配位键 |
D. 的组成元素中,电负性最大的是氮元素 的组成元素中,电负性最大的是氮元素 |
 的碱性溶液反应生成红色
的碱性溶液反应生成红色 沉淀。在1个
沉淀。在1个 晶胞中(结构如图所示),所包含的
晶胞中(结构如图所示),所包含的 原子的数目为
原子的数目为
(5)已知铜和氧的原子半径分别为a和b,试用a、b、
 等表示
等表示 的密度(只要求写出计算式)
的密度(只要求写出计算式)
您最近一年使用:0次
名校
解题方法
7 . 氮、磷、锌元素的单质和化合物在农药生产及工业制造等领域用途非常广泛。回答下列问题:
(1)基态P原子中,电子占据的最高能层具有的原子轨道数为_______ ,基态Zn原子的价电子排布式是________ 。
(2)2019年德国专家从硫酸铵中检测出一种组成为N4H4(SO4)2的物质,该物质在水中以 和
和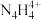 两种离子的形式存在。
两种离子的形式存在。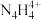 易被植物吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。
易被植物吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。
①N、O、S三元素第一电离能从小到大的顺序是_________ 。
②1个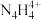 中含有
中含有_______ 个 键。
键。
(3)白磷在空气中缓慢氧化生成P4O6,其结构如图所示。P4O6中氧原子的杂化轨道类型为_______ ,每个P4O6分子中含孤电子对的数目为________ 。

(4)科学家合成了一种阳离子为“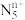 ”,其结构是对称的,5个N排成“V”形,含2个氮氮三键,且每个N原子都达到8电子稳定结构;此后又合成了一种含有“
”,其结构是对称的,5个N排成“V”形,含2个氮氮三键,且每个N原子都达到8电子稳定结构;此后又合成了一种含有“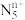 ”化学式为“N8”的离子晶体。“
”化学式为“N8”的离子晶体。“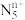 ”中位于角顶点上的N原子的杂化轨道类型是
”中位于角顶点上的N原子的杂化轨道类型是_______ ,“N8”中阴离子的空间构型为________ 。
(1)基态P原子中,电子占据的最高能层具有的原子轨道数为
(2)2019年德国专家从硫酸铵中检测出一种组成为N4H4(SO4)2的物质,该物质在水中以
 和
和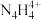 两种离子的形式存在。
两种离子的形式存在。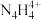 易被植物吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。
易被植物吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。①N、O、S三元素第一电离能从小到大的顺序是
②1个
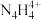 中含有
中含有 键。
键。(3)白磷在空气中缓慢氧化生成P4O6,其结构如图所示。P4O6中氧原子的杂化轨道类型为

(4)科学家合成了一种阳离子为“
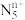 ”,其结构是对称的,5个N排成“V”形,含2个氮氮三键,且每个N原子都达到8电子稳定结构;此后又合成了一种含有“
”,其结构是对称的,5个N排成“V”形,含2个氮氮三键,且每个N原子都达到8电子稳定结构;此后又合成了一种含有“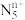 ”化学式为“N8”的离子晶体。“
”化学式为“N8”的离子晶体。“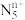 ”中位于角顶点上的N原子的杂化轨道类型是
”中位于角顶点上的N原子的杂化轨道类型是
您最近一年使用:0次
2020-10-17更新
|
208次组卷
|
2卷引用:湖南省岳阳县第一中学2022届高三下学期期中考试化学试题
解题方法
8 . 钛(Ti)和锆(Zr)是同一副族的相邻元素,它们的化合物在生产、生活中有着广泛的用途。
回答下列问题:
(1)钛和锆的价层电子结构相同,基态锆原子的价电子排布式为___________ ;与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有___________ 种。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是___________ ,H、B、Ti的电负性由小到大的顺序为___________ 。
(3)ZrCl4可以与乙二胺形成配合物[ ZrCl4( H2NCH2CH2NH2)]。
①1 mol [ ZrCl4( H2NCH2CH2NH2)]中含有σ键的物质的量为___________ mol。
②H2NCH2CH2NH2形成[ ZrCl4( H2NCH2CH2NH2)]后,H-N-H键角将___________ (填“变大”、“变小”或“不变”),原因是___________ 。
(4)已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。
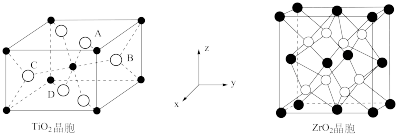
①TiO2晶胞中O2-的配位数是_________________ 。
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C、D原子坐标为___________ 、___________ 。
③已知二氧化锆晶胞的密度为ρ g·cm-3,则晶体中Zr原子和O原子之间的最短距离___________ pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。
回答下列问题:
(1)钛和锆的价层电子结构相同,基态锆原子的价电子排布式为
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)ZrCl4可以与乙二胺形成配合物[ ZrCl4( H2NCH2CH2NH2)]。
①1 mol [ ZrCl4( H2NCH2CH2NH2)]中含有σ键的物质的量为
②H2NCH2CH2NH2形成[ ZrCl4( H2NCH2CH2NH2)]后,H-N-H键角将
(4)已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。

①TiO2晶胞中O2-的配位数是
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C、D原子坐标为
③已知二氧化锆晶胞的密度为ρ g·cm-3,则晶体中Zr原子和O原子之间的最短距离
您最近一年使用:0次
2021-05-12更新
|
971次组卷
|
3卷引用:湖南省岳阳市平江县2022届高三下学期教学质量监测(三)化学试题
湖南省岳阳市平江县2022届高三下学期教学质量监测(三)化学试题山东省临沂市2021届高三二模考试化学试题(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】
9 . Ⅰ. 和
和 都是非线性光学晶体材料,在激光技术方面有广泛用途。回答下列问题:
都是非线性光学晶体材料,在激光技术方面有广泛用途。回答下列问题:
(1)基态氧原子核外电子有_______ 种不同的空间运动状态;基态 原子的价电子排布式为
原子的价电子排布式为_______ 。
(2)O、P、K、Zn中电负性最小的为_______ 。
(3) 、
、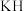 熔点由高到低的顺序为
熔点由高到低的顺序为_______ ,原因是_______ 。
(4) 可与
可与 结合生成
结合生成 ,水中
,水中 的键角比
的键角比 中的
中的_______ (填“大”或“小”)。 是常用的氧化剂,其分子结构如图1所示。
是常用的氧化剂,其分子结构如图1所示。 能与水混溶,却不溶于
能与水混溶,却不溶于 的原因是
的原因是_______ 。

(5)将纯液态 冷却到
冷却到 时,能凝固得到一种螺旋状单链结构的固体,其结构如图2所示,此固态SO3中S原子的杂化轨道类型是
时,能凝固得到一种螺旋状单链结构的固体,其结构如图2所示,此固态SO3中S原子的杂化轨道类型是_______ 。

Ⅱ.铁、铜和镉是三种过渡金属元素。回答下列问题:
(6) 比
比 稳定,试从原子结构角度解释原因
稳定,试从原子结构角度解释原因_______ 。
(7)新制的 能够溶解于过量浓
能够溶解于过量浓 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为_______ 。
(8)镉晶胞如图3所示。已知:NA是阿伏加德罗常数的值,晶体密度为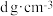 。在该晶胞中两个镉原子最近核间距
。在该晶胞中两个镉原子最近核间距
_______  (用含NA、
(用含NA、 的代数式表示);镉晶胞中原子空间利用率为
的代数式表示);镉晶胞中原子空间利用率为_______ (用含 的代数式表示)。
的代数式表示)。

 和
和 都是非线性光学晶体材料,在激光技术方面有广泛用途。回答下列问题:
都是非线性光学晶体材料,在激光技术方面有广泛用途。回答下列问题:(1)基态氧原子核外电子有
 原子的价电子排布式为
原子的价电子排布式为(2)O、P、K、Zn中电负性最小的为
(3)
 、
、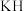 熔点由高到低的顺序为
熔点由高到低的顺序为(4)
 可与
可与 结合生成
结合生成 ,水中
,水中 的键角比
的键角比 中的
中的 是常用的氧化剂,其分子结构如图1所示。
是常用的氧化剂,其分子结构如图1所示。 能与水混溶,却不溶于
能与水混溶,却不溶于 的原因是
的原因是
(5)将纯液态
 冷却到
冷却到 时,能凝固得到一种螺旋状单链结构的固体,其结构如图2所示,此固态SO3中S原子的杂化轨道类型是
时,能凝固得到一种螺旋状单链结构的固体,其结构如图2所示,此固态SO3中S原子的杂化轨道类型是
Ⅱ.铁、铜和镉是三种过渡金属元素。回答下列问题:
(6)
 比
比 稳定,试从原子结构角度解释原因
稳定,试从原子结构角度解释原因(7)新制的
 能够溶解于过量浓
能够溶解于过量浓 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为(8)镉晶胞如图3所示。已知:NA是阿伏加德罗常数的值,晶体密度为
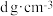 。在该晶胞中两个镉原子最近核间距
。在该晶胞中两个镉原子最近核间距
 (用含NA、
(用含NA、 的代数式表示);镉晶胞中原子空间利用率为
的代数式表示);镉晶胞中原子空间利用率为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
10 . Al、Cr、Co、Ni的合金及其相关化合物用途非常广泛,如锂离子电池的正极材料为LiCoO2,电解质溶液为LiBF4溶液。
(1)Co2+的基态核外电子排布式为_______ 。
(2)钴元素可形成种类繁多的配合物。三氯五氨合钴的化学式为Co(NH3)5Cl3,是一种典型的维尔纳配合物,具有反磁性。0.01molCo(NH3)5Cl3与足量硝酸银溶液反应时生成2.87g白色沉淀。Co(NH3)5Cl3中Co3+的配位数为_______ ,该配合物中的配位原子为_______ 。
(3)1951年Tsao最早报道了用LiAlH4还原腈:

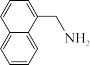 。
。
①LiAlH4中三种元素的电负性从大到小的顺序为_______ (用元素符号表示)。
② 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为_______ ,1mol该分子中含σ键的物质的量为_______ 。
(4)全惠斯勒合金CrxCoyAlz的晶胞结构如图甲所示,其化学式为_______ 。
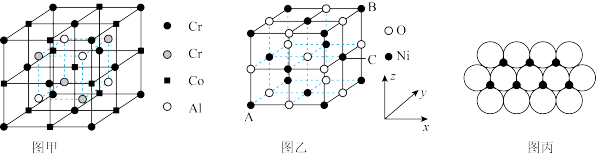
(5)NiO的晶胞结构如图乙所示其中离子坐标参数A为(0,0,0),则C的离子坐标参数为_______ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为apm,设阿伏加德罗常数的值为NA,每平方米的面积上具有该晶体的质量为_______ g(用含a、NA的代数式表示,Ni的相对原子质量为59)。
(1)Co2+的基态核外电子排布式为
(2)钴元素可形成种类繁多的配合物。三氯五氨合钴的化学式为Co(NH3)5Cl3,是一种典型的维尔纳配合物,具有反磁性。0.01molCo(NH3)5Cl3与足量硝酸银溶液反应时生成2.87g白色沉淀。Co(NH3)5Cl3中Co3+的配位数为
(3)1951年Tsao最早报道了用LiAlH4还原腈:


 。
。①LiAlH4中三种元素的电负性从大到小的顺序为
②
 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为(4)全惠斯勒合金CrxCoyAlz的晶胞结构如图甲所示,其化学式为

(5)NiO的晶胞结构如图乙所示其中离子坐标参数A为(0,0,0),则C的离子坐标参数为
您最近一年使用:0次



