名校
解题方法
1 . Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态 的价层电子轨道表达式为
的价层电子轨道表达式为_______ ,C、N、O的第一电离能从小到大的顺序为_______ 。
(2)N、P可形成一些复杂离子,如 、
、 、
、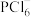 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为_______ , 的空间构型为
的空间构型为_______ 。
(3)Fe、Ni易与CO形成配合物, 中σ键与π键个数比为
中σ键与π键个数比为_______ , 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为_______ 晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO_______ NiO(填“>”、“<”或“=”)。
②FeO晶胞如图, 的配位数为
的配位数为_______ 。

(1)基态
 的价层电子轨道表达式为
的价层电子轨道表达式为(2)N、P可形成一些复杂离子,如
 、
、 、
、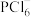 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为 的空间构型为
的空间构型为(3)Fe、Ni易与CO形成配合物,
 中σ键与π键个数比为
中σ键与π键个数比为 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO
②FeO晶胞如图,
 的配位数为
的配位数为
您最近一年使用:0次
2 . 硼元素作为农作物生长所需的微量元素之一,被形象的誉为“生殖元素”。硼也是一种用途广泛的化工原料,主要用于生产硼砂、硼酸和硼的各种化合物。请回答下列问题:
(1)基态硼原子的价电子轨道表示式为___________ ;与同周期的铍元素相比,硼的第一电离能小的原因是___________ 。
(2)BF3的VSEPR模型为___________ ; BF3的键角大于NF3的键角,解释其原因____________ 。
(3)碳化硼(B4C)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350°C、沸点为3500°C,属于____ 晶体。 原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+  表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为___________ 。
(4)氨硼烷( )是一种新型储氢材料,氨硼烷分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),组成氨硼烷的各元素的电负性由大到小的顺序为
)是一种新型储氢材料,氨硼烷分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),组成氨硼烷的各元素的电负性由大到小的顺序为___________ 。
(5)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连如图1,1molH3BO3晶体中有___________ mol 氢键。H3BO3微溶于水,与水有微弱反应生成[B(OH)4]-而使其水溶液呈弱酸性,写出该反应的离子方程式___________ 。

(6)砷化硼的晶胞结构如图2,图3中矩形AA'C 'C是沿晶胞对角面取得截图。

①晶胞中各原子在矩形AA'C 'C中的位置为___________ ( 填编号)。

②若晶胞的边长为apm,阿伏加德罗常数的值为N0,则晶体的密度为___________ g ·cm-3(列出计算表达式)。
(1)基态硼原子的价电子轨道表示式为
(2)BF3的VSEPR模型为
(3)碳化硼(B4C)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350°C、沸点为3500°C,属于
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为(4)氨硼烷(
 )是一种新型储氢材料,氨硼烷分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),组成氨硼烷的各元素的电负性由大到小的顺序为
)是一种新型储氢材料,氨硼烷分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),组成氨硼烷的各元素的电负性由大到小的顺序为(5)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连如图1,1molH3BO3晶体中有

(6)砷化硼的晶胞结构如图2,图3中矩形AA'C 'C是沿晶胞对角面取得截图。

①晶胞中各原子在矩形AA'C 'C中的位置为

②若晶胞的边长为apm,阿伏加德罗常数的值为N0,则晶体的密度为
您最近一年使用:0次
3 . 许多元素及它们的化合物在科学研究和工业生产中具有多种用途。请回答下列有关问题:
(1)现代化学中,常利用____ 上的特征谱线来鉴定元素。
(2)某同学画出的基态碳原子的核外电子排布图为 ,该电子排布图背了
,该电子排布图背了____ 。CH 、—CH3、CH
、—CH3、CH 都是重要的有机反应中间体。CH
都是重要的有机反应中间体。CH 、CH
、CH 的空间构型分别为
的空间构型分别为____ 、____ 。
(3)咪唑的结构为 。分子中的大π键可用符号π
。分子中的大π键可用符号π 表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π )。咪唑分子中的大π键可表示为
)。咪唑分子中的大π键可表示为____ ,咪唑比环戊烯C5H8熔点高的主要原因是____ 。
(4) 中孤电子对与π键比值为
中孤电子对与π键比值为_____ ,碳原子的杂化方式为____ 。
(5)铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力。有望获得较高的微波磁导率,具有极大的市场潜力。其四子格结构如图所示,已知晶体密度为ρg·cm-3,阿伏加德罗常数为NA。

①写出氮化铁中铁的堆积方式为____ 。
②该化合物的化学式为____ 。
③计算出Fe(II)围成的八面体的体积为____ cm3。
(1)现代化学中,常利用
(2)某同学画出的基态碳原子的核外电子排布图为
 ,该电子排布图背了
,该电子排布图背了 、—CH3、CH
、—CH3、CH 都是重要的有机反应中间体。CH
都是重要的有机反应中间体。CH 、CH
、CH 的空间构型分别为
的空间构型分别为(3)咪唑的结构为
 。分子中的大π键可用符号π
。分子中的大π键可用符号π 表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π )。咪唑分子中的大π键可表示为
)。咪唑分子中的大π键可表示为(4)
 中孤电子对与π键比值为
中孤电子对与π键比值为(5)铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力。有望获得较高的微波磁导率,具有极大的市场潜力。其四子格结构如图所示,已知晶体密度为ρg·cm-3,阿伏加德罗常数为NA。

①写出氮化铁中铁的堆积方式为
②该化合物的化学式为
③计算出Fe(II)围成的八面体的体积为
您最近一年使用:0次
解题方法
4 . 硫酸亚铁铵是一种蓝绿色的复盐,俗名为摩尔盐,化学式为(NH4)2Fe(SO4)2•6H2O。它在空气中稳定,是重要的化工原料,用途十分广泛。该物质隔绝空气加强热会发生分解,一种分解方式可表示为:(NH4)2Fe(SO4)2•6H2O=2NH3↑+FeO+2SO3↑+7H2O↑。请回答下列问题:
(1)基态铁原子的价电子排布式为___________ ,s电子的电子云形状为___________ 。
(2)摩尔盐中的组成元素N、O的电负性大小顺序是___________ 。
(3)SO2、SO3、SO 是三种常见含硫微粒。
是三种常见含硫微粒。
①SO 微粒的立体构型为
微粒的立体构型为___________ ,SO2中心原子的杂化方式为___________ 。
②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是___________ (填“桥氧”或“端基氧”),理由是___________ 。
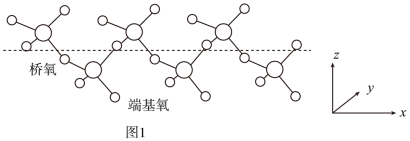
(4)噻吩( )、吡咯(
)、吡咯(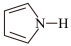 )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩___________ 吡咯(填“<”、“>”或“=”),理由是___________ 。
(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。
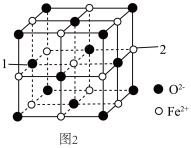
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0, ,
, ),则原子2的坐标为
),则原子2的坐标为___________ 。
②Fe2+处于O2﹣围成的___________ 空隙中。(填“正四面体”或“正八面体”)
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为___________ pm。
(1)基态铁原子的价电子排布式为
(2)摩尔盐中的组成元素N、O的电负性大小顺序是
(3)SO2、SO3、SO
 是三种常见含硫微粒。
是三种常见含硫微粒。①SO
 微粒的立体构型为
微粒的立体构型为②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是

(4)噻吩(
 )、吡咯(
)、吡咯( )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0,
 ,
, ),则原子2的坐标为
),则原子2的坐标为②Fe2+处于O2﹣围成的
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为
您最近一年使用:0次
2022-04-15更新
|
333次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市2021届高三第二次质量检测理综化学试题
解题方法
5 . 过渡金属元素种类众多,具有重要的用途,回答下列问题:
(1)Fe元素能形成化学式为[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁( III)]的络合物,其中基态Fe3+的核外电子排布式为___________ ,尿素中C原子的杂化方式是___________ ,Fe3+比Fe2+稳定的原因是___________ 。
(2)Ti广泛应用于航空航天行业,络合物[Ti(OH)2(H2O)4]2+中含有的化学键有___________
a.离子键 b.σ键 c.配位键 d.氢键
对比分析H2O、H2S、H2Se,沸点最低的是___________ ,键角最小的是___________ 热稳定性最强的是___________ : 钛酸亚铁(FeTiO3)与80%的硫酸反应可生成TiOSO4,写出与SO 互为等电子体的一种分子的化学式:
互为等电子体的一种分子的化学式:___________ 。
(3)Mn 、Sn元素形成的一种磁性材料的单晶胞结构如图所示。

该晶胞中碳原子的原子坐标为___________ ,该晶体的化学式为___________ 该晶体中距离Sn最近的Mn原子有___________ 个 。
(1)Fe元素能形成化学式为[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁( III)]的络合物,其中基态Fe3+的核外电子排布式为
(2)Ti广泛应用于航空航天行业,络合物[Ti(OH)2(H2O)4]2+中含有的化学键有
a.离子键 b.σ键 c.配位键 d.氢键
对比分析H2O、H2S、H2Se,沸点最低的是
 互为等电子体的一种分子的化学式:
互为等电子体的一种分子的化学式:(3)Mn 、Sn元素形成的一种磁性材料的单晶胞结构如图所示。

该晶胞中碳原子的原子坐标为
您最近一年使用:0次
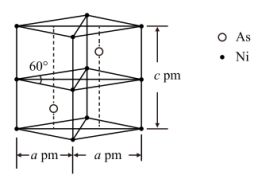
6 . 砷和镍是重要的材料和化工领域用途广泛。请回答下列问题:
(1)基态As原子中,价电子的电子云轮廓图形状为_______ 。与砷同周期的主族元素的基态原子中,电负性最大的为_______ (填元素符号)。
(2) 可用于碘的微量分析。
可用于碘的微量分析。
①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为_______ 。
②其中阴离子的VSEPR模型为_______ ,与其互为等电子体的分子为_______ (只写一种分子式即可)。
(3)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
NiO晶胞中Ni2+的配位数为_______ ,NiO熔点比NaCl高的原因是_______ 。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为_______ 。区分晶体Ni和非晶体Ni的最可靠的科学方法为_______ 。
(5)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为 ,该晶体的密度ρ=
,该晶体的密度ρ=_______ g·cm-3。
(1)基态As原子中,价电子的电子云轮廓图形状为
(2)
 可用于碘的微量分析。
可用于碘的微量分析。①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为
②其中阴离子的VSEPR模型为
(3)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
| Na+ | 102pm | Cl- | 181pm |
| Ni2+ | 69pm | O2- | 140pm |
NiO晶胞中Ni2+的配位数为
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为
(5)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为
 ,该晶体的密度ρ=
,该晶体的密度ρ=
您最近一年使用:0次
解题方法
7 . 第四周期某些过渡元素在工业生产中有着极其重要的作用。
Ⅰ.中国锰矿资源较多,分布广泛。
(1)写出基态锰原子的价电子排布图:___________ 。
(2) 用于
用于 分解制氧气的催化剂,
分解制氧气的催化剂, 中氧原子的杂化轨道类型为
中氧原子的杂化轨道类型为___________ 。
Ⅱ.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1) 常作净水剂和补铁剂,SO
常作净水剂和补铁剂,SO 的立体构型是
的立体构型是___________ 。
(2)铁氰化钾 是检验
是检验 的重要试剂。
的重要试剂。
①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式___________ 。
②铁氰化钾中存在的化学键有___________ (填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
Ⅲ.锌在工业中有重要作用,也是人体必需的微量元素。硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图所示。
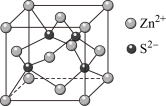
(1)该晶胞中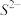 的配位数为
的配位数为___________ 。
(2)若晶胞参数为 ,则该晶体密度的计算式为
,则该晶体密度的计算式为___________  (用
(用 表示阿伏加德罗常数的值,不用化简)。
表示阿伏加德罗常数的值,不用化简)。
Ⅰ.中国锰矿资源较多,分布广泛。
(1)写出基态锰原子的价电子排布图:
(2)
 用于
用于 分解制氧气的催化剂,
分解制氧气的催化剂, 中氧原子的杂化轨道类型为
中氧原子的杂化轨道类型为Ⅱ.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)
 常作净水剂和补铁剂,SO
常作净水剂和补铁剂,SO 的立体构型是
的立体构型是(2)铁氰化钾
 是检验
是检验 的重要试剂。
的重要试剂。①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式
②铁氰化钾中存在的化学键有
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
Ⅲ.锌在工业中有重要作用,也是人体必需的微量元素。硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图所示。

(1)该晶胞中
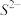 的配位数为
的配位数为(2)若晶胞参数为
 ,则该晶体密度的计算式为
,则该晶体密度的计算式为 (用
(用 表示阿伏加德罗常数的值,不用化简)。
表示阿伏加德罗常数的值,不用化简)。
您最近一年使用:0次
2021-05-18更新
|
258次组卷
|
2卷引用:新疆新源县第二中学2020-2021学年高二下学期期末联考化学试题
名校
解题方法
8 . 氮气、羟基乙胺(HOCH2CH2NH2)和氮化镓都含氮元素,其用途非常广泛。回答下列问题:
(1)基态氮原子价层电子排布图为___ ,其中电子能量最高的能级是___ 。
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为___ ,其中C和N的杂化方式均为___ HOCH2CH2NH2中∠HOC小于∠HNC,其原因是___ 。
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中___ 区,该环状配离子的配位原子为___ 。
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的___ (选填:八面体空隙、正四面体空隙、立方体空隙或三角形空隙);已知该晶胞底边边长为apm,高为cpm,阿伏加 德罗常数的值为NA,则该晶体的密度为___ g•cm-3(列出计算式即可)。

(1)基态氮原子价层电子排布图为
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的

您最近一年使用:0次
2020-06-05更新
|
412次组卷
|
4卷引用:新疆喀什莎车县第一中学2020-2021学年高三下学期第一次月考化学试题
新疆喀什莎车县第一中学2020-2021学年高三下学期第一次月考化学试题广西南宁市2020届高三第二次适应性测试理科综合化学试题甘肃省兰州市第一中学2020届高三冲刺模拟考试(二)理科综合化学试题(已下线)第32讲 晶体结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
9 . 硫及其化合物有许多用途,相关物质的物理常数如表所示:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________ ,基态S原子电子占据最高能级的电子云轮廊图为______ 形。
(2)据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是_____ 。
(3)如图为S8的结构,其S原子的杂化轨道类型为______ 。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_______ 形,其中共价键的类型有______ 种:固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为________ 。

(5)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为________ g·cm-3;晶胞中Fe2+位于S 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为______ cm。

| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(2)据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是
(3)如图为S8的结构,其S原子的杂化轨道类型为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为

(5)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为
 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
10 . 铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液,电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________ 。
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______ 。
(3)SO42-的立体构型是________ ,其中S原子的杂化轨道类型是_______ 。
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是
(3)SO42-的立体构型是
您最近一年使用:0次



