解题方法
1 . 氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,形成的化合物有:N2F2、HBF4、 等。回答下列问题:
等。回答下列问题:
(1)氟元素基态原子最高能级电子的电子云形状为___________ ,下列为氟原子激发态的电子排布式的是___________ (填序号)。
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为___________ 。
②N2F2结构式为___________ ,其分子中 键与
键与 键的数目之比为
键的数目之比为___________ 。
(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因___________ 。
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的___________ (填“长”或“短”)。___________ ,设NA为阿伏加德罗常数的值则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
 等。回答下列问题:
等。回答下列问题:(1)氟元素基态原子最高能级电子的电子云形状为
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为
②N2F2结构式为
 键与
键与 键的数目之比为
键的数目之比为(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物
 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的
 (列出计算式)。
(列出计算式)。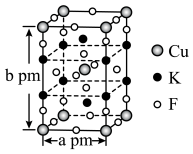
您最近一年使用:0次
名校
解题方法
2 . 铜、铁及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。
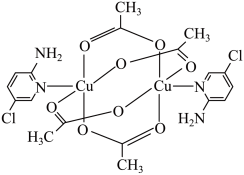
①基态氮原子的价层电子排布图为___________ ,在元素周期表中铜属于___________ (填“s”、“p”、“d”或“ds”)区。
②C.N、O元素原子的第一电离能由大到小的顺序为___________ 。
③X中 的配位数是
的配位数是___________ ,C原子的杂化轨道类型为___________ 。
(2)胆矾的简单平面结构式如图所示。
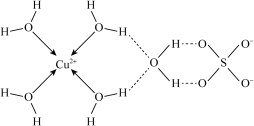
胆矾的化学式用配合物的形式可表示为___________ ;其阴离子的立体构型为___________ 。
(3)铁与硫能形成多种化合物,某种化合物的晶胞结构如下图所示。该化合物的化学式是___________ ;若该晶胞边长为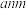 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  。
。

(1)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。

①基态氮原子的价层电子排布图为
②C.N、O元素原子的第一电离能由大到小的顺序为
③X中
 的配位数是
的配位数是(2)胆矾的简单平面结构式如图所示。

胆矾的化学式用配合物的形式可表示为
(3)铁与硫能形成多种化合物,某种化合物的晶胞结构如下图所示。该化合物的化学式是
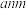 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
2023-12-19更新
|
248次组卷
|
2卷引用:2024届四川省自贡市普高高三上学期第一次诊断性考试理综试题
3 . 钝、钒、铬、铁、镍、铜等过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。Ti元素在元素周期表中的位置是___________ 。
(2)制备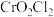 的反应为
的反应为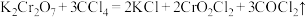 。
。
①上述化学方程式中非金属元素电负性由小到大的顺序为____________ (用元素符号表示)。
② 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为____________ ,中心原子的杂化方式为____________ 。
(3)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:____________ 。
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是____________ 。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。Ti元素在元素周期表中的位置是
(2)制备
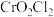 的反应为
的反应为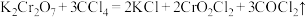 。
。①上述化学方程式中非金属元素电负性由小到大的顺序为
②
 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(3)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:
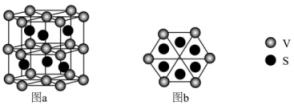
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是
您最近一年使用:0次
名校
解题方法
4 . 自然界中不存在氟的单质,得到单质氟的过程中,不少科学家为此献出了宝费的生命。1886年,法国化学家莫瓦桑发明了莫氏电炉,用电解法成功地制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有_______ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为_______ 。
(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为_______ 。
②S、P、Si的第一电离能由大到小的顺序为_______ 。
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为_______ 。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为_______ ,工业上不用电解AlCl3制取铝的原因为_______ 。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为
②S、P、Si的第一电离能由大到小的顺序为
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为
您最近一年使用:0次
2024-01-11更新
|
87次组卷
|
3卷引用:四川省合江县马街中学校2023-2024学年高二上学期1月期末化学试题
名校
解题方法
5 . 硼、氮、磷、钴、镍等元素的化合物在现代农业、科技、国防中有着许多独特的用途。
(1)磷原子在成键时,能将一个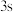 电子激发到
电子激发到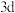 能级而参与成键,写出该激发态磷原子的核外电子排布式:
能级而参与成键,写出该激发态磷原子的核外电子排布式:___________ 。
(2)钴位于元素周期表的___________ 区,钴与 易形成正八面体形的
易形成正八面体形的 配离子,试推测
配离子,试推测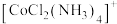 的空间构型有
的空间构型有___________ 种。
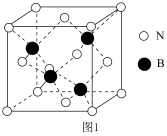
(3)制备氮化硼 的一种方法为
的一种方法为 。立方氮化硼(
。立方氮化硼( )的晶胞如图1所示,其晶体类型为
)的晶胞如图1所示,其晶体类型为___________ ,N的配位数为___________ 。试用价层电子对互斥理论解释 的键角比
的键角比 大的原因:
大的原因:___________ 。
(4)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。 的一种螯合物的结构如图2所示,
的一种螯合物的结构如图2所示, 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有___________  。
。

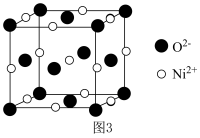
(5) 晶胞为
晶胞为 型结构(如图3)。其中
型结构(如图3)。其中 可看成填充在
可看成填充在 组成的
组成的________ 空隙中,填充率为 。将
。将 在空气中加热,部分
在空气中加热,部分 被氧化为
被氧化为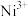 ,成为
,成为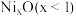 ,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有
,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有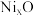 晶胞的质量为
晶胞的质量为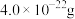 。则填充
。则填充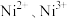 和未填充
和未填充 离子的空隙个数之比为
离子的空隙个数之比为___________ 。
(1)磷原子在成键时,能将一个
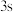 电子激发到
电子激发到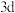 能级而参与成键,写出该激发态磷原子的核外电子排布式:
能级而参与成键,写出该激发态磷原子的核外电子排布式:(2)钴位于元素周期表的
 易形成正八面体形的
易形成正八面体形的 配离子,试推测
配离子,试推测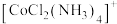 的空间构型有
的空间构型有(3)制备氮化硼
 的一种方法为
的一种方法为 。立方氮化硼(
。立方氮化硼( )的晶胞如图1所示,其晶体类型为
)的晶胞如图1所示,其晶体类型为 的键角比
的键角比 大的原因:
大的原因:
(4)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。
 的一种螯合物的结构如图2所示,
的一种螯合物的结构如图2所示, 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有 。
。
(5)
 晶胞为
晶胞为 型结构(如图3)。其中
型结构(如图3)。其中 可看成填充在
可看成填充在 组成的
组成的 。将
。将 在空气中加热,部分
在空气中加热,部分 被氧化为
被氧化为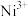 ,成为
,成为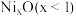 ,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有
,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有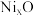 晶胞的质量为
晶胞的质量为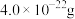 。则填充
。则填充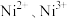 和未填充
和未填充 离子的空隙个数之比为
离子的空隙个数之比为
您最近一年使用:0次
解题方法
6 . ⅢA和ⅤA元素形成化合物在生产、生活中具有广泛用途。回答下列问题:
(1)铝的价电子排布式为_______ 。
(2)元素第一电离能Mg_______ (填“大于”或“小于”)Al。
(3)科学家合成了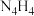 离子晶体。阴离子为
离子晶体。阴离子为 ,其中心原子轨道的杂化方式为
,其中心原子轨道的杂化方式为_______ ,阳离子的空间构型为_______ 。
(4) 熔点远低于
熔点远低于 的原因是
的原因是_______ ; 晶体变成气体时,测得气体的相对分子质量接近267,其中氯只有两种化学环境,比例为
晶体变成气体时,测得气体的相对分子质量接近267,其中氯只有两种化学环境,比例为 ,试画出该气体分子的结构式
,试画出该气体分子的结构式_______ 。
(5)原子晶体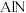 的晶胞参数为
的晶胞参数为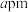 ,它的晶体的晶胞结构如图。
,它的晶体的晶胞结构如图。
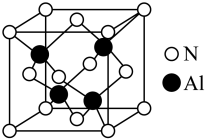
①该晶胞内存在共价键数目为_______ 。
②紧邻Al、N原子间距离为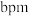 ,紧邻的N原子之间距离为
,紧邻的N原子之间距离为 ,则
,则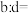
_______ 。
③该晶体的密度为_______  (阿伏加德罗常数的值用
(阿伏加德罗常数的值用 表示,列出计算式即可)。
表示,列出计算式即可)。
(1)铝的价电子排布式为
(2)元素第一电离能Mg
(3)科学家合成了
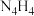 离子晶体。阴离子为
离子晶体。阴离子为 ,其中心原子轨道的杂化方式为
,其中心原子轨道的杂化方式为(4)
 熔点远低于
熔点远低于 的原因是
的原因是 晶体变成气体时,测得气体的相对分子质量接近267,其中氯只有两种化学环境,比例为
晶体变成气体时,测得气体的相对分子质量接近267,其中氯只有两种化学环境,比例为 ,试画出该气体分子的结构式
,试画出该气体分子的结构式(5)原子晶体
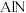 的晶胞参数为
的晶胞参数为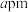 ,它的晶体的晶胞结构如图。
,它的晶体的晶胞结构如图。
①该晶胞内存在共价键数目为
②紧邻Al、N原子间距离为
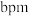 ,紧邻的N原子之间距离为
,紧邻的N原子之间距离为 ,则
,则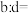
③该晶体的密度为
 (阿伏加德罗常数的值用
(阿伏加德罗常数的值用 表示,列出计算式即可)。
表示,列出计算式即可)。
您最近一年使用:0次
名校
解题方法
7 . 钴及其化合物在工业生产中具有广泛的用途,特别是作为工业生产的催化剂,钴及其化合物发挥了重要的作用。请回答下列问题:
(1)钴及其化合物广泛用作催化剂,说明钴元素在元素周期表中的位置为_______(填字母)。
(2)中国科学院院士、大连化学物理研究所研究员张涛及其团队开发出新型双原子催化剂(DACs),在丙烷脱氢性能上,该新型双原子催化剂优于单原子催化剂,其催化原理如图所示:_______ ,N原子为 杂化,未杂化的p轨道中容纳的电子数为
杂化,未杂化的p轨道中容纳的电子数为_______ 个;Zn或Co与N原子形成配位键时,提供孤电子对的原子是_______ (填元素符号);丙烷分解为丙烯的过程中,形成的化学键有_______ (填字母)。
A. 键 B.σ键 C.π键
键 B.σ键 C.π键
(3)CoO是石油化工中的一种催化剂,一种CoO的晶胞结构如图所示,该立方晶胞边长为a pm,设阿伏加德罗常数的值为 。
。 的分数坐标为
的分数坐标为_______ ;每个 周围与其距离最近且相等的
周围与其距离最近且相等的 共有
共有_______ 个;该CoO晶体的密度是_______ g⋅cm (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)钴及其化合物广泛用作催化剂,说明钴元素在元素周期表中的位置为_______(填字母)。
| A.主族元素 | B.金属与非金属分界线 |
| C.稀土元素 | D.过渡金属元素 |
(2)中国科学院院士、大连化学物理研究所研究员张涛及其团队开发出新型双原子催化剂(DACs),在丙烷脱氢性能上,该新型双原子催化剂优于单原子催化剂,其催化原理如图所示:

 杂化,未杂化的p轨道中容纳的电子数为
杂化,未杂化的p轨道中容纳的电子数为A.
 键 B.σ键 C.π键
键 B.σ键 C.π键(3)CoO是石油化工中的一种催化剂,一种CoO的晶胞结构如图所示,该立方晶胞边长为a pm,设阿伏加德罗常数的值为
 。
。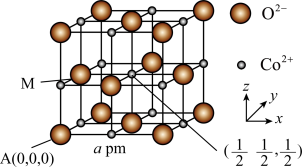
 的分数坐标为
的分数坐标为 周围与其距离最近且相等的
周围与其距离最近且相等的 共有
共有 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-04-11更新
|
140次组卷
|
3卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
解题方法
8 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。

(1)碳族元素位于周期表__________ 区,基态锗原子外围电子的轨道表示式为__________ 。
(2)科学家以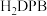 、
、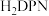 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。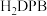 、
、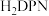 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是____________ 。
(3)金刚石(甲)、石墨(乙)、 (丙)的结构如图所示:
(丙)的结构如图所示:

①12g金刚石和石墨中含有的 键数目之比为
键数目之比为__________ 。
②金刚石的熔点高于 ,但低于石墨,原因是
,但低于石墨,原因是__________ 。
③ 的晶胞呈分子密堆积,下列晶体中,与
的晶胞呈分子密堆积,下列晶体中,与 具有相同晶体结构的是
具有相同晶体结构的是__________ 。
A. B.冰C.
B.冰C. D.
D. E.
E.
(4)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内 核间距为a
核间距为a ,层间距为k
,层间距为k ,晶体密度为ρ
,晶体密度为ρ ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为_________ ,其结构与石墨相似却不导电,原因是_____________ ,阿伏加德罗常数
__________ 。(用含a、k、ρ的式子表示)。


(1)碳族元素位于周期表
(2)科学家以
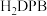 、
、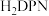 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。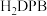 、
、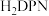 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是(3)金刚石(甲)、石墨(乙)、
 (丙)的结构如图所示:
(丙)的结构如图所示:
①12g金刚石和石墨中含有的
 键数目之比为
键数目之比为②金刚石的熔点高于
 ,但低于石墨,原因是
,但低于石墨,原因是③
 的晶胞呈分子密堆积,下列晶体中,与
的晶胞呈分子密堆积,下列晶体中,与 具有相同晶体结构的是
具有相同晶体结构的是A.
 B.冰C.
B.冰C. D.
D. E.
E.
(4)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内
 核间距为a
核间距为a ,层间距为k
,层间距为k ,晶体密度为ρ
,晶体密度为ρ ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为

您最近一年使用:0次
解题方法
9 . 硼及其化合物在材料制造、有机合成等方面用途非常广泛,硼的一些化合物表现出缺电子特征。回答下列问题:
(1)基态硼原子的电子排布式为_______ ;B和Al的第一电离能I1(B)_______ I1(Al)(填“>”或“=”或“<”)。
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是_______ ,层内存在的作用力有_______ 。硼酸显弱酸性与[B(OH)4]-配离子有关,硼酸的电离方程式:_______ 。

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是_______ 。
(4)已知晶体硼的熔、沸点及硬度数据和基本结构单元(由硼原子组成的正二十面体如图1所示,每个三角形均为正三角形,每个顶点为一个硼原子)如下:

①晶体硼属于原子(共价)晶体,其理由是_______ 。
②每一个硼基本单元由_______ 个原子组成;
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为_______ ;
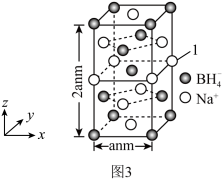
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为_______ 。已知NA代表阿伏加德罗常数的值,则硼氢化钠晶体的密度为ρ=_______ g·cm-3(用含NA的代数式表示)。
(1)基态硼原子的电子排布式为
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是
| 化学键 | B-H | B-O | B-B |
| 键能(kJ·mol-1) | 389 | 561 | 293 |
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
| 熔点(K) | 3832 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 3823 |
| 硬度 | 10 | 7.0 | 9.6 |

①晶体硼属于原子(共价)晶体,其理由是
②每一个硼基本单元由
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为

您最近一年使用:0次
2023-03-12更新
|
754次组卷
|
3卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高三上学期10月月考理综化学试题
名校
解题方法
10 . 回答下列问题:
(1)肼(N2H4)分子可视为NH3中的一个氢原子被—NH2(氨基)取代形成的氢化物。
①NH3分子的VSEPR模型是___________ ;N2H4分子中氮原子轨道的杂化类型是___________ 。
②肼作火箭燃料:N2O4+2N2H4=3N2+4H2O若反应中有4 mol N—H键断裂,则形成的π键有___________ mol。
(2)VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。H2Se的热稳定性比H2S___________ (填“强”或“弱”)。SO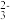 离子的立体构型为
离子的立体构型为___________ 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=___________ 。CO与N2结构相似,CO分子内σ键与π键个数之比为___________ 。
(1)肼(N2H4)分子可视为NH3中的一个氢原子被—NH2(氨基)取代形成的氢化物。
①NH3分子的VSEPR模型是
②肼作火箭燃料:N2O4+2N2H4=3N2+4H2O若反应中有4 mol N—H键断裂,则形成的π键有
(2)VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。H2Se的热稳定性比H2S
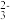 离子的立体构型为
离子的立体构型为(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
您最近一年使用:0次



