解题方法
1 . 以大洋锰结核(主要由MnO2和铁氧化物组成,还含有Al、Mg、Zn、Ca、Si等元素)为原料,制备MnxOy及Mn(H2PO4)2·2H2O,所得产品具有广泛的用途。制备过程如下图所示:
②25℃时,Ksp(ZnS)=2.9×10-25;Ksp(MnF2)=5.3×10-3;Ksp(MgF2)=7.4×10-11;Ksp(MnCO3)=1.0×10-11。
1.“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式_______ 。
2.温度对锰的浸出率、MnS2O6生成率的影响如图所示,为了减少副产物的生成,最适宜的温度_______。
3.“调pH”时,应控制的pH范围是_______ 。“净化”后滤渣3的主要成分_______ 。
4.“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为_______ 。若改用加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)  Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K =
Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K = _______ (填数值)。
5.要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为_______ 、过滤、洗涤、干燥。
“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
6.晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。其的分子式为_______ ;若阿伏加德罗常数为NA mol-1,则晶体Ⅰ的密度为_______ g·cm-3。

| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
1.“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式
2.温度对锰的浸出率、MnS2O6生成率的影响如图所示,为了减少副产物的生成,最适宜的温度_______。

| A.45度 | B.90度 | C.120度 | D.135度 |
4.“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为
 Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K =
Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K = 5.要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为
“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
6.晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。其的分子式为

您最近一年使用:0次
名校
解题方法
2 . 锰酸锂 是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。
是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。 中的三种元素位于元素周期表的共
中的三种元素位于元素周期表的共___________ 个区。
A.1 B.2 C.3
2.O元素的第一电离能比N小,但电负性却比N大,原因分别是___________ ,___________ 。
3.“酸浸”可将难溶的 转化为
转化为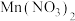 、
、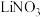 等产物。写出对应的离子方程式
等产物。写出对应的离子方程式___________
4.如果以盐酸代替 和
和 ,会产生一种有毒气体,该气体可能是
,会产生一种有毒气体,该气体可能是___________ 。(填化学式)
5.加入NaOH的目的是使得 转化为
转化为 ,过滤分离,避免后续
,过滤分离,避免后续 中混有
中混有___________ ,常温下, 的
的 是
是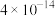 ,为使
,为使 沉淀完全(浓度
沉淀完全(浓度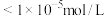 ),溶液的pH应大于
),溶液的pH应大于___________
6.过滤出的 往往用乙醇洗涤,写出用乙醇洗涤的两个优点
往往用乙醇洗涤,写出用乙醇洗涤的两个优点___________ 、___________ 。
 是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。
是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。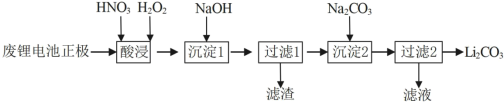
 中的三种元素位于元素周期表的共
中的三种元素位于元素周期表的共A.1 B.2 C.3
2.O元素的第一电离能比N小,但电负性却比N大,原因分别是
3.“酸浸”可将难溶的
 转化为
转化为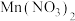 、
、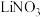 等产物。写出对应的离子方程式
等产物。写出对应的离子方程式4.如果以盐酸代替
 和
和 ,会产生一种有毒气体,该气体可能是
,会产生一种有毒气体,该气体可能是5.加入NaOH的目的是使得
 转化为
转化为 ,过滤分离,避免后续
,过滤分离,避免后续 中混有
中混有 的
的 是
是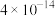 ,为使
,为使 沉淀完全(浓度
沉淀完全(浓度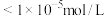 ),溶液的pH应大于
),溶液的pH应大于6.过滤出的
 往往用乙醇洗涤,写出用乙醇洗涤的两个优点
往往用乙醇洗涤,写出用乙醇洗涤的两个优点
您最近一年使用:0次
名校
3 . 海水中含有 、
、 、
、 等杂质离子,处理过程中装置易产生水垢。除去这三种离子所需试剂添加的试剂顺序为
等杂质离子,处理过程中装置易产生水垢。除去这三种离子所需试剂添加的试剂顺序为
 、
、 、
、 等杂质离子,处理过程中装置易产生水垢。除去这三种离子所需试剂添加的试剂顺序为
等杂质离子,处理过程中装置易产生水垢。除去这三种离子所需试剂添加的试剂顺序为A. , , ,稀盐酸 ,稀盐酸 | B. , , ,稀盐酸 ,稀盐酸 |
C. , , ,稀盐酸 ,稀盐酸 | D. , , ,稀盐酸 ,稀盐酸 |
您最近一年使用:0次
解题方法
4 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍并制备硫酸镍晶体:
(1)“碱浸”中NaOH的作用有 ___________ 、___________ 。
(2)滤液②中含有的金属离子是 ___________。
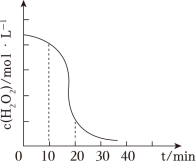
(3)“转化”步骤中H2O2的作用是 ___________ ,c(H2O2)随时间t的变化关系如图所示,反应开始10~20min内c(H2O2)迅速减小,原因可能是 ___________ 。(不考虑温度变化)
资料显示,硫酸镍结晶水合物的形态与温度有如表的关系:
(5)从滤液③中获得NiSO4•6H2O晶体的操作依次是 ___________ 、___________ 、过滤、洗涤、干燥。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其目的是___________ 。
实验室有一份NiSO4•xH2O样品,为测定其结晶水数目x,将4.188g样品加热至300℃充分反应,最终残留固体质量为2.328g。
(7)该样品中结晶水数目x为多少?___________ (结果精确至0.1,写出计算过程)
(8)再设计一种实验方案测定样品结晶水数目x(简述实验过程)。___________ 。

| 金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
| Ni2+ | 7.2 | 8.7 |
| Al3+ | 3.7 | 4.7 |
| Fe3+ | 2.2 | 3.2 |
| Fe2+ | 7.5 | 9.5 |
(2)滤液②中含有的金属离子是 ___________。
| A.Ni2+ | B.Al3+ | C.Fe3+ | D.Fe2+ |
| A.2.2 | B.3.2 | C.3.7 | D.4.7 |
资料显示,硫酸镍结晶水合物的形态与温度有如表的关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4•7H2O | NiSO4•6H2O | 多种结晶水合物 | NiSO4 |
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其目的是
实验室有一份NiSO4•xH2O样品,为测定其结晶水数目x,将4.188g样品加热至300℃充分反应,最终残留固体质量为2.328g。
(7)该样品中结晶水数目x为多少?
(8)再设计一种实验方案测定样品结晶水数目x(简述实验过程)。
您最近一年使用:0次
解题方法
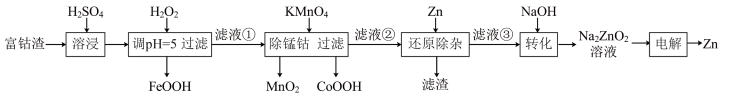
5 . 电解锌的生产过程中产生大量富钴渣,主要含金属Zn、Cd及CoO、MnO和FeO。采用以下工艺可利用富钴渣生产高纯锌_______ 。
(2)加入H2O2后生成FeOOH的化学方程式为_______ 。
(3)“滤液①”中含有的金属离子有Cd2+、Co2+、_______ 。
(4)“除锰钴”中,生成MnO2的离子方程式为_______ 。
(5)还原除杂的“滤渣”主要成分是_______ 。
(2)加入H2O2后生成FeOOH的化学方程式为
(3)“滤液①”中含有的金属离子有Cd2+、Co2+、
(4)“除锰钴”中,生成MnO2的离子方程式为
(5)还原除杂的“滤渣”主要成分是
您最近一年使用:0次
名校
解题方法
6 . 粉煤灰是燃煤产生的工业固体废料,主要成分有 、
、 ,还含有少量
,还含有少量 、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
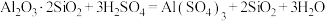

(1)“结晶”操作:缓缓加热,浓缩至___________ ,放置冷却,得到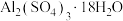 。
。
(2)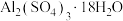 在250~300℃下失重40.5%得
在250~300℃下失重40.5%得 ,
,
___________ 。
(3)“还原焙烧”过程中发生反应的化学方程式为___________ 。
(4)设计实验检验粗氧化铝中是否含有 :
:___________ 。
(5)向硅酸钠溶液中通入过量 制备白炭黑的化学方程式为
制备白炭黑的化学方程式为___________ 。
 、
、 ,还含有少量
,还含有少量 、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下: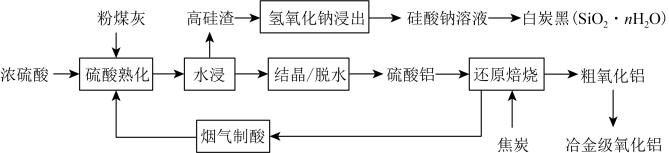
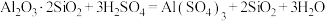

(1)“结晶”操作:缓缓加热,浓缩至
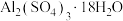 。
。(2)
 在250~300℃下失重40.5%得
在250~300℃下失重40.5%得 ,
,
(3)“还原焙烧”过程中发生反应的化学方程式为
(4)设计实验检验粗氧化铝中是否含有
 :
:(5)向硅酸钠溶液中通入过量
 制备白炭黑的化学方程式为
制备白炭黑的化学方程式为
您最近一年使用:0次
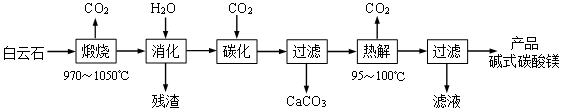
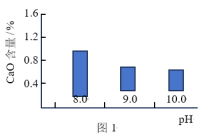
7 . 碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是一种重要的无机化工产品。一种由白云石【主要成分为CaMg(CO3)2,含少量SiO2、Fe2O3等】为原料制备碱式碳酸镁的实验流程如下:___________ ,钙元素的主要存在形式是___________ (填化学式)。
(2)“热解”生成碱式碳酸镁的化学方程式为___________ 。
(3)该工艺为达到清洁生产,可以循环利用的物质是___________ (填化学式)。
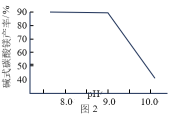
(2)“热解”生成碱式碳酸镁的化学方程式为
(3)该工艺为达到清洁生产,可以循环利用的物质是
您最近一年使用:0次
8 . FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下方法来制备无水FeCl2。有关物质的性质如下:
方法一:用H2还原无水FeCl3制取FeCl2。有关装置如下:____________ 。
(2)按气流由左到右的方向,上述仪器的连接顺序为____________。
(3)该制备装置的缺点为____________ 。
方法二:利用反应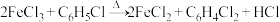 制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。
制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。_____________ 。
(5)仪器b中干燥剂可以选择_____________。
(6)反应结束后恢复至室温,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用最佳试剂是___________ 。
(7)回收滤液中C6H6Cl的操作方法是_____________。
(8)反应后将c中溶液稀释至250mL。量取25.00mL所配溶液,用0.400mol·L-1标准NaOH溶液滴定,终点时消耗标准液19.60mL。则氯化铁的转化率为___________ 。
(9)若反应后通入N2时间不足,则测得氯化铁的转化率______________ 。
A.偏低 B.偏高 C.不影响
(10)制备无水FeCl2需要用到无水FeCl3,某同学提出利用 制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方
制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方_______________ 。
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯;易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 100℃时升华 | 672 |
| 沸点/℃ | 132 | 173 | >1000 | |
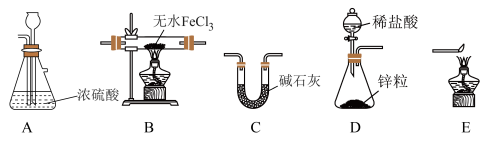
(2)按气流由左到右的方向,上述仪器的连接顺序为____________。
| A.D→C→B→A→E | B.D→A→B→C→E |
| C.D→B→A→C→E | D.D→C→A→B→E |
(3)该制备装置的缺点为
方法二:利用反应
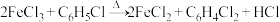 制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。
制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。
(5)仪器b中干燥剂可以选择_____________。
| A.碱石灰 | B.无水硫酸铜 | C.无水氯化钙 | D.浓硫酸 |
(6)反应结束后恢复至室温,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用最佳试剂是
(7)回收滤液中C6H6Cl的操作方法是_____________。
| A.萃取 | B.分液 | C.过滤 | D.蒸馏 |
(8)反应后将c中溶液稀释至250mL。量取25.00mL所配溶液,用0.400mol·L-1标准NaOH溶液滴定,终点时消耗标准液19.60mL。则氯化铁的转化率为
(9)若反应后通入N2时间不足,则测得氯化铁的转化率
A.偏低 B.偏高 C.不影响
(10)制备无水FeCl2需要用到无水FeCl3,某同学提出利用
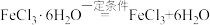 制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方
制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方
您最近一年使用:0次
解题方法
9 . 溶液法制取LiBF4的流程如下: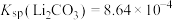 ,
,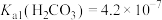 ,
,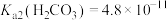 ;
;
ⅱ.反应①可以表示为: 。
。
(1)写出反应②的化学方程式:___________ 。室温条件下,反应②完成后若溶液中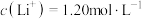 ,pH=8.0,则此时溶液中
,pH=8.0,则此时溶液中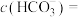
___________ 。
(2)对LiBF4粗品进一步提纯的方法称为______________ 。
(3)写出固相-气相接触法较溶液法制取LiBF4的一项优势:__________ 。

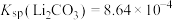 ,
,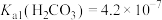 ,
,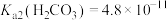 ;
;ⅱ.反应①可以表示为:
 。
。(1)写出反应②的化学方程式:
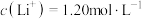 ,pH=8.0,则此时溶液中
,pH=8.0,则此时溶液中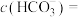
(2)对LiBF4粗品进一步提纯的方法称为
(3)写出固相-气相接触法较溶液法制取LiBF4的一项优势:
您最近一年使用:0次
解题方法
10 . 实验室模拟工业生产,利用废铜(含少量铁)和硫酸制备胆矾的过程如下:
1.灼烧后的固体用硫酸溶解。配制100 mL 1.50 mol·L-1 硫酸溶液,需用98%的硫酸(密度为1.84 g•cm-3)___________ mL(计算结果保留一位小数)。
2.粗CuSO4溶液中存在的正离子除Cu2+外,还有___________ 。
除杂操作为:在粗CuSO4溶液中滴加 3% H2O2溶液,再慢慢加入CuCO3粉末,调节溶液pH至一定范围,再加热至沸腾并过滤。
3.可用来替代CuCO3粉末的试剂是___________。
4.pH范围应控制在___________ 之间。
A. 1.9~9.0 B. 5.8~6.7 C. 3.2~4.7 D. 5.8~9.0
目的是___________ 。

| 离子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
1.灼烧后的固体用硫酸溶解。配制100 mL 1.50 mol·L-1 硫酸溶液,需用98%的硫酸(密度为1.84 g•cm-3)
2.粗CuSO4溶液中存在的正离子除Cu2+外,还有
除杂操作为:在粗CuSO4溶液中滴加 3% H2O2溶液,再慢慢加入CuCO3粉末,调节溶液pH至一定范围,再加热至沸腾并过滤。
3.可用来替代CuCO3粉末的试剂是___________。
| A.Na2CO3 | B.Cu(OH)2 | C.NaOH | D.CO2 |
A. 1.9~9.0 B. 5.8~6.7 C. 3.2~4.7 D. 5.8~9.0
目的是
您最近一年使用:0次



