名校
解题方法
1 . 下列实验装置或操作能达到相应实验目的的是
| 实验装置或操作 |
|
|
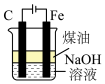
| 实验目的 | A.测量氨水浓度 | B.制备Fe(OH)2 |
| 实验装置或操作 |
|
|
| 实验目的 | C.检查装置气密性 | D.测量CCl4沸点 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7日内更新
|
46次组卷
|
2卷引用:2024届湘豫名校高三下学期考前保温卷理综试题-高中化学
名校
解题方法
2 . 高砷烟尘(主要成分有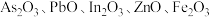 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为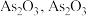 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为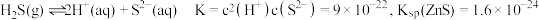 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用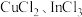 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
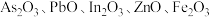 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: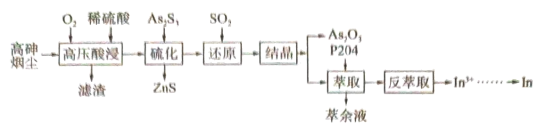
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为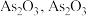 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为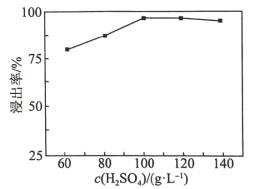
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为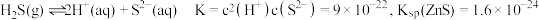 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用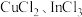 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2024-05-31更新
|
167次组卷
|
5卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
3 . 碘酸钙[ ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:
Ⅰ.将一定质量的 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用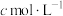 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
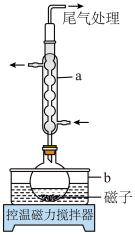
(1)仪器a的名称为___________ ,b中应盛放的最佳传热介质是___________ 。
(2)步骤Ⅰ中反应生成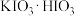 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:___________ 。反应过程中,在烧瓶瓶颈或仪器a下口处可能会看到___________ (填物质名称)析出,其原因是___________ 。
(3)步骤Ⅱ“一系列操作”包括静置、___________ 、洗涤、干燥,其中洗涤所用较佳试剂为___________ (填“水”或“乙醇”)。
(4)碘酸钙粗晶纯度为___________ %(用含a、c、V的代数式表示),下列情况导致产品纯度测定结果偏低的是___________ (填字母)。
A.所配待测溶液中含有 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数
C.盛放 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
 ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:Ⅰ.将一定质量的
 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1
 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL
 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用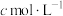 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
(1)仪器a的名称为
(2)步骤Ⅰ中反应生成
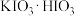 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:(3)步骤Ⅱ“一系列操作”包括静置、
(4)碘酸钙粗晶纯度为
A.所配待测溶液中含有
 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数C.盛放
 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
您最近一年使用:0次
2024-05-27更新
|
180次组卷
|
3卷引用:2024届河南省九师联盟2023-2024学年高三下学期4月联考理综试题-高中化学
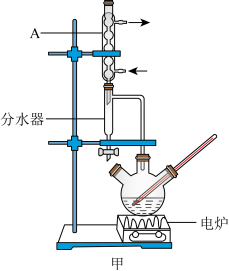
4 . 某实验小组进行酯化反应的改进,创新性地利用草酸(乙二酸)的自催化而不需外加浓硫酸即可实现草酸和1—丁醇合成草酸二丁酯。主要实验步骤如下: 三颈烧瓶中依次加入
三颈烧瓶中依次加入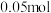 草酸、
草酸、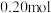 1—丁醇和
1—丁醇和 环己烷、三颗沸石。在三颈烧瓶中间瓶口连接分水器及仪器A,搭建如图甲所示的装置(部分装置已省略)。
环己烷、三颗沸石。在三颈烧瓶中间瓶口连接分水器及仪器A,搭建如图甲所示的装置(部分装置已省略)。
②回流反应:加热,升温至溶液沸腾并回流,将温度稳定在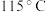 ,待分水器全部被水充满后继续回流
,待分水器全部被水充满后继续回流 ,即可停止反应。
,即可停止反应。
③后处理:移去热源,待温度降至 左右时,将反应液缓慢转移至烧杯中,边搅拌边加入溶液B直至无气泡产生,水洗,将上层油状液体转移至锥形瓶中,加入无水硫酸镁,
左右时,将反应液缓慢转移至烧杯中,边搅拌边加入溶液B直至无气泡产生,水洗,将上层油状液体转移至锥形瓶中,加入无水硫酸镁, 后,用短颈漏斗快速滤入
后,用短颈漏斗快速滤入 圆底烧瓶中进行蒸馏,获得纯净的草酸二丁酯,并称重收集产物
圆底烧瓶中进行蒸馏,获得纯净的草酸二丁酯,并称重收集产物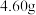 。
。
请回答下列问题:
(1)仪器 的名称为
的名称为_______ 。
(2)写出该合成反应的化学方程式:_______ 。
(3)后处理环节中,溶液B为_______ ,加入无水硫酸镁的作用是_______ 。
(4)该实验制得的草酸二丁酯的产率为_______ (保留3位有效数字)。
(5)该实验小组分别深入探究反应温度、带水剂(环己烷)用量对草酸二丁酯产率的影响。实验设计与结果如下。
Ⅰ.温度:在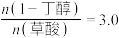 、反应时间为
、反应时间为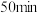 条件下,反应温度对酯产率的影响如图乙所示。
条件下,反应温度对酯产率的影响如图乙所示。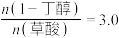 、反应时间为
、反应时间为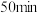 、反应温度在
、反应温度在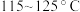 内,带水剂(环己烷)用量对酯产率的影响如图丙所示。
内,带水剂(环己烷)用量对酯产率的影响如图丙所示。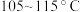 内,酯产率随温度升高而升高的主要原因是
内,酯产率随温度升高而升高的主要原因是_______ 。
②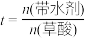 ,当
,当 在
在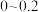 内,酯产率随着带水剂(环己烷)用量的增加而增加的原因是
内,酯产率随着带水剂(环己烷)用量的增加而增加的原因是_______ 。
 三颈烧瓶中依次加入
三颈烧瓶中依次加入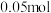 草酸、
草酸、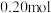 1—丁醇和
1—丁醇和 环己烷、三颗沸石。在三颈烧瓶中间瓶口连接分水器及仪器A,搭建如图甲所示的装置(部分装置已省略)。
环己烷、三颗沸石。在三颈烧瓶中间瓶口连接分水器及仪器A,搭建如图甲所示的装置(部分装置已省略)。②回流反应:加热,升温至溶液沸腾并回流,将温度稳定在
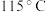 ,待分水器全部被水充满后继续回流
,待分水器全部被水充满后继续回流 ,即可停止反应。
,即可停止反应。③后处理:移去热源,待温度降至
 左右时,将反应液缓慢转移至烧杯中,边搅拌边加入溶液B直至无气泡产生,水洗,将上层油状液体转移至锥形瓶中,加入无水硫酸镁,
左右时,将反应液缓慢转移至烧杯中,边搅拌边加入溶液B直至无气泡产生,水洗,将上层油状液体转移至锥形瓶中,加入无水硫酸镁, 后,用短颈漏斗快速滤入
后,用短颈漏斗快速滤入 圆底烧瓶中进行蒸馏,获得纯净的草酸二丁酯,并称重收集产物
圆底烧瓶中进行蒸馏,获得纯净的草酸二丁酯,并称重收集产物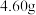 。
。请回答下列问题:
(1)仪器
 的名称为
的名称为(2)写出该合成反应的化学方程式:
(3)后处理环节中,溶液B为
(4)该实验制得的草酸二丁酯的产率为
(5)该实验小组分别深入探究反应温度、带水剂(环己烷)用量对草酸二丁酯产率的影响。实验设计与结果如下。
Ⅰ.温度:在
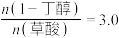 、反应时间为
、反应时间为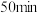 条件下,反应温度对酯产率的影响如图乙所示。
条件下,反应温度对酯产率的影响如图乙所示。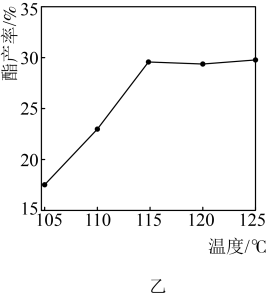
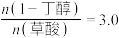 、反应时间为
、反应时间为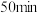 、反应温度在
、反应温度在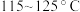 内,带水剂(环己烷)用量对酯产率的影响如图丙所示。
内,带水剂(环己烷)用量对酯产率的影响如图丙所示。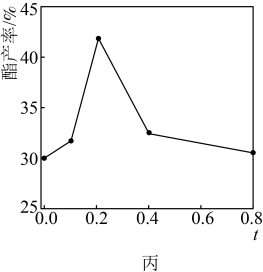
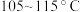 内,酯产率随温度升高而升高的主要原因是
内,酯产率随温度升高而升高的主要原因是②
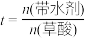 ,当
,当 在
在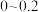 内,酯产率随着带水剂(环己烷)用量的增加而增加的原因是
内,酯产率随着带水剂(环己烷)用量的增加而增加的原因是
您最近一年使用:0次
5 . 以银锰精矿(主要含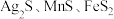 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银、锰及
)为原料联合提取银、锰及 的一种流程示意图如下:
的一种流程示意图如下: 的氧化性强于
的氧化性强于 。
。
(1)“浸锰渣”含有S和 ,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:
,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:_______ 。
(2)“除杂”时,若溶液中 ,欲使溶液中
,欲使溶液中 浓度小于
浓度小于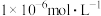 ,需控制的
,需控制的 范围为
范围为_______ (已知:室温下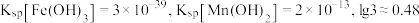 )。
)。
(3)沉锰过程在 为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在
为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在 左右达最大的原因是
左右达最大的原因是_______ 。 晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。
晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。_______  (用含有a、b及
(用含有a、b及 的代数式表示)。
的代数式表示)。
(5)“浸银”时,使用过量 和
和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出并生成S。写出“浸银”反应的离子方程式:
形式浸出并生成S。写出“浸银”反应的离子方程式:_______ 。“沉银”过程中需要过量的铁粉作为还原剂,“沉银”后的滤液中,主要含有的阳离子有_______ 。
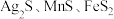 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银、锰及
)为原料联合提取银、锰及 的一种流程示意图如下:
的一种流程示意图如下: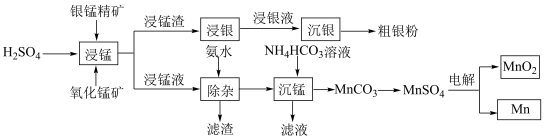
 的氧化性强于
的氧化性强于 。
。(1)“浸锰渣”含有S和
 ,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:
,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:(2)“除杂”时,若溶液中
 ,欲使溶液中
,欲使溶液中 浓度小于
浓度小于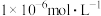 ,需控制的
,需控制的 范围为
范围为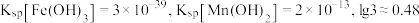 )。
)。(3)沉锰过程在
 为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在
为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在 左右达最大的原因是
左右达最大的原因是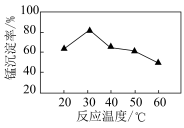
 晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。
晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。
①图1中“ ”代表的是
”代表的是 ”或“O”),对应图2中的
”或“O”),对应图2中的
 (用含有a、b及
(用含有a、b及 的代数式表示)。
的代数式表示)。(5)“浸银”时,使用过量
 和
和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出并生成S。写出“浸银”反应的离子方程式:
形式浸出并生成S。写出“浸银”反应的离子方程式:
您最近一年使用:0次
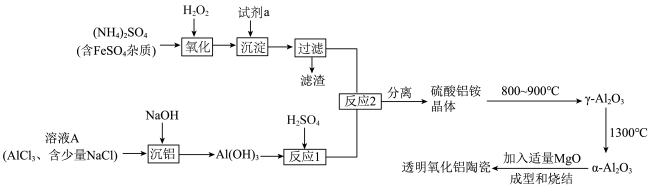
6 . 透明氧化铝陶瓷被认为是最具潜力的材料之一,制备透明氧化铝陶瓷的一种方法的流程如图所示:
(1)试剂a应选用___________ (填名称), 的电子式为
的电子式为___________ 。
(2)“反应1”的离子方程式为___________ 。
(3)检验上述流程中“过滤”后杂质已除尽的方法是___________ 。
(4)“沉铝”时,欲使 恰好完全转化为
恰好完全转化为 沉淀,应控制pH的范围是
沉淀,应控制pH的范围是___________ {已知:溶液中 、
、 浓度小于
浓度小于 认为
认为 沉淀完全,
沉淀完全,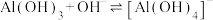 ,
,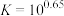 ,
,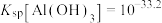 }。
}。
(5)硫酸铝铵晶体[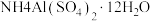 ]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的
]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的 溶液,沉淀质量最大时,反应的总离子方程式为
溶液,沉淀质量最大时,反应的总离子方程式为___________ 。
(6)硫酸铝铵晶体加热到800~900℃得到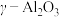 ,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为
,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为___________ 。___________ 特性;用它制造刚玉球磨机,是利用它的___________ 特性。
(1)试剂a应选用
 的电子式为
的电子式为(2)“反应1”的离子方程式为
(3)检验上述流程中“过滤”后杂质已除尽的方法是
(4)“沉铝”时,欲使
 恰好完全转化为
恰好完全转化为 沉淀,应控制pH的范围是
沉淀,应控制pH的范围是 、
、 浓度小于
浓度小于 认为
认为 沉淀完全,
沉淀完全,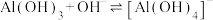 ,
,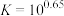 ,
,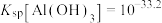 }。
}。(5)硫酸铝铵晶体[
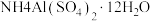 ]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的
]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的 溶液,沉淀质量最大时,反应的总离子方程式为
溶液,沉淀质量最大时,反应的总离子方程式为(6)硫酸铝铵晶体加热到800~900℃得到
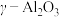 ,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为
,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为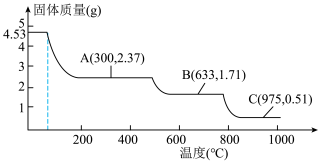
您最近一年使用:0次
2024-05-12更新
|
155次组卷
|
2卷引用:2024届河南省九师联盟2023-2024学年高三下学期4月联考理综试题-高中化学
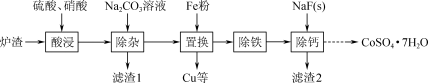
7 . 废弃电脑的CPU中含有贵重金属Cu、Ag、Au,可回收利用,部分流程如下:

(1)铜元素在周期表中位于______ ,基态铜原子的核外电子排布式为______ 。
(2)电脑CPU在使用时会涂抹一层散热硅脂(一种液体橡胶,主要成分为聚二甲基硅氧烷和聚甲基硅氧烷),可用______洗去;
(3)用Zn粉还原 的化学反应方程式为
的化学反应方程式为______ ;
(4)试剂1为______ (填名称,下同),试剂2为______ ;
(5)加入过其铁粉的原因是______ ;
(6)滤渣2溶于试剂2的原因是______ ;(用离子反应方程式表示)
(7)金属铜的晶胞结构如图所示,铜原子之间的最小距离为apm,则铜晶胞的密度为______  (
( 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。

(1)铜元素在周期表中位于
(2)电脑CPU在使用时会涂抹一层散热硅脂(一种液体橡胶,主要成分为聚二甲基硅氧烷和聚甲基硅氧烷),可用______洗去;
| A.NaOH溶液 | B.纯碱溶液 | C.稀硫酸 | D.酒精 |
(3)用Zn粉还原
 的化学反应方程式为
的化学反应方程式为(4)试剂1为
(5)加入过其铁粉的原因是
(6)滤渣2溶于试剂2的原因是
(7)金属铜的晶胞结构如图所示,铜原子之间的最小距离为apm,则铜晶胞的密度为
 (
( 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
8 . 实验室从某废弃炉渣(含Cu、Ni、Co、Ca、Fe等金属及其氧化物)中回收Cu、Ni、Co,其部分实验过程如下:___________ (答2条即可)。
(2)将“置换”后溶液中的Fe2+氧化为Fe3+,控制pH可形成Na2Fe6(SO4)4(OH)12沉淀。写出该反应的离子方程式:___________ 。
(3)向“除铁”后的滤液中加入NaF,使Ca2+转化为CaF2沉淀除去。若溶液pH偏低,将会导致CaF2沉淀不完全,其原因是___________ 。[Ksp(CaF2)=5.3×10-9、Ka(HF)=6.3×10-4]
(4)“除钙”后的溶液经过萃取、反萃取等操作可分离钴和镍,其中萃取原理可表示为Co2+(水层)+2HA(有机层) CoA2(有机层)+2H+(水层)。
CoA2(有机层)+2H+(水层)。___________ (已知Co2+、Ni2+的萃取率与pH的关系曲线如图所示。实验中须使用的试剂有Cyanex272、H2SO4溶液、NaOH溶液)。
(2)将“置换”后溶液中的Fe2+氧化为Fe3+,控制pH可形成Na2Fe6(SO4)4(OH)12沉淀。写出该反应的离子方程式:
(3)向“除铁”后的滤液中加入NaF,使Ca2+转化为CaF2沉淀除去。若溶液pH偏低,将会导致CaF2沉淀不完全,其原因是
(4)“除钙”后的溶液经过萃取、反萃取等操作可分离钴和镍,其中萃取原理可表示为Co2+(水层)+2HA(有机层)
 CoA2(有机层)+2H+(水层)。
CoA2(有机层)+2H+(水层)。①与萃取剂Cyanex272(磷酸酯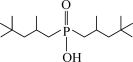 )相比,芳香基磷酸酯更适合高酸度废水中Co2+的萃取,原因是
)相比,芳香基磷酸酯更适合高酸度废水中Co2+的萃取,原因是

您最近一年使用:0次
2024高三·全国·专题练习
9 . FeS是一种黑色固体,常用作固体润滑剂、废水处理剂等。可通过高温合成法和均相沉淀法合成纳米FeS。
Ⅰ.高温合成法
称取一定质量还原铁粉和淡黄色硫粉,充分混合后置于真空密闭石英管中。用酒精喷灯加热。加热过程中硫粉升华成硫蒸气。持续加热至反应完全,冷却,得纳米FeS。
(1)若分别用S8和S6与足量铁粉反应制取等质量的FeS,消耗S8和S6的质量比为___________ 。
(2)反应需在真空环境下进行的原因是___________ 。
Ⅱ.均相沉淀法
实验室以硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]和硫代乙酰胺(CH3CSNH2)为主要原料,利用如图装置合成纳米硫化亚铁的流程如下:
CH3CSNH2+2H2O+H+=CH3COOH+H2S+NH ;
;
CH3CSNH2+3OH-=CH3COO-+S2-+NH3·H2O。
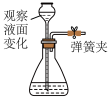
(3)加入药品前检查装置气密性的操作为___________ 。
(4)“反应”时,控制混合液pH约为9,温度70℃。三颈烧瓶内发生反应的离子方程式为___________ 。
(5)该方法得到的产品中常混有少量Fe(OH)2杂质。有研究表明,在混合液中添加少量柠檬酸钠(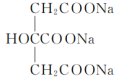 )可降低溶液中c(Fe2+),抑制Fe(OH)2杂质的形成。加入柠檬酸钠能降低c(Fe2+)的原因是
)可降低溶液中c(Fe2+),抑制Fe(OH)2杂质的形成。加入柠檬酸钠能降低c(Fe2+)的原因是___________ 。
(6)已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于乙醇。下表列出了不同温度下硫酸铵、硫酸亚铁、硫酸亚铁铵在水中的溶解度:
请补充完整实验室制取硫酸亚铁铵晶体的实验过程:取4.0g充分洗净的铁屑,___________ ,趁热过滤,洗涤、烘干,得未反应铁屑1.2g。向滤液中___________ ,低温烘干,得到硫酸亚铁铵晶体。[可选用的实验试剂有(NH4)2SO4晶体、3mol·L-1H2SO4溶液、0.1mol·L-1H2SO4溶液、蒸馏水、无水乙醇]
Ⅰ.高温合成法
称取一定质量还原铁粉和淡黄色硫粉,充分混合后置于真空密闭石英管中。用酒精喷灯加热。加热过程中硫粉升华成硫蒸气。持续加热至反应完全,冷却,得纳米FeS。
(1)若分别用S8和S6与足量铁粉反应制取等质量的FeS,消耗S8和S6的质量比为
(2)反应需在真空环境下进行的原因是
Ⅱ.均相沉淀法
实验室以硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]和硫代乙酰胺(CH3CSNH2)为主要原料,利用如图装置合成纳米硫化亚铁的流程如下:


CH3CSNH2+2H2O+H+=CH3COOH+H2S+NH
 ;
;CH3CSNH2+3OH-=CH3COO-+S2-+NH3·H2O。
(3)加入药品前检查装置气密性的操作为
(4)“反应”时,控制混合液pH约为9,温度70℃。三颈烧瓶内发生反应的离子方程式为
(5)该方法得到的产品中常混有少量Fe(OH)2杂质。有研究表明,在混合液中添加少量柠檬酸钠(
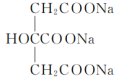 )可降低溶液中c(Fe2+),抑制Fe(OH)2杂质的形成。加入柠檬酸钠能降低c(Fe2+)的原因是
)可降低溶液中c(Fe2+),抑制Fe(OH)2杂质的形成。加入柠檬酸钠能降低c(Fe2+)的原因是(6)已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于乙醇。下表列出了不同温度下硫酸铵、硫酸亚铁、硫酸亚铁铵在水中的溶解度:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 70℃ | |
| (NH4)2SO4 | 73.0g | 75.4g | 78.0g | 81.0g | 84.5g | 91.9g |
| FeSO4·7H2O | 40.0g | 48.0g | 60.0g | 73.3g | - | - |
| (NH4)2SO4·FeSO4·6H2O | 18.1g | 21.2g | 24.5g | 27.9g | 31.3g | 38.5g |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
10 . 下列能达到实验目的并且对装置或仪器的使用或操作规范的是
|
|
| A.用裂化汽油提纯溴水中的Br2 | B.用标准KMnO4溶液滴定未知浓度的FeSO4溶液 |
|
|
| C.蒸干溶液获得Cu(NO3)2固体 | D.灼烧海带灰 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次