1 . 钴、镍是重要的战略金属,在工业中占据重要地位。以湿法炼锌过程中产出的钴渣为原料,分离回收渣中钴、镍的工艺流程如下。
②下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
(1)酸浸。投料后,保持温度、浸取时间不变,能提高金属元素浸出率的措施有___________ 。
(2)除铁。先向酸浸液中加入H2O2,反应完成后加入CaCO3调节溶液pH至4.0~4.5,得到滤渣1的主要成分为___________ 。
(3)除镍。Ni2+与丁二酮肟(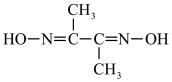 )反应生成鲜红色沉淀,可以用来检验Ni2+的存在。
)反应生成鲜红色沉淀,可以用来检验Ni2+的存在。
①丁二酮肟中σ键与π键数目之比为___________ 。
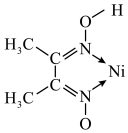
②Ni2+与丁二酮肟以物质的量之比1:2发生反应生成配合物,分子中含有2个五元环,且通过氢键形成两个六元环,补充图中该配合物的结构并标注出氢键___________ 。 的离子方程式为
的离子方程式为___________ 。
(5)沉钴。向除锰后的溶液中加入Na2S2O8溶液并控制溶液pH氧化沉Co2+。将Co(OH)3隔绝空气灼烧会生成Co2O3;如果控制温度不当,Co(OH)3会生成CoO杂质,反应的化学方程式是___________ ;铁、钴、镍属于中等活泼的金属,根据流程可知:Co2+的还原性___________ (填“强于”、“弱于”)Fe2+。
(6)上述流程中___________(填字母)可返回湿法炼锌系统回收锌。

②下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
| 金属离子 | Zn2+ | Fe3+ | Fe2+ | Mn2+ | Co2+ | Ni2+ |
| 开始沉淀的pH | 6.2 | 1.5 | 6.3 | 8.1 | 7.6 | 6.9 |
| 完全沉淀的pH | 8.2 | 2.8 | 8.3 | 10.1 | 9.2 | 8.9 |
(2)除铁。先向酸浸液中加入H2O2,反应完成后加入CaCO3调节溶液pH至4.0~4.5,得到滤渣1的主要成分为
(3)除镍。Ni2+与丁二酮肟(
 )反应生成鲜红色沉淀,可以用来检验Ni2+的存在。
)反应生成鲜红色沉淀,可以用来检验Ni2+的存在。①丁二酮肟中σ键与π键数目之比为
②Ni2+与丁二酮肟以物质的量之比1:2发生反应生成配合物,分子中含有2个五元环,且通过氢键形成两个六元环,补充图中该配合物的结构并标注出氢键
 的离子方程式为
的离子方程式为(5)沉钴。向除锰后的溶液中加入Na2S2O8溶液并控制溶液pH氧化沉Co2+。将Co(OH)3隔绝空气灼烧会生成Co2O3;如果控制温度不当,Co(OH)3会生成CoO杂质,反应的化学方程式是
(6)上述流程中___________(填字母)可返回湿法炼锌系统回收锌。
| A.浸渣 | B.滤渣1 | C.滤渣3 | D.滤液 |
您最近一年使用:0次
2 . 碘化亚铜(CuI)是一种难溶于水的白色固体,能被O2氧化。
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是___________ 。
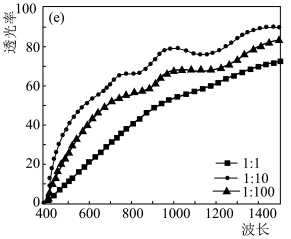
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为___________ 。___________ 。其他条件不变,溶液中铜元素的质量随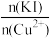 变化情况如图所示,当
变化情况如图所示,当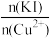 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是___________ 。 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是___________ 。
(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,___________ 。(实验中须使用的试剂和仪器有:SO2、I2、0.1 mol·L−1 NaOH、乙醇、真空干燥箱)。
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为___________ (保留一位小数)。
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为

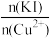 变化情况如图所示,当
变化情况如图所示,当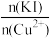 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是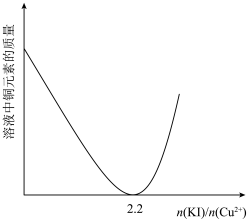
 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为

您最近一年使用:0次
解题方法
3 . 硫酸羟胺 是一种重要的化工原料,呈白色粉末状,可溶于水。一种利用氨法烟气脱硫中生成的亚硫酸氢铵制备环己酮肟的过程如下:
是一种重要的化工原料,呈白色粉末状,可溶于水。一种利用氨法烟气脱硫中生成的亚硫酸氢铵制备环己酮肟的过程如下: 浓溶液。
浓溶液。
(1)“反应”中生成 ,若
,若 ,写出该反应的离子方程式
,写出该反应的离子方程式__________ 。
(2)浓缩的目的有:①防止在后续蒸发浓缩制硫酸铵时耗能过多;②__________ ;③__________ 。
(3)“肟化反应”中还需通入气体X,写出X的化学式:__________ 。
(4)“分离”的操作名称为:__________ 。
(5)环己酮肟在酸性条件下水解可实现脱肟。实验小组利用题图装置进行环己酮肟的脱肟并制备硫酸羟胺。补充完整制取硫酸羟胺的实验方案:在三颈烧瓶中分别加入一定量环己酮肟、蒸馏水和硫酸,__________ ,萃取相经气相色谱分析环己酮肟的转化率较高后,__________ ,即可得到硫酸羟胺粗品。(实验中需要使用的试剂、仪器:甲苯、 溶液、蒸馏水、pH计)
溶液、蒸馏水、pH计)
 是一种重要的化工原料,呈白色粉末状,可溶于水。一种利用氨法烟气脱硫中生成的亚硫酸氢铵制备环己酮肟的过程如下:
是一种重要的化工原料,呈白色粉末状,可溶于水。一种利用氨法烟气脱硫中生成的亚硫酸氢铵制备环己酮肟的过程如下:
已知:①环己酮( )和羟胺
)和羟胺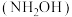 反应生成环己酮肟(
反应生成环己酮肟( )称为肟化反应;
)称为肟化反应;
 浓溶液。
浓溶液。(1)“反应”中生成
 ,若
,若 ,写出该反应的离子方程式
,写出该反应的离子方程式(2)浓缩的目的有:①防止在后续蒸发浓缩制硫酸铵时耗能过多;②
(3)“肟化反应”中还需通入气体X,写出X的化学式:
(4)“分离”的操作名称为:
(5)环己酮肟在酸性条件下水解可实现脱肟。实验小组利用题图装置进行环己酮肟的脱肟并制备硫酸羟胺。补充完整制取硫酸羟胺的实验方案:在三颈烧瓶中分别加入一定量环己酮肟、蒸馏水和硫酸,
 溶液、蒸馏水、pH计)
溶液、蒸馏水、pH计)
您最近一年使用:0次
2024-06-05更新
|
58次组卷
|
2卷引用:江苏省南通市2023-2024学年高三下学期期中考试化学试题
解题方法
4 . 工业用镁还原 制备金属Ti,工艺流程如图。下列说法
制备金属Ti,工艺流程如图。下列说法不正确 的是
 制备金属Ti,工艺流程如图。下列说法
制备金属Ti,工艺流程如图。下列说法
A.工业上可通过电解熔融 制取金属Mg 制取金属Mg |
B.用金属Mg还原 过程中需要通入 过程中需要通入 作保护气 作保护气 |
C.“真空蒸馏”的目的是使Mg、 气化,实现与Ti的分离 气化,实现与Ti的分离 |
| D.制得海绵钛中含有少量金属Mg,可以用稀盐酸浸泡除Mg |
您最近一年使用:0次
名校
解题方法
5 . 实验室以废旧磷酸铁锂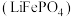 电极粉末为原料回收
电极粉末为原料回收 ,其实验过程可表示为
,其实验过程可表示为 磷酸铁锂加入三烧瓶中(装置见下图),滴液漏斗
磷酸铁锂加入三烧瓶中(装置见下图),滴液漏斗 装有
装有 盐酸、
盐酸、 中装有
中装有
 溶液。控制
溶液。控制 ,依次将两种溶液加入三颈烧瓶,充分反应
,依次将两种溶液加入三颈烧瓶,充分反应 后,过滤。
后,过滤。

①实验时应先打开滴液漏斗_______ (填“ ”或“
”或“ ”)。
”)。
②浸出后过滤所得滤渣主要成分为 写出
写出 转化为
转化为 的离子方程式:
的离子方程式:_______ 。
③控制原料 锂的浸出率为
锂的浸出率为 若提高盐酸用量,可使锂浸出率达
若提高盐酸用量,可使锂浸出率达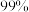 以上,但同时可能存在的缺陷有
以上,但同时可能存在的缺陷有_______ 。
(2)用碳酸钠作沉淀剂从浸出液中回收碳酸锂。有同学建议用“侯氏制碱法”的原理制备 查阅资料发现文献对常温下的
查阅资料发现文献对常温下的 有不同的描述:
有不同的描述:
i.白色固体。ii.尚未从溶液中分离出来。
为探究 的性质,将饱和
的性质,将饱和 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。
①上述现象说明,在该实验条件下
_______ (填“稳定”或“不稳定”)。
②实验中发生反应的离子方程式为_______ 。
(3)盐湖提盐后的浓缩卤水(含 和少量
和少量 )也常用作制备
)也常用作制备 的重要原料。已知:常温时
的重要原料。已知:常温时 的溶解度为:
的溶解度为:
 的溶解度曲线如下图所示。
的溶解度曲线如下图所示。 请补充完整实验方案:向浓缩卤水中边搅拌边缓慢添加石灰乳,
请补充完整实验方案:向浓缩卤水中边搅拌边缓慢添加石灰乳,_______ ,洗涤,低温烘干。 完全沉淀
完全沉淀 可选用的试剂:饱和
可选用的试剂:饱和 溶液、饱和
溶液、饱和 溶液、
溶液、 固体、蒸馏水]。
固体、蒸馏水]。
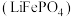 电极粉末为原料回收
电极粉末为原料回收 ,其实验过程可表示为
,其实验过程可表示为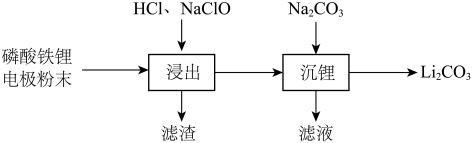
 磷酸铁锂加入三烧瓶中(装置见下图),滴液漏斗
磷酸铁锂加入三烧瓶中(装置见下图),滴液漏斗 装有
装有 盐酸、
盐酸、 中装有
中装有
 溶液。控制
溶液。控制 ,依次将两种溶液加入三颈烧瓶,充分反应
,依次将两种溶液加入三颈烧瓶,充分反应 后,过滤。
后,过滤。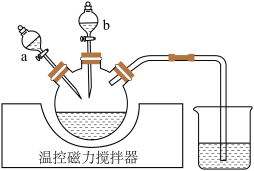


①实验时应先打开滴液漏斗
 ”或“
”或“ ”)。
”)。②浸出后过滤所得滤渣主要成分为
 写出
写出 转化为
转化为 的离子方程式:
的离子方程式:③控制原料
 锂的浸出率为
锂的浸出率为 若提高盐酸用量,可使锂浸出率达
若提高盐酸用量,可使锂浸出率达 以上,但同时可能存在的缺陷有
以上,但同时可能存在的缺陷有(2)用碳酸钠作沉淀剂从浸出液中回收碳酸锂。有同学建议用“侯氏制碱法”的原理制备
 查阅资料发现文献对常温下的
查阅资料发现文献对常温下的 有不同的描述:
有不同的描述:i.白色固体。ii.尚未从溶液中分离出来。
为探究
 的性质,将饱和
的性质,将饱和 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。①上述现象说明,在该实验条件下

②实验中发生反应的离子方程式为
(3)盐湖提盐后的浓缩卤水(含
 和少量
和少量 )也常用作制备
)也常用作制备 的重要原料。已知:常温时
的重要原料。已知:常温时 的溶解度为:
的溶解度为:
 的溶解度曲线如下图所示。
的溶解度曲线如下图所示。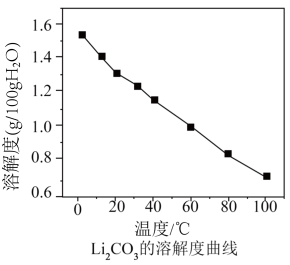
 请补充完整实验方案:向浓缩卤水中边搅拌边缓慢添加石灰乳,
请补充完整实验方案:向浓缩卤水中边搅拌边缓慢添加石灰乳, 完全沉淀
完全沉淀 可选用的试剂:饱和
可选用的试剂:饱和 溶液、饱和
溶液、饱和 溶液、
溶液、 固体、蒸馏水]。
固体、蒸馏水]。
您最近一年使用:0次
名校
解题方法
6 . 某研究小组以硫化铜精矿(含 、
、 元素的杂质)为主要原料制备
元素的杂质)为主要原料制备 粉,其流程如下:
粉,其流程如下: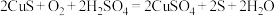 。
。
②金属氢氧化物开始沉淀和沉淀完全的 如下表所示。
如下表所示。
回答下列问题:
(1)步骤I中通入 采用高压的原因是
采用高压的原因是___________ 。
(2)下列说法正确的是___________(填字母)。
(3)步骤I、Ⅲ需要使用高压反应釜装置(如图)。步骤Ⅲ中,首先关闭出气口,向高压反应釜中通入固定流速的 ,然后通过控制气阀
,然后通过控制气阀 或
或 ,维持反应釜中的压强为
,维持反应釜中的压强为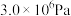 。请给出反应过程中的操作排序:
。请给出反应过程中的操作排序:___________ 。
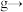 _____
_____ _____
_____ _____
_____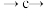 _____。
_____。 b.开启气阀
b.开启气阀 ,通入高压
,通入高压 c.关闭气阀
c.关闭气阀
d.开启气阀 e.开启气阀
e.开启气阀 ,通入高压
,通入高压 f.关闭气阀
f.关闭气阀
g.开启搅拌器 h.拆下罐体
(4)步骤Ⅲ中高压 可以从滤液中置换出金属
可以从滤液中置换出金属 ,而无法置换出金属
,而无法置换出金属 。请结合方程式说明其原因:
。请结合方程式说明其原因:___________ 。
(5)现取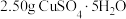 样品,加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。生成
样品,加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。生成 的温度范围为
的温度范围为___________ , 时发生反应的化学方程式为
时发生反应的化学方程式为___________ 。
 、
、 元素的杂质)为主要原料制备
元素的杂质)为主要原料制备 粉,其流程如下:
粉,其流程如下:
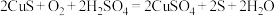 。
。②金属氢氧化物开始沉淀和沉淀完全的
 如下表所示。
如下表所示。| 金属氢氧化物 |  |  |  |
开始沉淀的 | 1.9 | 4.2 | 6.2 |
沉淀完全的 | 3.2 | 6.7 | 8.2 |
(1)步骤I中通入
 采用高压的原因是
采用高压的原因是(2)下列说法正确的是___________(填字母)。
| A.步骤I中过滤得到的滤渣中含有S |
B.步骤Ⅱ中用 调节 调节 约至4,使 约至4,使 、 、 沉淀完全 沉淀完全 |
C.步骤Ⅲ中增大溶液的酸度不利于 生成 生成 |
| D.为加快过滤速率,需用玻璃棒对漏斗中的沉淀进行充分搅拌 |
(3)步骤I、Ⅲ需要使用高压反应釜装置(如图)。步骤Ⅲ中,首先关闭出气口,向高压反应釜中通入固定流速的
 ,然后通过控制气阀
,然后通过控制气阀 或
或 ,维持反应釜中的压强为
,维持反应釜中的压强为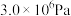 。请给出反应过程中的操作排序:
。请给出反应过程中的操作排序: _____
_____ _____
_____ _____
_____ _____。
_____。
 b.开启气阀
b.开启气阀 ,通入高压
,通入高压 c.关闭气阀
c.关闭气阀
d.开启气阀
 e.开启气阀
e.开启气阀 ,通入高压
,通入高压 f.关闭气阀
f.关闭气阀
g.开启搅拌器 h.拆下罐体
(4)步骤Ⅲ中高压
 可以从滤液中置换出金属
可以从滤液中置换出金属 ,而无法置换出金属
,而无法置换出金属 。请结合方程式说明其原因:
。请结合方程式说明其原因:(5)现取
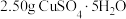 样品,加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。生成
样品,加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。生成 的温度范围为
的温度范围为 时发生反应的化学方程式为
时发生反应的化学方程式为
您最近一年使用:0次
2024-06-02更新
|
202次组卷
|
3卷引用:江苏省南京市第十三中学2024届高三下学期适应性考试化学试题
(已下线)江苏省南京市第十三中学2024届高三下学期适应性考试化学试题广东省华南师范大学附属中学2024届高三下学期高考适应性练习(4月)化学试题甘肃省陇南市部分学校2023-2024学年高三下学期化学押题考试(三模)化学试题
7 . 赤铜矿(主要成分为 ,含少量
,含少量 、
、 )含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备
)含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备 晶体的流程为:
晶体的流程为:
(1) 晶体结构如下图所示。晶体中存在的作用力包括离子键、
晶体结构如下图所示。晶体中存在的作用力包括离子键、_______ 。_______ 。 发生反应的离子方程式为
发生反应的离子方程式为_______ 。检验氧化完全的试剂为_______ (填化学式)。
(4)沉铁。离子浓度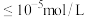 时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则
时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则 的
的 为
为_______ 。
(5)试从产率、试剂选择角度评价该制备流程并提出修改建议_______ 。
 ,含少量
,含少量 、
、 )含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备
)含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备 晶体的流程为:
晶体的流程为:

(1)
 晶体结构如下图所示。晶体中存在的作用力包括离子键、
晶体结构如下图所示。晶体中存在的作用力包括离子键、

 发生反应的离子方程式为
发生反应的离子方程式为(4)沉铁。离子浓度
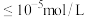 时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则
时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则 的
的 为
为(5)试从产率、试剂选择角度评价该制备流程并提出修改建议
您最近一年使用:0次
8 . 下列说法正确的是
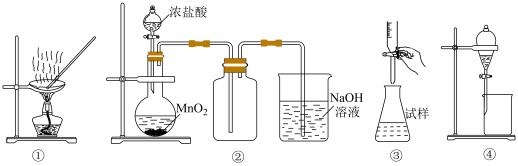
A.图①操作可从 溶液中提取 溶液中提取 晶体 晶体 |
B.图②装置可用于实验室制取并收集 |
| C.图③操作可用于盐酸滴定含有酚酞的NaOH溶液 |
| D.图④装置可用于四氯化碳萃取碘水中的碘单质 |
您最近一年使用:0次
9 . 乙二胺四乙酸铁钠(化学式 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。
已知:① 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为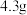 。
。
②乙二胺四乙酸( ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。
Ⅰ.制备
实验室用铁屑制备 的主要流程如下:
的主要流程如下:___________
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量 ,过程中浓度减少的离子有
,过程中浓度减少的离子有___________ (填离子符号)。
(3)“制备”步骤,向氧化所得的 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。
①从反应后的混合物中获得较高产率的 粗品的实验操作是,
粗品的实验操作是,___________ ,过滤,水洗,干燥。检验 是否洗净的试剂是
是否洗净的试剂是___________
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是___________ 。
样品中乙二胺四乙酸铁钠纯度可用 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为 发生反应:
发生反应: ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:___________ 。
 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。已知:①
 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为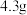 。
。②乙二胺四乙酸(
 ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。Ⅰ.制备

实验室用铁屑制备
 的主要流程如下:
的主要流程如下:
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量
 ,过程中浓度减少的离子有
,过程中浓度减少的离子有(3)“制备”步骤,向氧化所得的
 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。①从反应后的混合物中获得较高产率的
 粗品的实验操作是,
粗品的实验操作是, 是否洗净的试剂是
是否洗净的试剂是②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液
 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是
样品中乙二胺四乙酸铁钠纯度可用
 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为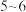 发生反应:
发生反应: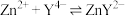 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。(4)补充完整实验方案:准确称取
 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:
您最近一年使用:0次
解题方法
10 . 用软锰矿( ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: ,
,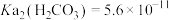 ,
,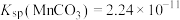
有关离子沉淀时的pH:
回答下列问题:
(1)“滤渣1”除了S、 外,还有
外,还有___________ (填化学式)。
(2)“试剂a”可以选用___________ (填标号),“除杂”应调pH范围是___________ 。
A.NaClO B. C.
C. D.NaOH
D.NaOH
(3)“沉锰”时发生反应的离子方程式为___________ 。
(4)“沉锰”后上层清液中
___________ 。
(5)“焙烧”时发生反应的化学方程式为___________ 。
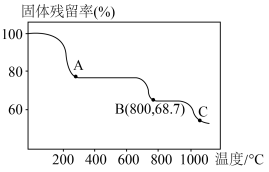
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为___________ 。
 ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: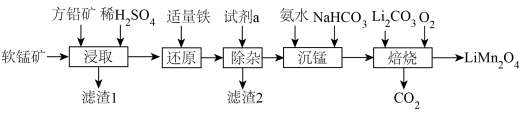
 ,
,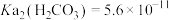 ,
,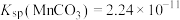
有关离子沉淀时的pH:
 |  |  |  | |
| 开始沉淀时 | 8.3 | 7.6 | 2.7 | 3.0 |
| 沉淀完全时 | 9.8 | 9.6 | 3.7 | 4.7 |
(1)“滤渣1”除了S、
 外,还有
外,还有(2)“试剂a”可以选用
A.NaClO B.
 C.
C. D.NaOH
D.NaOH(3)“沉锰”时发生反应的离子方程式为
(4)“沉锰”后上层清液中

(5)“焙烧”时发生反应的化学方程式为
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为
您最近一年使用:0次
2024-05-28更新
|
241次组卷
|
2卷引用:江苏省部分学校2024届高三下学期高考模拟化学试题



