名校
解题方法
1 . 氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 (
( 与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。
与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。
(1)盛放 粉末的仪器名称是
粉末的仪器名称是______ ,a中的试剂为_______ 。
(2)b中采用的加热方式是_______ ,c中化学反应的离子方程式是_____ ,采用冰水浴冷却的目的是_____ 。
(3)d的作用是____ ,可选用试剂____ (填标号)。
A. B.NaCl C.NaOH D.
B.NaCl C.NaOH D.
(4)反应结束后,取出b中试管,经冷却结晶,_______ ,______ ,干燥,得到 晶体。
晶体。
(5)取少量 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显
层显____ 色。可知该条件下 的氧化能力
的氧化能力_____ NaClO(填“大于”或“小于”)。
 (
( 与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。
与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。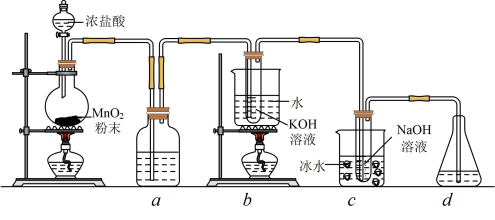
(1)盛放
 粉末的仪器名称是
粉末的仪器名称是(2)b中采用的加热方式是
(3)d的作用是
A.
 B.NaCl C.NaOH D.
B.NaCl C.NaOH D.
(4)反应结束后,取出b中试管,经冷却结晶,
 晶体。
晶体。(5)取少量
 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显
层显 的氧化能力
的氧化能力
您最近一年使用:0次
名校
解题方法
2 . 肉桂酸广泛用于食品添加剂、医药工业和有机合成等方面。其合成原理及实验室制备方法如下:主反应:
副反应: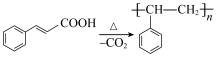 (棕红色树脂物)
(棕红色树脂物)
| 名称 | 相对分子质量 | 密度/ | 熔点/℃ | 沸点/℃ | 溶解度:g/100mL | ||
| 水 | 醇 | 醚 | |||||
| 苯甲醛 | 106 | 1.04 | -26 | 179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 1.08 | -73 | 140 | 遇水生成乙酸 | 溶 | 不溶 |
| 肉桂酸 | 148 | 1.24 | 133-134 | 300 | 0.04 | 24 | 溶 |
(Ⅰ)合成:向装置1的三颈烧瓶中先后加入4.2g无水碳酸钾、3mL(3.18g,0.03mol)新蒸馏过的苯甲醛和8mL(8.16g,0.08mol)乙酸酐,振荡使之混合均匀。在150~170℃加热回流40min,反应过程中体系的颜色会逐渐加深,并伴有棕红色树脂物出现。

①向反应液中加入30mL沸水,加固体碳酸钠至反应混合物呈弱碱性;
②按装置2进行水蒸气蒸馏;
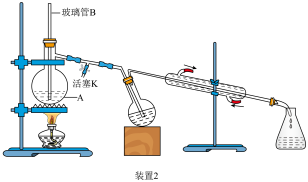
④滤液用浓盐酸酸化、冷水浴冷却、结晶、抽滤、洗涤、干燥,称量得固体3.0g。
回答下列问题:
(1)合成肉桂酸实验需在无水条件下进行,实验前仪器必须干燥的原因是
A.水 B.沙子 C.甘油(沸点290℃) D.植物油(沸点230-325℃)
(2)玻璃管B的作用是
(3)下列关于“分离与提纯”系列步骤的说法中不正确的是___________。
A.步骤①加 的目的是中和反应中产生的副产品乙酸,并使肉桂酸转变为盐溶于水中 的目的是中和反应中产生的副产品乙酸,并使肉桂酸转变为盐溶于水中 |
| B.步骤②的目的是将棕红色树脂物蒸出 |
| C.为了防止发生倒吸,水蒸气蒸馏结束后,应先熄灭酒精灯,再打开活塞K连通大气 |
| D.步骤③趁热过滤可通过保温漏斗实现,目的是防止肉桂酸钠因温度降低而结晶析出 |
(4)步骤④中抽滤按如图装置3进行,请选择合适的编号,按正确的操作顺序补充完整:
在布氏漏斗中加入润湿的滤纸→微开水龙头→___________→___________→___________→___________。

(5)若进一步提纯粗产品,采用的操作名称是
您最近一年使用:0次
解题方法
3 . 二茂铁(化学式为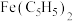 )常温下是一种橙黄色针状晶体,熔点为173℃,易升华,能进行一系列的取代反应,可用作紫外吸收剂、火箭燃料添加剂。实验室合成二茂铁的步骤如下:
)常温下是一种橙黄色针状晶体,熔点为173℃,易升华,能进行一系列的取代反应,可用作紫外吸收剂、火箭燃料添加剂。实验室合成二茂铁的步骤如下: ,开始搅拌;
,开始搅拌;
②向仪器A中分批次加入8.125g无水 ,然后加入2.000g还原铁粉,水浴加热回流。反应结束除去多余的反应物后将回流装置改为减压蒸馏装置,蒸去溶剂;
,然后加入2.000g还原铁粉,水浴加热回流。反应结束除去多余的反应物后将回流装置改为减压蒸馏装置,蒸去溶剂;
③反应器冷却后,再改成回流装置并继续通入 ,逐滴加入事先混合好的足量
,逐滴加入事先混合好的足量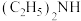 (二乙胺)
(二乙胺)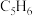 (环戊二烯)的混合液,搅拌加热反应;
(环戊二烯)的混合液,搅拌加热反应;
④反应结束后蒸去溶剂,析出粗品,然后以升华法提纯。
回答下列问题:
(1)仪器A的名称为___________ ,仪器B的作用是___________ 。
(2)步骤①中通入 的作用是
的作用是___________ 。
(3)写出在步骤②中仪器A内发生反应的化学方程式___________ 。
(4)已知步骤③中二乙胺反应后生成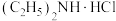 ,写出制备二茂铁的化学反应方程式
,写出制备二茂铁的化学反应方程式___________ 。
(5)采用图2所示装置进行升华法提纯时,粗品二茂铁放在___________ (填“蒸发皿”或“带孔滤纸”)上,装置中漏斗颈处棉花的作用是___________ 。___________ 。(保留4位有效数字)
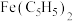 )常温下是一种橙黄色针状晶体,熔点为173℃,易升华,能进行一系列的取代反应,可用作紫外吸收剂、火箭燃料添加剂。实验室合成二茂铁的步骤如下:
)常温下是一种橙黄色针状晶体,熔点为173℃,易升华,能进行一系列的取代反应,可用作紫外吸收剂、火箭燃料添加剂。实验室合成二茂铁的步骤如下: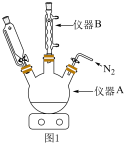
 ,开始搅拌;
,开始搅拌;②向仪器A中分批次加入8.125g无水
 ,然后加入2.000g还原铁粉,水浴加热回流。反应结束除去多余的反应物后将回流装置改为减压蒸馏装置,蒸去溶剂;
,然后加入2.000g还原铁粉,水浴加热回流。反应结束除去多余的反应物后将回流装置改为减压蒸馏装置,蒸去溶剂;③反应器冷却后,再改成回流装置并继续通入
 ,逐滴加入事先混合好的足量
,逐滴加入事先混合好的足量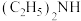 (二乙胺)
(二乙胺)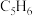 (环戊二烯)的混合液,搅拌加热反应;
(环戊二烯)的混合液,搅拌加热反应;④反应结束后蒸去溶剂,析出粗品,然后以升华法提纯。
回答下列问题:
(1)仪器A的名称为
(2)步骤①中通入
 的作用是
的作用是(3)写出在步骤②中仪器A内发生反应的化学方程式
(4)已知步骤③中二乙胺反应后生成
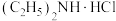 ,写出制备二茂铁的化学反应方程式
,写出制备二茂铁的化学反应方程式(5)采用图2所示装置进行升华法提纯时,粗品二茂铁放在
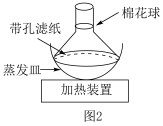
您最近一年使用:0次
4 . 已知 在
在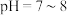 时溶解度最小。某工厂利用钒铬渣提取液(主要成分为
时溶解度最小。某工厂利用钒铬渣提取液(主要成分为 和
和 )制备
)制备 和
和 晶体,流程如下:
晶体,流程如下:
(1)关于“钒铬分离”过程,下列说法正确的是_______。
(2)从滤液A中获取 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为_______ (填“蒸发结晶”或“冷却结晶”);残留的含铬废水不能直接排放,处理时需要经过“酸化→还原→沉降”三个步骤,用 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式:
,则反应的离子方程式:_______ ;为了使 不高于
不高于 mol·L
mol·L ,“沉降”时应调节pH
,“沉降”时应调节pH _______ (保留两位有效数字)[该温度下 的
的 近似为
近似为 ]。
]。
(3)“转化”过程中选用 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为_______ 。
(4)该流程中可循环利用的物质主要有_______ 。
(5)某工厂用1m3钒铬渣提取液[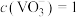 mol·L
mol·L ]最终制得
]最终制得 质量为58.5kg,则产率为
质量为58.5kg,则产率为_______ %。
 在
在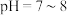 时溶解度最小。某工厂利用钒铬渣提取液(主要成分为
时溶解度最小。某工厂利用钒铬渣提取液(主要成分为 和
和 )制备
)制备 和
和 晶体,流程如下:
晶体,流程如下:
 |  | 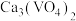 |  | |
| 20℃ | 19.3 | 84.0 | 0.1 | 5.5 |
| 40℃ | 22.5 | 96.5 | 0.09 | 2.49 |
| 60℃ | 26.3 | 102 | 0.09 | 1.3 |
(1)关于“钒铬分离”过程,下列说法正确的是_______。
A.研磨可防止生成的沉淀覆在 表面,提高 表面,提高 利用率 利用率 |
| B.研磨减小了所得钒渣的粒径,提高了后续步骤中钒渣的浸出率 |
| C.相对于20℃、40℃,工业上更宜选用60℃ |
| D.该过程发生了氧化还原反应 |
(2)从滤液A中获取
 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式:
,则反应的离子方程式: 不高于
不高于 mol·L
mol·L ,“沉降”时应调节pH
,“沉降”时应调节pH  的
的 近似为
近似为 ]。
]。(3)“转化”过程中选用
 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为(4)该流程中可循环利用的物质主要有
(5)某工厂用1m3钒铬渣提取液[
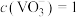 mol·L
mol·L ]最终制得
]最终制得 质量为58.5kg,则产率为
质量为58.5kg,则产率为
您最近一年使用:0次
名校
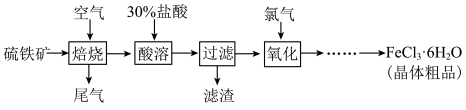
5 . 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:___________ ,检验氧化生成的阳离子的试剂是___________ 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气VL测定SO2含量:
方案一:让尾气缓慢通过以下装置。___________ ,该装置的作用是___________ 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理___________ (填“是”或“否”)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是___________ 。
②进行沉淀洗涤的方法是___________ 。
③SO2含量的表达式是___________ (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括___________ 、冷却结晶、过滤,该过程需保持盐酸过量,抑制Fe3+水解。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气VL测定SO2含量:
方案一:让尾气缓慢通过以下装置。
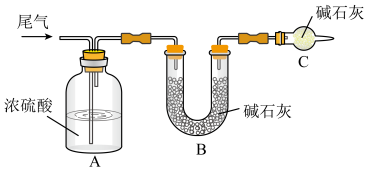
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是
②进行沉淀洗涤的方法是
③SO2含量的表达式是
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括
您最近一年使用:0次
名校
6 . 下列实验装置(部分夹持装置略)设计或操作能够达到实验目的的是
|
|
A.除去 中混有的少量HCl 中混有的少量HCl | B.制取 |
|
|
C.验证 的漂白性 的漂白性 | D.制备无水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。
Ⅰ.碱式碳酸铜的制备
①步骤ⅱ中发生的化学反应方程式为_____ 。
②原料中 必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因
必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因_____ (用离子方程式表示)。
③步骤ⅱ中反应温度低于80℃的原因是_____ 。
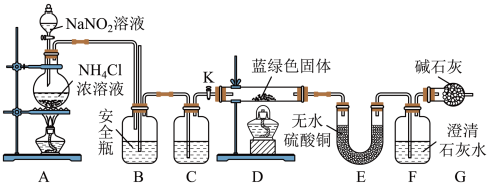
(2)在步骤(ⅲ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤(把上层清液直接倾入另一容器中,让沉淀尽可能留在烧杯内)、趁热过滤与减压过滤,最终制得蓝绿色固体。该实验流程中会使用到的下列装置有_____ (填序号);
同学们设计了如图装置,针对制得的蓝绿色固体进行检验。 ,点燃D处酒精灯。C中盛装的试剂应是
,点燃D处酒精灯。C中盛装的试剂应是_____ ;
(4)若蓝绿色固体的组成为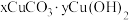 ,实验能观察到的现象是:D中现象为
,实验能观察到的现象是:D中现象为_____ ,E中现象为_____ ,F中现象为_____ 。
(5)同学们查阅文献得知: ,
,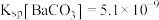 ,经讨论认为用
,经讨论认为用 代替
代替 来定量测定蓝绿色固体的化学式会更好,其原因是
来定量测定蓝绿色固体的化学式会更好,其原因是_____ (填序号);
a. 的碱性比
的碱性比 强
强
b.吸收等量 生成的
生成的 的质量大于
的质量大于 ,测量误差小
,测量误差小
c.相同条件下, 的溶解度明显大于
的溶解度明显大于
d. 溶解度大于
溶解度大于 ,能充分吸收
,能充分吸收
(6)若蓝绿色固体的组成为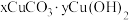 。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为
。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为 溶液,
溶液, 的相对分子质量为197]。则该蓝绿色固体的化学式为
的相对分子质量为197]。则该蓝绿色固体的化学式为_____ 。
Ⅰ.碱式碳酸铜的制备

①步骤ⅱ中发生的化学反应方程式为
②原料中
 必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因
必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因③步骤ⅱ中反应温度低于80℃的原因是
(2)在步骤(ⅲ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤(把上层清液直接倾入另一容器中,让沉淀尽可能留在烧杯内)、趁热过滤与减压过滤,最终制得蓝绿色固体。该实验流程中会使用到的下列装置有
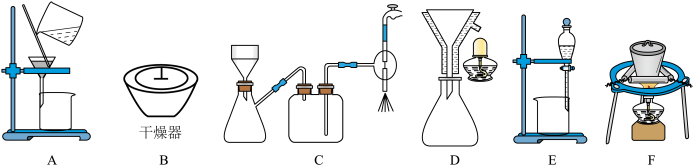
同学们设计了如图装置,针对制得的蓝绿色固体进行检验。
 ,点燃D处酒精灯。C中盛装的试剂应是
,点燃D处酒精灯。C中盛装的试剂应是(4)若蓝绿色固体的组成为
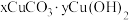 ,实验能观察到的现象是:D中现象为
,实验能观察到的现象是:D中现象为(5)同学们查阅文献得知:
 ,
,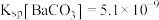 ,经讨论认为用
,经讨论认为用 代替
代替 来定量测定蓝绿色固体的化学式会更好,其原因是
来定量测定蓝绿色固体的化学式会更好,其原因是a.
 的碱性比
的碱性比 强
强b.吸收等量
 生成的
生成的 的质量大于
的质量大于 ,测量误差小
,测量误差小c.相同条件下,
 的溶解度明显大于
的溶解度明显大于
d.
 溶解度大于
溶解度大于 ,能充分吸收
,能充分吸收
(6)若蓝绿色固体的组成为
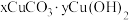 。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为
。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为 溶液,
溶液, 的相对分子质量为197]。则该蓝绿色固体的化学式为
的相对分子质量为197]。则该蓝绿色固体的化学式为
您最近一年使用:0次
名校
8 . 工业上,从有机催化剂(主要含钴和锌)回收金属的简易流程如下:
(1)“灼烧”的目的是___________ 。“酸浸”时加入稀硫酸,浸出液含有 、
、 、
、 、
、 、
、 等,检验
等,检验 的试剂是
的试剂是___________ (填化学式)。
(2)“净化”中加入 ,生成
,生成 和
和 。书写离子方程式:
。书写离子方程式:___________ 。
(3) (已知其中硫为+6价)中含
(已知其中硫为+6价)中含___________ mol过氧键 ,“沉钴”中加入
,“沉钴”中加入 ,还原产物为
,还原产物为 。
。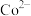 转化成
转化成 ,理论上消耗
,理论上消耗___________ mol 。
。
(4)“沉钴”的 不能太高,原因是
不能太高,原因是___________ 。
(5)“沉锌”加入 ,反应的离子方程式为
,反应的离子方程式为___________ ;沉锌的温度不能太高,原因是___________ 。
(6)“沉钴”中, 时
时 的数量级为
的数量级为___________ 。

(1)“灼烧”的目的是
 、
、 、
、 、
、 、
、 等,检验
等,检验 的试剂是
的试剂是(2)“净化”中加入
 ,生成
,生成 和
和 。书写离子方程式:
。书写离子方程式:(3)
 (已知其中硫为+6价)中含
(已知其中硫为+6价)中含 ,“沉钴”中加入
,“沉钴”中加入 ,还原产物为
,还原产物为 。
。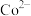 转化成
转化成 ,理论上消耗
,理论上消耗 。
。(4)“沉钴”的
 不能太高,原因是
不能太高,原因是(5)“沉锌”加入
 ,反应的离子方程式为
,反应的离子方程式为(6)“沉钴”中,
 时
时 的数量级为
的数量级为
您最近一年使用:0次
9 . 工业上利用锌焙砂(主要成分为  ,含有少量
,含有少量 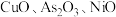 等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
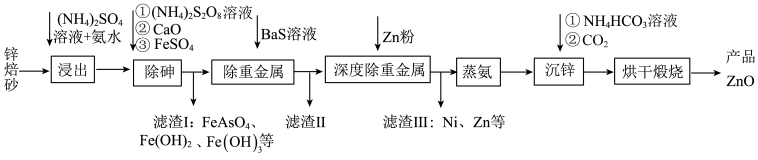
(1)用足量 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。
①“浸出”前,锌焙砂预先粉碎的目的是___________ 。
②通过“浸出”步骤,锌焙砂中的 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)“浸出”时 转化为
转化为  。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为___________
(3)“除重金属”时,加入 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是___________ 和  。
。
(4)“蒸氨”时会出现白色固体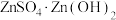 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)“沉锌”步骤①中加入足量 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为___________ 。
(6)煅烧”步骤中,在一定温度下,煅烧 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为___________  (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。
(7)该流程中可循环利用的物质有___________ (答出任意 2 种即可)
 ,含有少量
,含有少量 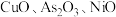 等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
(1)用足量
 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。①“浸出”前,锌焙砂预先粉碎的目的是
②通过“浸出”步骤,锌焙砂中的
 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为(2)“浸出”时
 转化为
转化为  。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为(3)“除重金属”时,加入
 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是 。
。(4)“蒸氨”时会出现白色固体
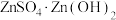 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)“沉锌”步骤①中加入足量
 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为(6)煅烧”步骤中,在一定温度下,煅烧
 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为 (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。(7)该流程中可循环利用的物质有
您最近一年使用:0次
解题方法
10 . 硫酸四氨合铜(Ⅱ)晶体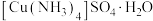 为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗
为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗 (含少量
(含少量 )合成硫酸四氨合铜晶体并测定其纯度。
)合成硫酸四氨合铜晶体并测定其纯度。
I.硫酸四氨合铜(Ⅱ)晶体制备与提纯
步骤①:称取 粗
粗 倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入
倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入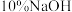 溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到
溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到 溶液。
溶液。
步骤②:___________ ,调pH为3.5的目的是___________ 。
(2)写出操作①中发生的离子反应方程式___________ 。
(3)操作③中洗涤步骤中可选用的洗涤液是___________ 。
A.乙醇与乙醚的混合液 B.蒸馏水 C.饱和硫酸钠溶液
(4)某同学认为操作②也可以通过蒸发浓缩、冷却结晶获得所要晶体,你___________ (填“是”或“否”)同意他的观点,并说明理由___________ 。
Ⅱ.硫酸四氨合铜(Ⅱ)晶体纯度测定
步骤①:准确称取 固体于烧杯中,加稀硫酸溶解,配制为
固体于烧杯中,加稀硫酸溶解,配制为 的溶液。
的溶液。
步骤②:量取上述试液 于锥形瓶中,加入
于锥形瓶中,加入 水和KI固体(稍过量)
水和KI固体(稍过量)
步骤③:用 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液
)滴定至溶液呈淡黄色,加入淀粉溶液 ,溶液变为蓝色,再加入
,溶液变为蓝色,再加入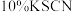 溶液
溶液 ,继续用
,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为 。
。
已知:①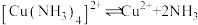 ,
,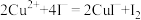 ,
, 沉淀表面易吸附
沉淀表面易吸附 。
。
② 比
比 更难溶。③
更难溶。③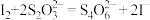 。
。
(5)硫酸四氨合铜晶体纯度是___________ (写出用m、V表示的计算表达式。)。
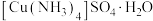 为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗
为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗 (含少量
(含少量 )合成硫酸四氨合铜晶体并测定其纯度。
)合成硫酸四氨合铜晶体并测定其纯度。I.硫酸四氨合铜(Ⅱ)晶体制备与提纯
步骤①:称取
 粗
粗 倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入
倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入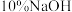 溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到
溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到 溶液。
溶液。步骤②:

(2)写出操作①中发生的离子反应方程式
(3)操作③中洗涤步骤中可选用的洗涤液是
A.乙醇与乙醚的混合液 B.蒸馏水 C.饱和硫酸钠溶液
(4)某同学认为操作②也可以通过蒸发浓缩、冷却结晶获得所要晶体,你
Ⅱ.硫酸四氨合铜(Ⅱ)晶体纯度测定
步骤①:准确称取
 固体于烧杯中,加稀硫酸溶解,配制为
固体于烧杯中,加稀硫酸溶解,配制为 的溶液。
的溶液。步骤②:量取上述试液
 于锥形瓶中,加入
于锥形瓶中,加入 水和KI固体(稍过量)
水和KI固体(稍过量)步骤③:用
 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液
)滴定至溶液呈淡黄色,加入淀粉溶液 ,溶液变为蓝色,再加入
,溶液变为蓝色,再加入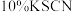 溶液
溶液 ,继续用
,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为 。
。已知:①
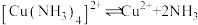 ,
,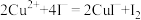 ,
, 沉淀表面易吸附
沉淀表面易吸附 。
。②
 比
比 更难溶。③
更难溶。③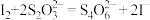 。
。(5)硫酸四氨合铜晶体纯度是
您最近一年使用:0次







