名校
1 . 固体X可能含有Fe、Fe3O4、Na2SO3、(NH4)2SO4、KNO3中的几种,进行如图所示实验:
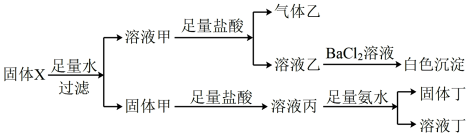
下列说法正确的是

下列说法正确的是
| A.X中一定含有(NH4)2SO4 |
| B.白色沉淀可能是混合物 |
| C.若乙是混合气体,则乙溶液的焰色试验呈黄色,透过蓝色钴玻璃观察呈紫色 |
| D.取少许溶液丙,滴加K3[ Fe(CN)6]溶液,若产生蓝色沉淀,则固体丁一定是混合物 |
您最近一年使用:0次
2022-08-17更新
|
287次组卷
|
2卷引用:重庆市巴蜀中学校2021-2022学年高三下学期适应性月考(八)化学试题
2 . 某学习小组拟研究FeSO4的分解实验探究,请你利用所学知识帮该小组完成以下实验方案。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2;假设2:FeO、SO3、SO2;假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
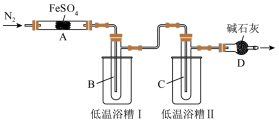
回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是_______ 。
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是_______ ,(只填操作),当A处固体完全分解后通入N2的目的是_______ 。
(3)低温浴槽I收集的物质是_______ (填化学式),低温浴槽II控制的温度范围为_______ 。
(4)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
甲组实验中A装置得到固体产物是_______ (填化学式)。
(5)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是_______ 。
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(6)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案_______ (填“1”或“2”)可行。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2;假设2:FeO、SO3、SO2;假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
| 物质 | SO3 | SO2 | O2 | N2 |
| 熔点/℃ | 16.8 | -72.4 | -218.4 | -209.9 |
| 沸点/℃ | 44.8 | -10 | -182.9 | -195.8 |

回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是
(3)低温浴槽I收集的物质是
(4)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
| 实验 | A处温度/℃ | FeSO4质量/g | 低温浴槽I净增质量/g | 低温浴槽II净增质量/g |
| 甲 | T1 | 3.04 | 0.80 | 0.64 |
| 乙 | T2 | 4.56 | 1.60 | 0.64 |
(5)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(6)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案
您最近一年使用:0次
解题方法
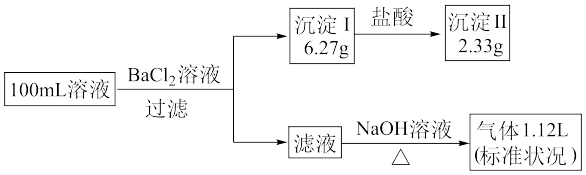
3 . 100mL某溶液可能含有 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种,取该溶液进行连续实验,实验过程如图所示(所加试剂均过量,气体全部逸出)。下列说法错误的是
中的若干种,取该溶液进行连续实验,实验过程如图所示(所加试剂均过量,气体全部逸出)。下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种,取该溶液进行连续实验,实验过程如图所示(所加试剂均过量,气体全部逸出)。下列说法错误的是
中的若干种,取该溶液进行连续实验,实验过程如图所示(所加试剂均过量,气体全部逸出)。下列说法错误的是
A.原溶液中一定不含有 、 、 |
B.原溶液中一定含有 、 、 、 、 |
C.可通过向滤液中加入 溶液来确定原溶液中是否含有 溶液来确定原溶液中是否含有 |
D.原溶液中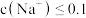 |
您最近一年使用:0次
4 . 向稀硝酸酸化的某溶液中滴加氯化钠溶液,产生白色沉淀,证明原溶液中一定含有
| A.Ba | B. | C.Ag+ | D. |
您最近一年使用:0次
名校
解题方法
5 . 某无色透明溶液中加入 后,有无色无味气体产生,同时产生沉淀。则原溶液中可能含有的离子是
后,有无色无味气体产生,同时产生沉淀。则原溶液中可能含有的离子是
 后,有无色无味气体产生,同时产生沉淀。则原溶液中可能含有的离子是
后,有无色无味气体产生,同时产生沉淀。则原溶液中可能含有的离子是A. | B. | C. | D. |
您最近一年使用:0次
2022-07-07更新
|
1140次组卷
|
12卷引用:人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验
人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验湖南省长沙市周南中学2020-2021学年高一上学期第一次月考化学试题湖南省湘潭电机子弟中学2020-2021学年高一上学期段考化学试题安徽省芜湖市无为市华星学校2020-2021学年高一上学期第二次月考化学试题陕西省咸阳市2021-2022学年高一下学期期末考试化学试题(已下线)第07讲 钠及其氧化物-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )云南省玉溪市通海县第一中学2021—2022学年高一上学期期末考试化学试题广东省佛山市禅城区2022-2023学年高三统一调研测试(一) 化学试题广东省珠海市教研联盟(两校)2022-2023学年高三上学期十月联考化学试题广东省佛山市禅城区2022-2023学年高三上学期统一调研测试(一)化学试题福建省福州市三校2022-2023学年高三上学期期中联考化学试题广东省陆丰市甲子中学2022-2023学年高三上学期第三次月考化学试题
6 . 下列实验能达到目的的是
| 实验目的 | 实验方法或操作 | |
| A | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
| B | 探究浓度对化学反应速率的影响 | 量取同体积不同浓度的 溶液,分别加入等体积等浓度的 溶液,分别加入等体积等浓度的 溶液,对比现象 溶液,对比现象 |
| C | 判断反应后 是否沉淀完全 是否沉淀完全 | 将 溶液与 溶液与 溶液混合,反应后静置,向上层清液中再加1滴 溶液混合,反应后静置,向上层清液中再加1滴 溶液 溶液 |
| D | 检验淀粉是否发生了水解 | 向淀粉水解液中加入碘水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-06更新
|
12547次组卷
|
32卷引用:2022年辽宁高考真题化学试题
2022年辽宁高考真题化学试题(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题43 常见物质的分离、提纯和鉴别-备战2023年高考化学考点微专题(全国版)福建省厦门集美中学2022-2023学年高三上学期10月月考化学试题吉林省延边第二中学2022-2023学年高三上学期第三次阶段测试化学试题(已下线)专题11 化学实验基础(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价(已下线)【知识图鉴】单元讲练测选择性必修3第4单元02基础练(已下线)专题05 突破化学实验基础(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江西省宜春市铜鼓中学2022-2023学年高二下学期第一次段考化学试题(已下线)回归教材重难点10 再现常考化学实验基础知识-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)(已下线)专题14 化学实验方案的设计与评价(已下线)专题14 化学实验方案的设计与评价(已下线)第09练 微型实验设计与评价 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点巩固卷12 化学实验基础(一)(3大考点67题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)实验01 中和反应反应热的测定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)四川省内江市第六中学2023-2024学年高三上学期入学考试化学试题黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期11月月考化学试题(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题北京市第一○一中学2023-2024学年高三下学期统练二化学试题
名校
7 . 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注。回答以下问题:
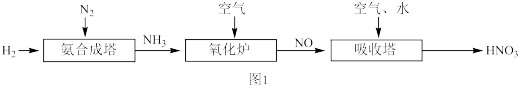
图1是工业上生产 的流程图:
的流程图:
(1)与氮氧化物有关的全球性大气环境问题有_______。
(2)下列有关NH3的说法,不正确的是_______(填字母序号)。
(3) 极易溶于水,在标准状况下,用充满
极易溶于水,在标准状况下,用充满 的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为
的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为_______  。(保留3位有效数字)
。(保留3位有效数字)
(4)工业上常用氨气与硝酸反应制备化肥硝酸铵,写出检验铵根离子的实验方法:_______ 。
化学兴趣小组的同学利用下图进行 的一些性质实验(加热装置略):
的一些性质实验(加热装置略):
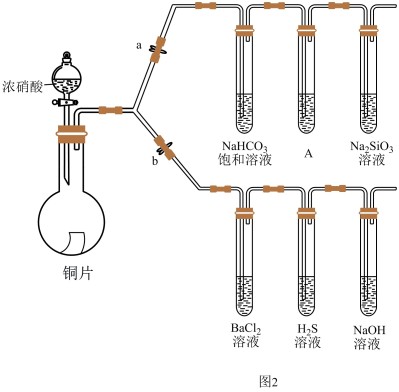
(5)首先,验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、检查装置气密性、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。
②装置A中试剂是_______ 。
③能说明碳的非金属性比硅强的实验现象是:_______ 。
(6)验证 的某些性质。
的某些性质。
①打开b,关闭a。
②硫化氢溶液中看到有淡黄色沉淀, 体现
体现_______ 。(选填“酸性氧化物”、“还原性”、“氧化性”)
③ 溶液中无明显现象,将其分成两份,分别滴加下列溶液,都产生了白色沉淀,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,都产生了白色沉淀,将产生的沉淀的化学式填入下表相应位置。
写出其中 显示还原性生成沉淀的离子方程式:
显示还原性生成沉淀的离子方程式:_______ 。
图1是工业上生产
 的流程图:
的流程图:
(1)与氮氧化物有关的全球性大气环境问题有_______。
| A.酸雨 | B.沙尘暴 | C.光化学烟雾 | D.白色污染 |
A.工业合成 属于人工固氮 属于人工固氮 | B. 易液化,液氨常用作制冷剂 易液化,液氨常用作制冷剂 |
C. 可用浓硫酸或无水氯化钙干燥 可用浓硫酸或无水氯化钙干燥 | D. 制备NO体现了 制备NO体现了 的还原性 的还原性 |
 极易溶于水,在标准状况下,用充满
极易溶于水,在标准状况下,用充满 的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为
的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为 。(保留3位有效数字)
。(保留3位有效数字)(4)工业上常用氨气与硝酸反应制备化肥硝酸铵,写出检验铵根离子的实验方法:
化学兴趣小组的同学利用下图进行
 的一些性质实验(加热装置略):
的一些性质实验(加热装置略):
(5)首先,验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、检查装置气密性、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。
②装置A中试剂是
③能说明碳的非金属性比硅强的实验现象是:
(6)验证
 的某些性质。
的某些性质。①打开b,关闭a。
②硫化氢溶液中看到有淡黄色沉淀,
 体现
体现③
 溶液中无明显现象,将其分成两份,分别滴加下列溶液,都产生了白色沉淀,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,都产生了白色沉淀,将产生的沉淀的化学式填入下表相应位置。| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
写出其中
 显示还原性生成沉淀的离子方程式:
显示还原性生成沉淀的离子方程式:
您最近一年使用:0次
8 . 对于某些常见离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有 |
B.加入盐酸酸化的氯化钡溶液有白色沉淀产生,一定有 |
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蒙试纸变蓝,一定有 |
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有 |
您最近一年使用:0次
名校
解题方法
9 . 化合物X由3种元素组成。某兴趣小组按如下流程进行实验:

已知:A由两种气体组成,且两种气体组成元素相同。请回答下列问题:
(1)X的组成元素有___________ ;X的化学式为___________ 。
(2)固体B的成分是___________ (用化学式表示)
(3)X化学性质相当活泼,1mol X吸收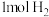 只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式
只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式___________ 。
(4)设计实验证明溶液G中的阳离子___________ 。

已知:A由两种气体组成,且两种气体组成元素相同。请回答下列问题:
(1)X的组成元素有
(2)固体B的成分是
(3)X化学性质相当活泼,1mol X吸收
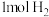 只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式
只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式(4)设计实验证明溶液G中的阳离子
您最近一年使用:0次
2022-06-26更新
|
629次组卷
|
6卷引用:浙江省温州浙南名校联盟2021-2022学年高二下学期期末联考化学试题
浙江省温州浙南名校联盟2021-2022学年高二下学期期末联考化学试题浙江省舟山市普陀中学2023届高三返校考试化学试题(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷C 浙江省宁波市余姚中学2022-2023学年高二下学期3月月考化学试题 浙江省杭州市临平区杭州二中树兰高级中学2022-2023学年高二下学期第一次调研化学试题 (已下线)2019年高考浙江卷化学试题变式题(物质组成的测定)
10 . 磷酸亚铁锂(LiFePO4)是生产锂电池的重要材料。实验室中用下图装置制备LiFePO4:在仪器A中加入40mL蒸馏水、少量抗坏血酸,再加入0.01molH3PO4和0.01molFeSO4·7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH·H2O,继续搅拌5min。快速将反应液装入反应釜中,保持170℃恒温5h。
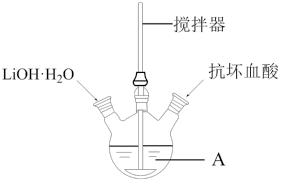
(1)仪器A的名称是_______ ;实验所用蒸馏水若未经煮沸直接使用,则可能发生反应的离子方程式为_______ 。
(2)实验中可用Na2SO3代替抗坏血酸,其原理是_______ (用离子方程式表示);不能用铁粉代替抗坏血酸的原因是_______ 。
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是将反应液冷却至室温,_______ 、用蒸馏水洗涤沉淀、_______ 。
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是_______ 。
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率为_______ %(保留小数点后1位)。

(1)仪器A的名称是
(2)实验中可用Na2SO3代替抗坏血酸,其原理是
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是将反应液冷却至室温,
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率为
您最近一年使用:0次



