1 . 某小组按如图装置探究氯气和双氧水的反应。将注射器中的浓盐酸注入试管中,在盛NaOH溶液的试管中收集到无色气体,该气体可以使带火星的木条复燃。下列说法错误的是


| A.饱和食盐水的作用是除去氯气中的HCl |
| B.NaOH溶液不可以用水代替 |
| C.由反应H2O2+Cl2=2HCl+O2可证明非金属性:Cl>O |
| D.仅根据此实验现象无法证明一定是氯气氧化了H2O2 |
您最近一年使用:0次
2021-05-13更新
|
846次组卷
|
6卷引用:河南省洛阳市第一高级中学2023届高三上学期8月调研考试化学试题
河南省洛阳市第一高级中学2023届高三上学期8月调研考试化学试题河南省郑州市2021届高三下学期第三次质量预测理综化学试题(已下线)第12讲 富集在海水中的元素——卤素(精练)-2022年高考化学一轮复习讲练测浙江省吴兴高级中学2021-2022学年高一下学期学考模拟化学试题 湖南省湘东名校2022-2023学年高三上学期第一次联考化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
2 . 为检验溶液中是否含有Cl⁻,某同学向溶液中先加HNO3,再加AgNO3,若有白色沉淀生成,则证明有Cl⁻。对此结论,有人提出了质疑:溶液中可能有SO ,并设计了如下探究性实验。
,并设计了如下探究性实验。
实验一:向Na2SO4溶液中滴加AgNO3溶液
(1)实验一中产生沉淀的离子方程式为_______ 。
(2)已知:25℃时,Ksp(Ag2SO4)=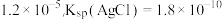 实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO
实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO )理论上至少需达到
)理论上至少需达到_______ mol·L-1。若向1mL某浓度的NaCl与Na2SO4的混合溶液中加入3滴 溶液,分析上面数据,下列说法正确的是
溶液,分析上面数据,下列说法正确的是_______ (填标号)。
A.混合液中 时不会产生Ag2SO4沉淀
时不会产生Ag2SO4沉淀
B.混合液中 时不会产生Ag2SO4沉淀
时不会产生Ag2SO4沉淀
C.无论SO 浓度大小,都会产生Ag2SO4沉淀
浓度大小,都会产生Ag2SO4沉淀
D.若使用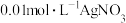 溶液,可基本排除SO
溶液,可基本排除SO 对Cl⁻检验构成的干扰
对Cl⁻检验构成的干扰
将实验一编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。
实验二:
(3)对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设二。
假设一:NO 对Ag2SO4溶解起作用。
对Ag2SO4溶解起作用。
假设二:_______ 。
(4)选择合适的试剂并设计实验方案,分别验证假设一和假设二是否成立。请补充完整实验操作和现象。
(5)通过(4)的实验,请用平衡理论解释Ag2SO4溶解的原因:_______ 。(已知:H2SO4=H++HSO 、HSO
、HSO =H++SO
=H++SO )
)
 ,并设计了如下探究性实验。
,并设计了如下探究性实验。实验一:向Na2SO4溶液中滴加AgNO3溶液
| 编号 | Na2SO4溶液 | AgNO3溶液 | 混合后Ag+浓度/(mol·L-1) | 现象 | ||
| 体积/mL | 浓度/(mol·L-1) | 体积/滴 | 浓度/(mol·L-1) | |||
| ① | 1 | 1 | 3 | 2 | 0.2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3 | 0.5 | 0.05 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3 | 0.1 | 0.01 | 有些许浑浊 |
| ④ | 1 | 1 | 3 | 0.01 | 0.001 | 无明显变化 |
(2)已知:25℃时,Ksp(Ag2SO4)=
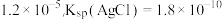 实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO
实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO )理论上至少需达到
)理论上至少需达到 溶液,分析上面数据,下列说法正确的是
溶液,分析上面数据,下列说法正确的是A.混合液中
 时不会产生Ag2SO4沉淀
时不会产生Ag2SO4沉淀B.混合液中
 时不会产生Ag2SO4沉淀
时不会产生Ag2SO4沉淀C.无论SO
 浓度大小,都会产生Ag2SO4沉淀
浓度大小,都会产生Ag2SO4沉淀D.若使用
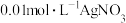 溶液,可基本排除SO
溶液,可基本排除SO 对Cl⁻检验构成的干扰
对Cl⁻检验构成的干扰将实验一编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。
实验二:
| 编号 | AgNO3溶液浓度/(mol·L-1) | 现象 | 滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
假设一:NO
 对Ag2SO4溶解起作用。
对Ag2SO4溶解起作用。假设二:
(4)选择合适的试剂并设计实验方案,分别验证假设一和假设二是否成立。请补充完整实验操作和现象。
| 步骤 | 操作 | 现象 | 结论 |
| 步骤① | 取少量Ag2SO4于试管中,加入2mL水,振荡 | 固体不溶解 | |
| 步骤② | 将①的浊液分成两等份 | ||
| 步骤③ | 向其中一份加入1mL0.1mol·L-1NaNO3溶液,振荡 | 假设一不成立 | |
| 步骤④ | 向另一份加入 | 假设二成立 |
 、HSO
、HSO =H++SO
=H++SO )
)
您最近一年使用:0次
2023-07-06更新
|
93次组卷
|
2卷引用:河南省洛阳市创新发展联盟2023-2024学年高三上学期7月阶段性考试化学试题
名校
3 . 铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】1.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。2.KSCN中的硫元素为-2价。
实验I.检验该补铁剂中铁元素的价态。
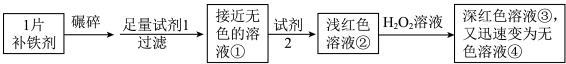
(1)将补铁剂碾碎的目的是_______ 。
(2)试剂1是_______ 。
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有_______ 。
(4)能证明溶液①中含有Fe2+的实验现象是_______ 。
(5)在上述条件下Fe2+与H2O2发生反应的离子方程式:_______ 。
(6)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是_______ 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是_______ 。
实验Ⅱ.测定该补铁剂中铁元素的含量。

(7)计算每片该补铁剂含铁元素的质量分数为_______ 。
【查阅资料】1.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。2.KSCN中的硫元素为-2价。
实验I.检验该补铁剂中铁元素的价态。

(1)将补铁剂碾碎的目的是
(2)试剂1是
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有
(4)能证明溶液①中含有Fe2+的实验现象是
(5)在上述条件下Fe2+与H2O2发生反应的离子方程式:
(6)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是
实验Ⅱ.测定该补铁剂中铁元素的含量。

(7)计算每片该补铁剂含铁元素的质量分数为
您最近一年使用:0次
4 . 实验室用二氧化锰与浓盐酸作为原料制取氯气,某同学利用此原理制氯气并设计了如图所示的实验装置。
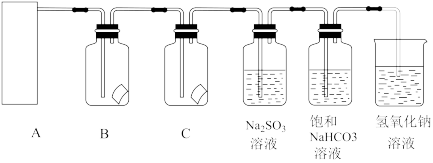
请回答下列问题:
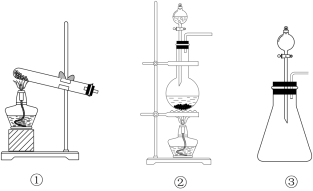
(1)从①、②、③装置中选择合适的制气装置(A处)_______ (填写序号)。
(2)写出A处的离子反应方程_______ 。
(3)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是_______ ,说明该装置存在明显的缺陷,合理的改进方法是_______ 。
(4)甲同学用一定量的浓盐酸与足量的 反应制
反应制 ,结果制得的
,结果制得的 体积比理论上应制得的体积小,这是由于反应过程中盐酸浓度变小造成的。请列举2条导致盐酸浓度变小的原因:
体积比理论上应制得的体积小,这是由于反应过程中盐酸浓度变小造成的。请列举2条导致盐酸浓度变小的原因:_______ 。
(5)将新制氯水逐滴滴入到含有酚酞氢氧化钠溶液中,红色褪去,其原因可能是:
①氢氧化钠溶液中的氢氧根被氯水中的酸中和,溶液不再显碱性;
②_______ 。取褪色后的溶液,加入_______ ,若溶液不能恢复红色,说明原因是_______ (填“①”或“②”)。
(6)氯气通入饱和 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有_______ (填“盐酸”或“次氯酸”)。
(7) 是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
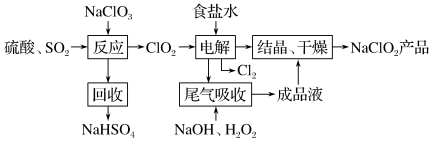
① 中Cl的化合价为
中Cl的化合价为_______ 。
②写出“反应”步骤中生成 的化学方程式
的化学方程式_______ 。

请回答下列问题:
(1)从①、②、③装置中选择合适的制气装置(A处)

(2)写出A处的离子反应方程
(3)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(4)甲同学用一定量的浓盐酸与足量的
 反应制
反应制 ,结果制得的
,结果制得的 体积比理论上应制得的体积小,这是由于反应过程中盐酸浓度变小造成的。请列举2条导致盐酸浓度变小的原因:
体积比理论上应制得的体积小,这是由于反应过程中盐酸浓度变小造成的。请列举2条导致盐酸浓度变小的原因:(5)将新制氯水逐滴滴入到含有酚酞氢氧化钠溶液中,红色褪去,其原因可能是:
①氢氧化钠溶液中的氢氧根被氯水中的酸中和,溶液不再显碱性;
②
(6)氯气通入饱和
 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有(7)
 是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
①
 中Cl的化合价为
中Cl的化合价为②写出“反应”步骤中生成
 的化学方程式
的化学方程式
您最近一年使用:0次
5 . 某研究小组用如图装置制取SO2并对其性质进行相关实验(夹持装置已略去)。

回答下列问题:
(1)D中观察到的现象是____ ;B、C、D三支试管中的现象分别体现了SO2的漂白性、____ 性和____ 性。
(2)写出C中反应的离子方程式:____ 。
(3)仪器X的名称是____ ;E装置的作用是____ ,E装置中发生反应的化学方程式为____ 。
(4)实验结束发现装置A中Y型试管产生白色固体,倾斜使左侧的物质全部转移到右侧水中,这时看到溶液的颜色为____ 色。
(5)该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明通入SO2后反应生成了SO 。该做法
。该做法____ (填“合理”或“不合理”),理由是____ 。

回答下列问题:
(1)D中观察到的现象是
(2)写出C中反应的离子方程式:
(3)仪器X的名称是
(4)实验结束发现装置A中Y型试管产生白色固体,倾斜使左侧的物质全部转移到右侧水中,这时看到溶液的颜色为
(5)该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明通入SO2后反应生成了SO
 。该做法
。该做法
您最近一年使用:0次
6 . 在研究物质的性质时,可以从物质类别、物质所含核心元素的化合价这两个基本角度预测物质可能具有的性质,并通过实验进行验证。
(1)已知某铝土矿的主要成分由Al2O3、SiO2、Fe2O3,组成。从物质类别的角度判断,SiO2属于_______ 氧化物(填“酸性”、“碱性”或“两性”)。从铝土矿中分离Al2O3的过程如图所示,则试剂甲、乙、丙分别是_______ (填字母)。
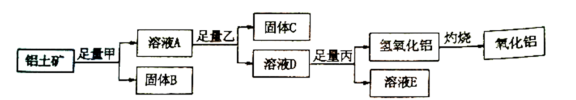
a.烧碱、盐酸、二氧化碳 b.烧碱、盐酸、氨水
c.盐酸、烧碱、氨水 d.盐酸、烧碱、二氧化碳
(2)某化学研究小组根据H2O2中氧元素的化合价,预测H2O2性质,并设计如图实验进行验证。
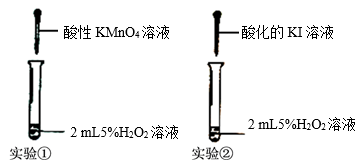
I.实验①证明酸性KMnO4溶液与H2O2反应的现象除了溶液颜色变浅或褪色外,还有_______ 。
II.实验②在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式:_______ 。以上实验可得出H2O2具有的性质是_______ 。
(3)某同学猜测Fe3+可以与S2-发生反应,为验证其猜测,他结合资料信息,选择了试剂FeCl3和Na2S进行实验,确认了Fe3+与S2-能发生反应。
资料:部分硫化物的溶解性表(室温)
可能发生的两种不同原理的反应的离子方程式是_______ 、_______ 。
(1)已知某铝土矿的主要成分由Al2O3、SiO2、Fe2O3,组成。从物质类别的角度判断,SiO2属于

a.烧碱、盐酸、二氧化碳 b.烧碱、盐酸、氨水
c.盐酸、烧碱、氨水 d.盐酸、烧碱、二氧化碳
(2)某化学研究小组根据H2O2中氧元素的化合价,预测H2O2性质,并设计如图实验进行验证。

I.实验①证明酸性KMnO4溶液与H2O2反应的现象除了溶液颜色变浅或褪色外,还有
II.实验②在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式:
(3)某同学猜测Fe3+可以与S2-发生反应,为验证其猜测,他结合资料信息,选择了试剂FeCl3和Na2S进行实验,确认了Fe3+与S2-能发生反应。
资料:部分硫化物的溶解性表(室温)
| 化学式 | 溶解性 |
| Na2S | 可溶 |
| Fe2S3 | 不溶,在热水或酸中分解 |
| FeS | 不溶 |
您最近一年使用:0次
7 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
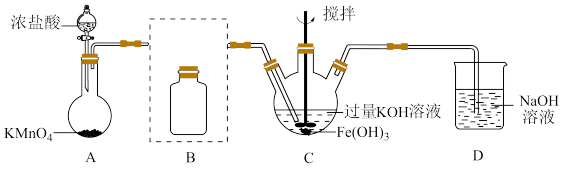
①A为氯气发生装置。A中反应方程式是________________ (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有________________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2________  (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是________________ 。
③资料表明,酸性溶液中的氧化性 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH
 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
2018-06-09更新
|
9672次组卷
|
31卷引用:河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题
河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题(已下线)高考母题题源18 化学实验设计与探究(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019年高考总复习巅峰冲刺-专题03 氧化还原反应 离子反应应试策略(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 高考帮(已下线)易错22 气体实验装置的设计-备战2021年高考化学一轮复习易错题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第7讲 铁及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)天津市耀华中学2023届高三第一次统练化学试题云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题第三章 金属及其化合物 第14讲 铁及其化合物的转化关系(已下线)第一部分 化学综合实验 热点6 物质性质探究实验北京一零一中学2023-2024学年高一上学期11月统练三化学试卷河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题
14-15高三上·四川成都·阶段练习
名校
解题方法
8 . 为验证氧化性Cl2>Fe3+> SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
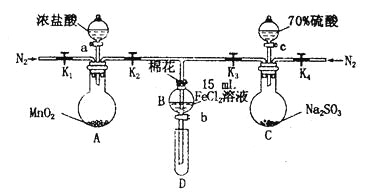
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程I的目的是______________________________________________________________________________ 。
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式___________________________________________________________________________________________________________________________________________________ 。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式_____________________________________________________________ 。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为________ 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是_____________________________ (填“甲”、“乙”或“丙”)。
(6)将B中的FeCl2溶液换成100 mLFeBr2溶液并向其中通入1.12 LCl2(标准状况下),若溶液中有1/2的Br一被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________ mol/L。

实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程I的目的是
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是
| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(6)将B中的FeCl2溶液换成100 mLFeBr2溶液并向其中通入1.12 LCl2(标准状况下),若溶液中有1/2的Br一被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
您最近一年使用:0次
2016-12-09更新
|
725次组卷
|
6卷引用:2016届河南省洛阳市高三上学期期中考试化学试卷
名校
解题方法
9 . 如图所示进行实验,下列说法不正确的是
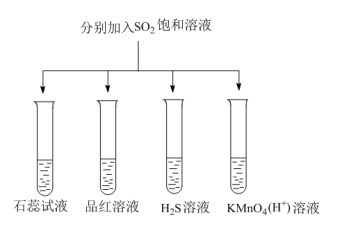

A.石蕊试液变红说明 溶于水所形成的溶液显酸性 溶于水所形成的溶液显酸性 |
| B.品红溶液、酸性高锰酸钾溶液褪色原因不相同 |
C. 溶液中出现淡黄色沉淀,该反应体现了 溶液中出现淡黄色沉淀,该反应体现了 的还原性 的还原性 |
D.该实验说明 的性质具有多样性 的性质具有多样性 |
您最近一年使用:0次
2023-03-11更新
|
431次组卷
|
2卷引用:河南省洛阳市宜阳县第一高级中学2022-2023学年高一下学期3月月考化学试题
11-12高一下·陕西西安·期末
名校
解题方法
10 . 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸反应的产物。下列有关说法不正确的是
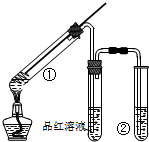

| A.浓硫酸既表现了强氧化性,又表现了酸性 |
| B.品红溶液的作用是吸收SO2,防止空气污染 |
| C.该实验体现环境保护和节约化学试剂的理念 |
| D.装置②中盛放的试剂可能是NaOH溶液 |
您最近一年使用:0次
2021-05-24更新
|
180次组卷
|
7卷引用:2012-2013学年河南省偃师高级中学高一下学期第二次月考化学试卷
(已下线)2012-2013学年河南省偃师高级中学高一下学期第二次月考化学试卷(已下线)2011-2012学年陕西省长安一中高一下学期期末考试化学试卷浙江省金华市云富高级中学2020-2021学年高一3月月考化学试题(已下线)【浙江新东方】高中化学20210513-047【2021】【高一下】甘肃省玉门油田第一中学2021-2022学年高一下学期4月月考化学试题贵州省黔西南州同源中学2021-2022学年高一下学期第一次月考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高一下学期4月月考化学试题



